- 182.87 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
www.ks5u.com
第2节 金属晶体与离子晶体
第1课时 金属晶体
一、非标准
1.下列叙述正确的是( )
①同周期金属元素的原子半径越大晶体熔点越高 ②同周期金属元素的原子半径越小晶体熔点越高 ③同主族金属元素的原子半径越大晶体熔点越高 ④同主族金属元素的原子半径越小晶体熔点越高
A.①③ B.②④ C.①④ D.③④
解析:同周期从左向右,金属元素原子(或离子)半径逐渐减小,而价层电子数逐渐增多,金属键逐渐增强,晶体的熔点逐渐升高;同主族自上而下,金属元素原子(或离子)半径逐渐增大,而价电子数相同,金属键逐渐减弱,晶体的熔点逐渐降低。
答案:B
2.关于金属元素的特征,下列叙述正确的是( )
①金属元素的原子只有还原性,离子只有氧化性 ②金属元素在化合物中一般显正价 ③金属性越强的元素相应的离子氧化性越弱 ④金属元素只有金属性,没有非金属性 ⑤价电子数越多的金属原子的金属性越强
A.①②③ B.②③
C.①⑤ D.①②③④⑤
解析:①中的金属若为变价元素,则可能既有氧化性又有还原性,如Fe2+。④中有些金属元素既有金属性又有非金属性。⑤中的价电子数多少与金属性无关。
答案:B
3.下列关于金属晶体的叙述中正确的是( )
A.常温下,金属单质都以金属晶体形式存在
B.金属离子与自由电子之间的强烈作用,在一定外力作用下,不因形变而消失
C.钙的熔、沸点低于钾
D.温度越高,金属的导电性越好
解析:常温下,Hg为液态,A错;因为金属键无方向性,故金属键在一定范围内不因形变而消失,B正确;钙的金属键强于钾,故熔沸点高于钾,C错;温度高,金属的导电性减弱,D错。
答案:B
4.金属原子在二维平面里的放置有如下图所示的两种方式,下列说法中正确的是( )
A.图(a)为非密置层,配位数为6
B.图(b)为密置层,配位数为4
C.图(a)在三维空间里堆积可得到镁型和铜型
D.图(b)在三维空间里堆积仅得到简单立方堆积
解析:密置层堆积的空间利用率高,原子的配位数为6,非密置层的配位数较密置层小,配位数为4。由此可知,图(a)为密置层,图(b)为非密置层。密置层在三维空间堆积可得到镁型和铜型两种堆积模型,非密置层在三维空间堆积可得到简单立方堆积和钾型两种堆积模型。
答案:C
5.下列关于金属性质及具有此性质原因的描述中不正确的是( )
A.金属一般具有银白色光泽,是物理性质,与金属键没有关系
B.金属具有良好的导电性,是由于在外电场作用下自由电子定向移动
C.金属具有良好的导热性,是由于自由电子受热后,运动速率增大,自由电子频繁与金属离子发生碰撞,传递了能量
D.金属晶体具有良好的延展性,是因为金属晶体中的原子层发生相对滑动时金属键不被破坏
解析:金属晶体内部存在自由电子,当光线投射到金属表面时,自由电子吸收所有频率的光,然后很快放出各种频率的光,这就使绝大多数的金属呈现银白色光泽。金属键是金属阳离子和自由电子间的强烈的相互作用,金属一般都具有金属光泽的性质正是由于金属键的构成微粒在起作用,与金属键有密切关系。
答案:A
6.金属具有延展性的原因是( )
A.金属原子半径都较大,价电子数较少
B.金属受外力作用变形时,金属阳离子与自由电子间仍保持较强烈的作用
C.金属中大量自由电子受外力作用时,运动速率加快
D.自由电子受外力作用时能迅速传递能量
解析:金属的延展性是因为金属晶体形成的作用是金属离子与自由电子之间的金属键,当金属发生形变时,金属离子与自由电子间的作用依然存在,所以不会发生断裂,即金属具有良好的延展性。
答案:B
7.某物质熔融状态可导电,固态可导电,将其投入水中,水溶液也可导电,则可推测该物质可能是( )
A.金属 B.非金属
C.可溶性碱 D.可溶性盐
解析:由固态导电可排除C、D,熔融状态可导电排除B。
答案:A
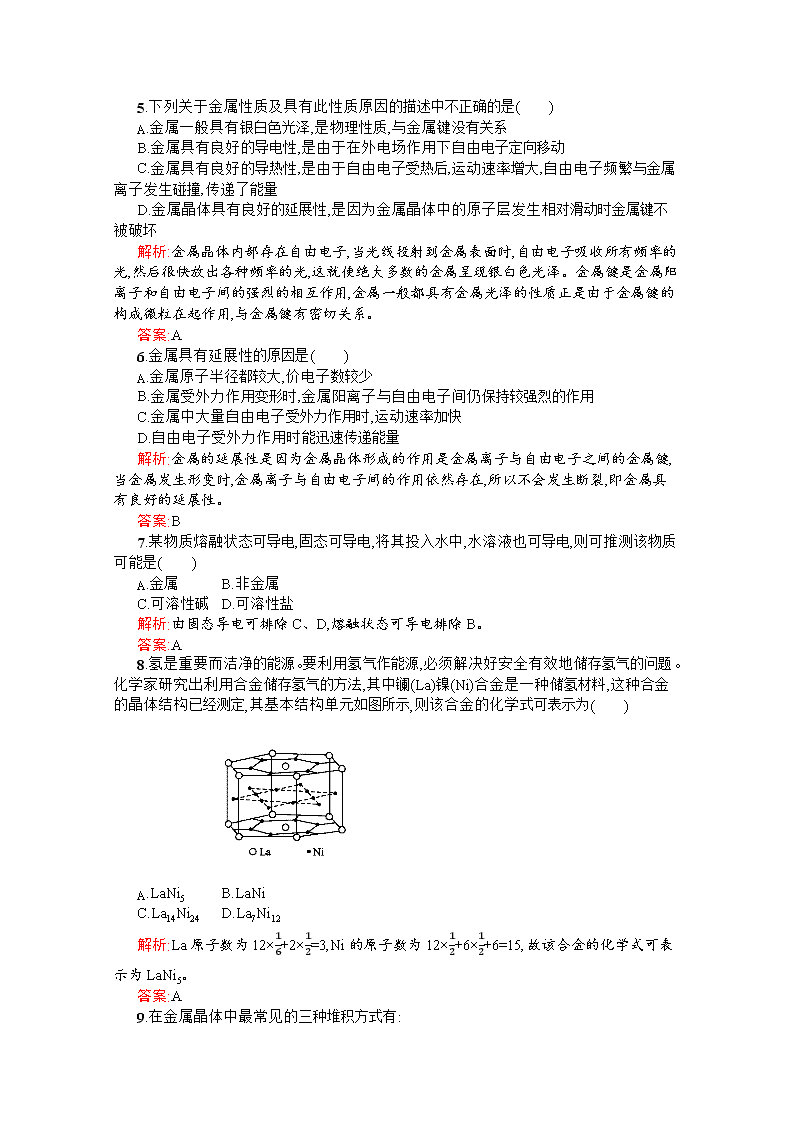
8.氢是重要而洁净的能源。要利用氢气作能源,必须解决好安全有效地储存氢气的问题。化学家研究出利用合金储存氢气的方法,其中镧(La)镍(Ni)合金是一种储氢材料,这种合金的晶体结构已经测定,其基本结构单元如图所示,则该合金的化学式可表示为( )
A.LaNi5 B.LaNi
C.La14Ni24 D.La7Ni12
解析:La原子数为12×16+2×12=3,Ni的原子数为12×12+6×12+6=15,故该合金的化学式可表示为LaNi5。
答案:A
9.在金属晶体中最常见的三种堆积方式有:
(1)配位数为8的是 堆积。
(2)配位数为 的是面心立方堆积。
(3)配位数为 的是 堆积。其中以…ABAB…方式堆积的 和以…ABCABC…方式堆积的 空间利用率相等,就堆积层来看,二者的区别是在第 层。
解析:要熟记金属晶体中最常见的三种堆积方式中,各种堆积方式的不同特点。
答案:(1)体心立方
(2)12
(3)12 六方 六方堆积 面心立方堆积 三
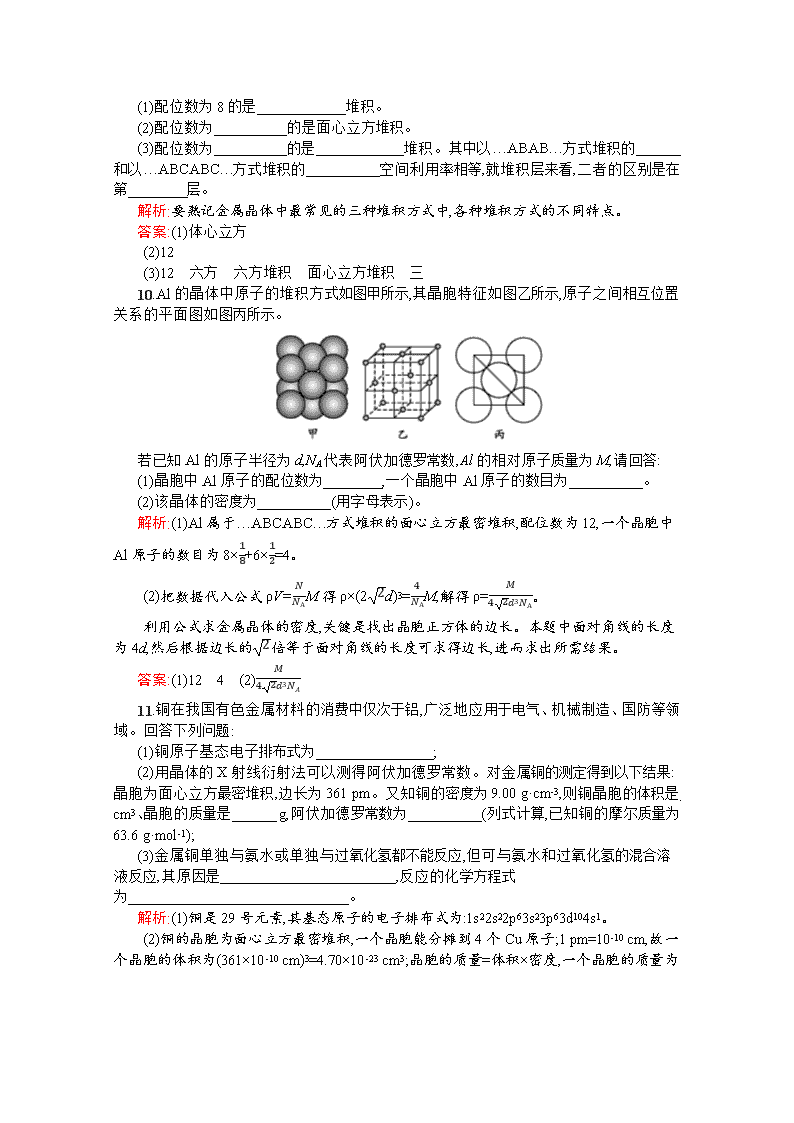
10.Al的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,请回答:
(1)晶胞中Al原子的配位数为 ,一个晶胞中Al原子的数目为 。
(2)该晶体的密度为 (用字母表示)。
解析:(1)Al属于…ABCABC…方式堆积的面心立方最密堆积,配位数为12,一个晶胞中Al原子的数目为8×18+6×12=4。
(2)把数据代入公式ρV=NNAM得ρ×(22d)3=4NAM,解得ρ=M42d3NA。
利用公式求金属晶体的密度,关键是找出晶胞正方体的边长。本题中面对角线的长度为4d,然后根据边长的2倍等于面对角线的长度可求得边长,进而求出所需结果。
答案:(1)12 4 (2)M42d3NA
11.铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。回答下列问题:
(1)铜原子基态电子排布式为 ;
(2)用晶体的X射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361 pm。又知铜的密度为9.00 g·cm-3,则铜晶胞的体积是 cm3、晶胞的质量是 g,阿伏加德罗常数为 (列式计算,已知铜的摩尔质量为63.6 g·mol-1);
(3)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是 ,反应的化学方程式为 。
解析:(1)铜是29号元素,其基态原子的电子排布式为:1s22s22p63s23p63d104s1。
(2)铜的晶胞为面心立方最密堆积,一个晶胞能分摊到4个Cu原子;1 pm=10-10 cm,故一个晶胞的体积为(361×10-10 cm)3=4.70×10-23 cm3;晶胞的质量=体积×密度,一个晶胞的质量为
4.70×10-23 cm3×9.00 g·cm-3=4.23×10-22 g;一个体心晶胞含4个铜原子,故铜的摩尔质量=14×晶胞质量×NA,得NA=6.01×1023 mol-1。
(3)题中给出了两物质和铜单独不反应,而同时混合能反应,说明两者能互相促进,这是两种物质共同作用的结果:其中过氧化氢为氧化剂,氨与Cu2+形成配离子,两者相互促进使反应进行;方程式可表示为:Cu+H2O2+4NH3[Cu(NH3)4]2++2OH-。
答案:(1)1s22s22p63s23p63d104s1
(2)4.70×10-23 4.23×10-22
NA=63.6 g·mol-1×44.23×10-22g=6.01×1023 mol-1
(3)过氧化氢为氧化剂,氨与Cu形成配离子,两者相互促进使反应进行 Cu+H2O2+4NH3
[Cu(NH3)4]2++2OH-
12.在核电荷数1~18的元素中,其单质属于金属晶体的有 ,这些金属晶体中,密度最小的是 ,地壳中含量最多的是 ,熔点最低的是 ,既能与酸又能与碱反应的是 ,单质的还原性最强的是 。
解析:金属元素在周期表中的位置一般可根据周期、族和主族序数来推断。凡是周期序数大于主族序数的元素为金属元素。而两序数相等的元素一般为既能与酸又能与碱反应的金属元素。周期序数小于主族序数的元素一般为非金属元素。
答案:Li、Be、Na、Mg、Al Li Al Na Al Na
相关文档
- 高中化学第三章晶体结构与性质第三2021-08-236页
- 2019-2020学年高二人教版化学选修2021-08-236页
- 新人教版高二化学选修3:3_3金属晶体2021-08-233页
- 2020高中化学 金属晶体 离子晶体(提2021-08-2311页
- 2020高中化学 金属晶体 离子晶体(提2021-08-075页
- 新人教版高二化学选修3:3_3金属晶体2021-08-064页
- 2020版高中化学课时作业9金属晶体2021-08-069页
- 2020版高中化学 第3章第2节 金属晶2021-08-0613页
- 人教版高中化学选修三教案3_3 金属2021-08-063页
- 2020届高考化学一轮复习金属键和金2021-08-0637页