- 314.08 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题能力训练8 常见的非金属元素及其化合物
(时间:45分钟 满分:100分)
一、选择题(共7小题,每小题6分,共42分。每小题只有1个选项符合题意)
1.某消毒液的主要成分为NaClO,还含有一定量的NaOH。下列用来解释事实的方程式中,不合理的是(已知:饱和NaClO溶液的pH约为11)( )
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-ClO-+Cl-+H2O
B.该消毒液的pH约为12:ClO-+H2OHClO+OH-
C.该消毒液与洁厕灵(主要成分为HCl)混用,产生有毒Cl2:2H++Cl-+ClO-Cl2↑+H2O
D.该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO-HClO+CH3COO-
答案:B
解析:A项,氢氧化钠溶液吸收氯气生成次氯酸钠、氯化钠和水,即可制得消毒液,A正确;B项,由于饱和次氯酸钠溶液的pH=11,如果消毒液的pH=12,这是由于氢氧化钠电离出氢氧根离子,导致氢氧根浓度增大,B错误;C项,次氯酸钠具有强氧化性,在酸性条件下,能把氯离子氧化为氯气,C正确;D项,次氯酸的漂白性强于次氯酸钠,因此消毒液中加白醋生成次氯酸后,可增强漂白作用,D正确。
2.下列实验过程中,始终无明显现象的是( )
A.NO2通入FeSO4溶液中
B.CO2通入CaCl2溶液中
C.NH3通入AgNO3溶液中
D.SO2通入Ba(NO3)2溶液中
答案:B
解析:A项,二氧化氮和水反应生成硝酸和一氧化氮,硝酸氧化Fe2+,溶液从浅绿色变为棕黄色;B项,二氧化碳和氯化钙不反应,没有明显现象;C项,氨气通到硝酸银溶液中先生成氢氧化银沉淀,继续通入NH3沉淀溶解;D项,二氧化硫通入水中形成亚硫酸,在酸性条件下NO3-氧化亚硫酸生成硫酸,进而生成硫酸钡白色沉淀。
3.下列有关物质性质与用途具有对应关系的是( )
A.Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂
B.ClO2具有还原性,可用于自来水的杀菌消毒
C.SiO2硬度大,可用于制造光导纤维
D.NH3易溶于水,可用作制冷剂
答案:A
解析:A项,人呼出气体中含有的CO2可与Na2O2反应生成O2,故Na2O2可用作呼吸面具的供氧剂,正确;B项,ClO2具有强氧化性,可以用于自来水的杀菌消毒,错误;C项,SiO2可用于制造光导纤维不是因为其硬度大,两者无对应关系,错误;D项,NH3易液化,是其可用作制冷剂的原因,错误。
4.海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示),下列有关说法正确的是( )
A.第①步除去粗盐SO42-、Ca2+、Mg2+、Fe3+等杂质离子,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
- 6 -
B.将第②步结晶出的MgCl2·6H2O可在HCl气流中加热分解制无水MgCl2
C.在第③④⑤步中溴元素均被氧化
D.第⑤步涉及的分离操作有过滤、萃取、蒸馏
答案:B
解析:A选项,Na2CO3溶液的作用是除去Ca2+和过量的Ba2+,所以Na2CO3溶液应在BaCl2溶液之后加入,错误;B选项,MgCl2·6H2O在空气中加热水解生成Mg(OH)2,最终生成MgO,在HCl气流中可防止其水解,正确;C选项,第④步溴元素被SO2还原,错误;D选项,不需要过滤,错误。
5.下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
①
②
③
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸产生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
答案:D
解析:图①中产生的红棕色气体应为NO2和O2的混合气体,原因是灼热的碎玻璃促进了硝酸的分解,A项正确;图②中的气体可能是红热的木炭促进了硝酸分解生成的,也可能是木炭与浓硝酸反应生成的,B项正确;图③中,由于红热的木炭没有插入浓硝酸中,但仍有红棕色气体产生,说明浓硝酸具有挥发性,生成的红棕色气体NO2为还原产物,C项正确;图③中气体产物中的二氧化碳也可能是硝酸分解产生的O2与红热的木炭反应生成的,D项错误。
6.在给定的条件下,下列选项所示的物质间转化均能实现的是( )
A.FeFeCl2Fe(OH)2
B.H2SiO3SiO2SiCl4
C.浓盐酸Cl2漂白粉
D.NH3NOHNO3
答案:C
7.向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种离子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法正确的是( )
A.线段Ⅱ表示Br-的变化情况
B.原溶液中n(FeI2)∶n(FeBr2)=3∶1
- 6 -
C.根据图像无法计算a的值
D.线段Ⅳ表示IO3-的变化情况
答案:D
解析:向含Fe2+、I-、Br-的溶液中通入过量的氯气,依据还原性:I->Fe2+>Br-可知,I-、Fe2+、Br-依次被氧化,则Ⅰ、Ⅱ、Ⅲ分别代表I-、Fe2+、Br-的变化情况,A项错误;根据图像横坐标,可以计算出n(I-)=2 mol,n(Fe2+)=4 mol,根据电荷守恒可知n(Br-)=6 mol,Br-消耗3 mol氯气,则a=6,原溶液中n(FeI2)∶n(FeBr2)=1∶3,B、C项错误;已知b-a=5,说明在a~b段参与反应的I2与Cl2的物质的量之比为1∶5,线段Ⅳ表示Cl2与I2反应生成的IO3-的变化情况,D项正确。
二、非选择题(共3小题,共58分)
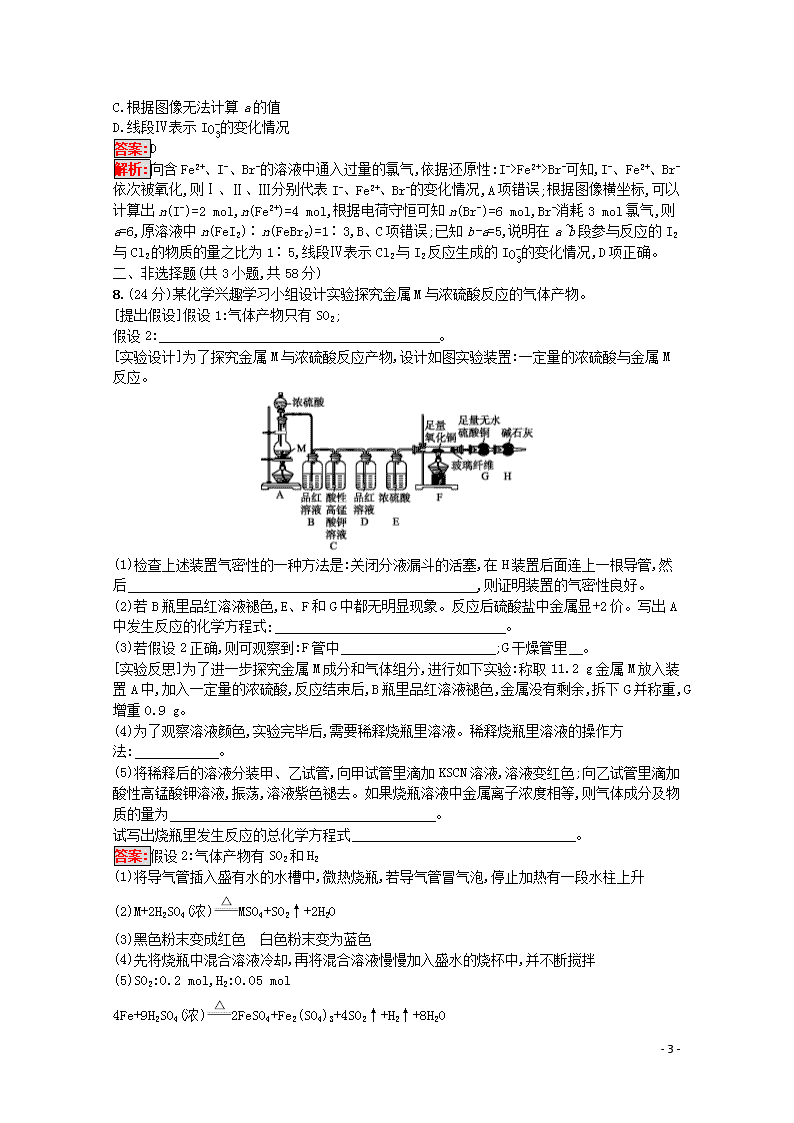
8.(24分)某化学兴趣学习小组设计实验探究金属M与浓硫酸反应的气体产物。
[提出假设]假设1:气体产物只有SO2;
假设2: 。
[实验设计]为了探究金属M与浓硫酸反应产物,设计如图实验装置:一定量的浓硫酸与金属M反应。
(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在H装置后面连上一根导管,然后 ,则证明装置的气密性良好。
(2)若B瓶里品红溶液褪色,E、F和G中都无明显现象。反应后硫酸盐中金属显+2价。写出A中发生反应的化学方程式: 。
(3)若假设2正确,则可观察到:F管中 ;G干燥管里 。
[实验反思]为了进一步探究金属M成分和气体组分,进行如下实验:称取11.2 g金属M放入装置A中,加入一定量的浓硫酸,反应结束后,B瓶里品红溶液褪色,金属没有剩余,拆下G并称重,G增重0.9 g。
(4)为了观察溶液颜色,实验完毕后,需要稀释烧瓶里溶液。稀释烧瓶里溶液的操作方法: 。
(5)将稀释后的溶液分装甲、乙试管,向甲试管里滴加KSCN溶液,溶液变红色;向乙试管里滴加酸性高锰酸钾溶液,振荡,溶液紫色褪去。如果烧瓶溶液中金属离子浓度相等,则气体成分及物质的量为 。
试写出烧瓶里发生反应的总化学方程式 。
答案:假设2:气体产物有SO2和H2
(1)将导气管插入盛有水的水槽中,微热烧瓶,若导气管冒气泡,停止加热有一段水柱上升
(2)M+2H2SO4(浓)MSO4+SO2↑+2H2O
(3)黑色粉末变成红色 白色粉末变为蓝色
(4)先将烧瓶中混合溶液冷却,再将混合溶液慢慢加入盛水的烧杯中,并不断搅拌
(5)SO2:0.2 mol,H2:0.05 mol
4Fe+9H2SO4(浓)2FeSO4+Fe2(SO4)3+4SO2↑+H2↑+8H2O
- 6 -
解析:浓硫酸具有强氧化性,与金属发生氧化还原反应生成二氧化硫气体,但是随着反应的进行,浓硫酸变稀,与金属反应就会产生氢气;故假设2:气体产物有SO2和H2。
(1)检查题述装置气密性的一种方法是:关闭分液漏斗的活塞,在H装置后面连上一根导管,将导气管插入盛有水的水槽中,微热烧瓶,若导气管冒气泡,停止加热有一段水柱上升,则证明装置的气密性良好。
(2)若B瓶里品红溶液褪色,E、F和G中都无明显现象,说明只生成了二氧化硫气体,化学方程式:M+2H2SO4(浓)MSO4+SO2↑+2H2O。
(3)若假设2正确,则可观察到:F管中黑色粉末变成红色(氢气还原氧化铜);G干燥管里白色粉末变为蓝色(还原产物水使无水硫酸铜变蓝)。
(4)稀释烧瓶里溶液的操作方法:先将烧瓶中混合溶液冷却,再将混合液慢慢加入盛水的烧杯里,并不断搅拌,注意不能用烧瓶进行直接稀释。
(5)根据特征反应,该金属是铁,反应后离子是铁离子和亚铁离子,浓度相等,设其物质的量均为x,则56 g·mol-1×2x=11.2 g,x=0.1 mol;G中增重0.9 g,对应生成氢气物质的量是0.05 mol;反应中金属化合价升高,失电子物质的量=0.1 mol×(2+3)=0.5 mol,设生成二氧化硫y,得电子物质的量=(0.05×2) mol+2y;得失相等,y=0.2 mol;即SO2:0.2 mol;H2:0.05 mol,n(SO2)∶n(H2)=4∶1,所以化学方程式:4Fe+9H2SO4(浓)2FeSO4+Fe2(SO4)3+4SO2↑+H2↑+8H2O。
9.(2018全国Ⅲ)(14分)KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1)KIO3的化学名称是 。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:
“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是 。“滤液”中的溶质主要是 。“调pH”中发生反应的化学方程式为 。
(3)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式 。
②电解过程中通过阳离子交换膜的离子主要为 ,其迁移方向是 。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有 (写出一点)。
答案:(1)碘酸钾
(2)加热 KCl KH(IO3)2+KOH2KIO3+H2O(或HIO3+KOHKIO3+H2O)
(3)①2H2O+2e-2OH-+H2↑ ②K+ 由a到b ③产生Cl2易污染环境等
- 6 -
解析:(2)温度升高气体溶解度减小;Cl2被逐出,KH(IO3)2结晶析出,“滤液”中溶质主要是KCl;“调pH”目的是生成KIO3,所以选用KOH溶液,发生反应的化学方程式为KH(IO3)2+KOH2KIO3+H2O(或HIO3+KOHKIO3+H2O)。
(3)①阴极区电解质是KOH,被电解的是H2O:2H2O+2e-2OH-+H2↑;
②电解时,阳离子向阴极区移动,故K+由a向b迁移;
③“KClO3氧化法”中产生有毒气体Cl2,易污染环境。
10.(20分)H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列各方法中的问题。
Ⅰ.H2S的除去
方法1:生物脱H2S的原理如下。
H2S+Fe2(SO4)3S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO42Fe2(SO4)3+2H2O
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是 。
(2)由图1和图2判断使用硫杆菌的最佳条件为 。若反应温度过高,反应速率下降,其原因是 。
图1
图2
方法2:在一定条件下,用H2O2氧化H2S。
(3)随着参加反应的n(H2O2)n(H2S)变化,氧化产物不同。当n(H2O2)n(H2S)=4时,氧化产物的分子式为 。
Ⅱ.SO2的除去
方法1(双碱法):用NaOH吸收SO2,并用CaO使NaOH再生。
NaOH溶液Na2SO3溶液
(4)写出过程①的离子方程式: ;CaO在水中存在如下转化:CaO(s)+H2O(l)Ca(OH)2(s)Ca2+(aq)+2OH-(aq)
从平衡移动的角度,简述过程②NaOH再生的原理: 。
方法2:用氨水除去SO2。
- 6 -
(5)已知25 ℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0 mol·L-1,溶液中的c(OH-)= mol·L-1。将SO2通入该氨水中,当c(OH-)降至1.0×10-7 mol·L-1时,溶液中的c(SO32-)c(HSO3-)= 。
答案:(1)降低反应活化能(或作催化剂)
(2)30 ℃、pH=2.0 蛋白质变性(或硫杆菌失去活性)
(3)H2SO4
(4)2OH-+SO2SO32-+H2O SO32-与Ca2+生成CaSO3沉淀,平衡向正向移动,有NaOH生成
(5)6.0×10-3 0.62
解析:(1)硫杆菌能加快反应速率,故是反应的催化剂。
(2)图1显示30 ℃反应速率最大,图2显示pH=2.0时反应速率最大,最佳条件为30 ℃,pH=2.0。硫杆菌的主要成分属于蛋白质,温度过高,会失去生理活性。
(3)当n(H2O2)=4 mol时,可得到8 mol e-,1 mol H2S应失去8 mol e-,故化合价变为+6价,氧化产物的分子式为H2SO4。
(4)离子方程式为SO2+2OH-SO32-+H2O。SO32-会与Ca2+结合生成难溶盐CaSO3,降低Ca2+浓度,平衡右移,生成NaOH。
(5)Kb=c(OH-)·c(NH4+)c(NH3·H2O)≈c2(OH-)2.0,c(OH-)=1.8×10-5×2.0 mol·L-1=6×10-3 mol·L-1;Ka2=c(SO32-)·c(H+)c(HSO3-),当c(OH-)=1.0×10-7 mol·L-1时,c(H+)=1.0×10-7 mol·L-1,c(SO32-)c(HSO3-)=Ka2c(H+)=6.2×10-81.0×10-7=0.62。
- 6 -
相关文档
- 天津专用2020高考化学二轮复习专题2021-08-066页
- 广西专用2020版高考化学二轮复习专2021-08-065页
- 广西专用2020版高考化学二轮复习专2021-08-066页
- 天津专用2020高考化学二轮复习专题2021-07-097页
- 天津专用2020高考化学二轮复习专题2021-07-086页
- 天津专用2020高考化学二轮复习专题2021-07-0810页
- 广西专用2020版高考化学二轮复习专2021-07-075页
- 天津专用2020高考化学二轮复习专题2021-07-075页
- 天津专用2020高考化学二轮复习专题2021-07-067页
- 天津专用2020高考化学二轮复习专题2021-07-067页