- 988.50 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
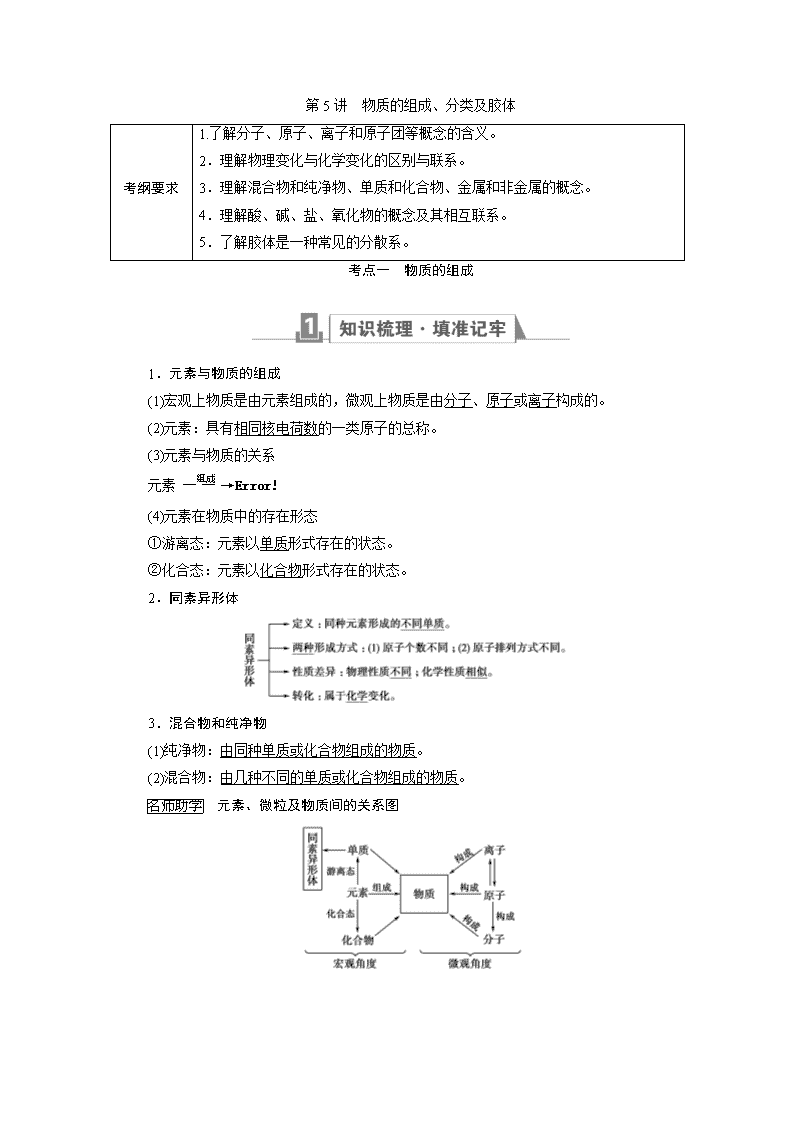
第5讲 物质的组成、分类及胶体
考纲要求
1.了解分子、原子、离子和原子团等概念的含义。
2.理解物理变化与化学变化的区别与联系。
3.理解混合物和纯净物、单质和化合物、金属和非金属的概念。
4.理解酸、碱、盐、氧化物的概念及其相互联系。
5.了解胶体是一种常见的分散系。
考点一 物质的组成
1.元素与物质的组成
(1)宏观上物质是由元素组成的,微观上物质是由分子、原子或离子构成的。
(2)元素:具有相同核电荷数的一类原子的总称。
(3)元素与物质的关系
元素
(4)元素在物质中的存在形态
①游离态:元素以单质形式存在的状态。
②化合态:元素以化合物形式存在的状态。
2.同素异形体
3.混合物和纯净物
(1)纯净物:由同种单质或化合物组成的物质。
(2)混合物:由几种不同的单质或化合物组成的物质。
元素、微粒及物质间的关系图
1.(RJ必修1·P29,1改编)现有下列12种物质:①H2O、②空气、③Mg、④CaO、⑤H2SO4、⑥Ca(OH)2、⑦CuSO4·5H2O、⑧碘酒、⑨C2H5OH、⑩NaHCO3、⑪氨水、⑫纯碱。
其中,属于混合物的是__________(填序号)。
答案: ②⑧⑪
2.判断正误(正确的打“√”,错误的打“×”)。
(1)含水的物质不一定是混合物( )
(2)只由一种分子组成的物质一定为纯净物,组成混合物的物质可能只有一种元素( )
(3)纯净物只由一种原子组成,而混合物由多种原子组成( )
(4)只由一种元素的阳离子与另一种元素的阴离子组成的物质一定为纯净物( )
(5)同位素单质混合在一起一般是纯净物 ( )
(6)同一种元素可能有多种不同原子,同一种原子也可能形成不同的离子( )
答案: (1)√ (2)√ (3)× (4)× (5)√ (6)√
3.(1)由同种元素组成的物质一定是纯净物吗?
(2)H2与H互为同素异形体吗?
答案: (1)不一定,如O2和O3混合在一起虽然只含氧元素,但属于混合物。
(2)不属于同素异形体,因为H不属于单质。
1.下列各组物质能真实表示物质分子组成的是( )
A.NO、C2H5OH、HNO3、I2
B.CaO、N2、HCl、H2O
C.NH3、H2S、Si、CO
D.CO2、SiO2、CH3COOH、H2SO4
答案: A
2.下列元素①Na ②Mg ③Al ④Fe ⑤Cu ⑥C ⑦Si ⑧O ⑨S ⑩N ⑪P ⑫Cl ⑬H ⑭He
在自然界中,
(1)只以化合态存在的是
________________________________________________________________________。
(2)只以游离态存在的是
________________________________________________________________________。
(3)既以化合态存在又以游离态存在的是
________________________________________________________________________。
答案: (1)①②③④⑤⑦⑫⑬ (2)⑭ (3)⑥⑧⑨⑩⑪
3.按要求回答问题。
①冰水混合物 ②水煤气 ③铝热剂 ④普通玻璃 ⑤水玻璃 ⑥有机玻璃 ⑦漂白粉 ⑧TNT ⑨H2SO4 ⑩含氧40%的氧化镁 ⑪花生油 ⑫福尔马林 ⑬密封保存的NO2气体 ⑭CuSO4·5H2O ⑮液氯 ⑯王水 ⑰KAl(SO4)2·12H2O ⑱分子式为C5H10的烃 ⑲分子式为C7H8的芳香烃
以上物质中一定为纯净物的是__________,一定为混合物的是__________,可能是纯净物,也可能是混合物的是__________。
答案: ①⑧⑨⑩⑭⑮⑰⑲ ②③④⑤⑥⑦⑪⑫⑬⑯ ⑱
速记卡片
常见的混合物
(1)分散系(如溶液、胶体、浊液等);
(2)高分子(如蛋白质、纤维素、聚合物、淀粉等);
(3)常见特殊名称的混合物:石油、石油的各种馏分、煤、漂白粉、碱石灰、福尔马林、油脂、天然气、水煤气、铝热剂等。
考点二 物质的分类
1.分类方法
(1)交叉分类法
利用交叉分类法对下列物质分类,在物质与物质类别之间连线。
(2)树状分类法
请把下列物质的序号填写到下图的括号中。
①硫黄 ②HClO ③苛性钠 ④铁 ⑤小苏打 ⑥氧化钠
2.熟记常见无机化合物的分类
3.氧化物的分类
1.(RJ必修1·P42,4改编)下列各组物质,按化合物、单质、混合物顺序排列的是 ( )
A.食醋、液态氧、碘酒 B.生石灰、白磷、熟石灰
C.干冰、铁、盐酸 D.空气、氮气、胆矾
答案: C
2.判断正误(正确的打“√”,错误的打“×”)。
(1)非金属氧化物一定是酸性氧化物( )
(2)酸性氧化物不一定是非金属氧化物( )
(3)金属氧化物一定是碱性氧化物( )
(4)碱性氧化物一定是金属氧化物( )
(5)Na2O和Na2O2均能与H2O反应生成NaOH,故二者都是碱性氧化物( )
(6)能与酸反应生成盐和水的氧化物一定是碱性氧化物( )
(7)能与碱反应生成盐和水的氧化物一定是酸性氧化物( )
(8)溶于水呈酸性的是酸,呈碱性的是碱( )
(9)HCOOH含有两个氢,所以是二元酸( )
(10)盐一定由金属离子和酸根离子组成( )
答案: (1)× (2)√ (3)× (4)√ (5)× (6)× (7)× (8)× (9)× (10)×
1.表中关于物质分类的正确组合是( )
类别
组合
酸性氧化物
碱性氧化物
酸
碱
盐
A
CO2
SiO2
H2SO4
Na2CO3
NaHCO3
B
CO
Na2O
HCl
NaOH
NaCl
C
SO2
Na2O2
CH3COOH
KOH
CaF2
D
SO3
CaO
HNO3
Ca(OH)2
CaCO3
解析: 可采用排除选项的方法,A中SiO2为酸性氧化物,Na2CO3为盐;B中CO为不成盐氧化物;C中Na2O2与酸反应,生成相应的盐、水和O2,不是碱性氧化物。
答案: D
2.下列逻辑关系图中正确的是( )
解析: 根据分散质粒子直径的大小将分散系分为溶液、胶体和浊液,而气溶胶属于胶体的一种,A错误。氧化还原反应与吸热反应和放热反应的分类标准不同,B错误。钾盐与钠盐是根据盐中的阳离子进行分类的,碳酸盐是根据盐中的阴离子进行分类的,C错误。
答案: D
3.盐是一种常见的物质,下列物质通过一步反应可直接形成盐的是( )
①金属单质 ②碱性氧化物 ③碱 ④非金属单质 ⑤酸性氧化物 ⑥酸
A.①②③ B.①④⑥ C.②⑤⑥ D.全部
解析: 金属单质与酸反应生成对应的盐和H2;碱性氧化物与酸反应生成盐和水;碱与酸(或酸性氧化物)反应生成盐;非金属单质和金属化合可得到盐;酸性氧化物或酸与碱(或碱性氧化物)反应生成盐。
答案: D
速记卡片
考点三 分散系 胶体
1.分散系的分类
(1)按照分散质粒子直径大小分类。
(2)按照分散质和分散剂的状态分类。
2.胶体的性质
(1)丁达尔效应
当可见光束通过胶体时,在胶体中出现一条光亮的“通路”。产生丁达尔效应的原因是胶体粒子对光线有散射作用。
(2)电泳
胶体粒子可以通过吸附而带有电荷,在电场的作用下,胶体粒子在分散系里作定向移动。
(3)聚沉
胶体粒子聚集成较大颗粒,从而形成沉淀从分散剂里析出的过程。
使胶体聚沉的方法
3.Fe(OH)3胶体的制备
(1)过程:向沸水中逐滴加入饱和FeCl3溶液,继续煮沸至液体呈红褐色,停止加热,即制得Fe(OH)3胶体。
(2)化学方程式为:FeCl3+3H2OFe(OH)3(胶体)+3HCl。
(3)提纯方法:渗析。
三种分散系性质比较
分散系
溶液
胶体
浊液
稳定性
稳定
较稳定
不稳定
能否透过滤纸
能
能
不能
能否透过半透膜
能
不能
不能
鉴别
无丁达
尔效应
有丁达
尔效应
静置分层或沉淀
1.(RJ必修1·P29,7改编)胶体分散系与其他分散系的本质区别是 ( )
A.是否有丁达尔效应 B.是否透明
C.分散质直径大小 D.是否稳定
答案: C
2.(RJ必修1·P42,5改编)当光束通过下列分散系:①有尘埃的空气 ②稀硫酸 ③蒸馏水 ④Fe(OH)3胶体,能观察到丁达尔效应的是 ( )
A.①② B.②③
C.①④ D.②④
答案: C
3.判断正误(正确的打“√”,错误的打“×”)。
(1)稀豆浆、硅酸、氯化铁溶液均为胶体( )
(2)明矾溶于水产生Al(OH)3胶体:Al3++3H2O===Al(OH)3↓+3H+( )
(3)丁达尔效应是胶体与溶液的本质区别( )
(4)含0.1 mol FeCl3的饱和溶液配制成胶体后,将得到胶体粒子0.1 mol( )
(5)FeCl3溶液和Fe(OH)3胶体都呈红褐色( )
(6)可用过滤的方法将胶体粒子与分散剂分开( )
(7)沸水中滴加少量饱和FeCl3溶液形成带电的胶体,导电能力增强( )
答案: (1)× (2)× (3)× (4)× (5)× (6)× (7)×
考向一 分散系类型的判断与比较
1.下列液体中,不会出现丁达尔效应的分散系是( )
①鸡蛋清溶液 ②水 ③淀粉溶液 ④蔗糖溶液
⑤Fe(OH)3溶胶 ⑥肥皂水
A.①③ B.⑤⑥ C.② D.④
解析: ②中水属于纯净物,不属于分散系;④中物质属于溶液,剩余物质均属于胶体。
答案: D
2.下列关于胶体的判断正确的是( )
A.胶体、溶液和悬浊液属于不同的分散系,其中胶体最稳定
B.氢氧化铝胶体与氯化铝溶液的本质区别是后者中分散质粒子的直径较大
C.纳米级的氧化铁与水组成的分散系可以产生丁达尔效应
D.氯化钠易溶于水,所以氯化钠一定不能制成胶体
解析: 溶液是最稳定的分散系,A项错误;胶体分散质粒子的直径大于溶液分散质的粒子直径,B项错误;纳米级的氧化铁粒子的直径在1~100 nm之间,溶于水能形成胶体,C项正确;氯化钠是离子化合物,易溶于极性溶剂,如水等,但它难溶于非极性溶剂,如苯、四氯化碳等,将氯化钠分散在75%的乙醇中能形成胶体,D项错误。
答案: C
考向二 胶体的性质及应用
3.(2016·湖南张家界联考)某同学在实验室进行了如图所示的实验,下列说法中错误的是( )
A.利用过滤的方法,可将Z中固体与液体分离
B.X、Z烧杯中分散质相同
C.Y中反应的离子方程式为3CaCO3+2Fe3++3H2O===2Fe(OH)3+3CO2↑+3Ca2+
D.Z中分散系能产生丁达尔效应
答案: B
4.下列事实与胶体性质无关的是( )
A.由肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
B.水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染
C.明矾可用作净水剂
D.臭氧、Cl2均可用于水的消毒净化
解析: 臭氧、Cl2用于水的消毒净化是因为臭氧和Cl2与H2O反应生成的HClO都具有强氧化性,与胶体的性质无关。
答案: D
5.回答下列问题。
(1)向Fe(OH)3胶体中加入饱和(NH4)2SO4溶液发生的现象是__________,原因是
________________________________________________________________________
________________________________________________________________________。
(2)向Fe(OH)3胶体中滴入过量稀硫酸,现象是__________,其原因是
________________________________________________________________________
________________________________________________________________________。
答案: (1)产生红褐色沉淀 电解质溶液使胶体发生了聚沉
(2)先出现红褐色沉淀,后沉淀溶解 开始加入稀硫酸,胶体发生聚沉生成氢氧化铁沉淀,随溶液中c(H+)增大,发生反应:Fe(OH)3+3H+===Fe3++3H2O,沉淀逐渐溶解
[福建高考]下表各组物质中,满足下图物质一步转化关系的选项是( )
选项
X
Y
Z
A
Na
NaOH
NaHCO3
B
Cu
CuSO4
Cu(OH)2
C
C
CO
CO2
D
Si
SiO2
H2SiO3
[高考还可以这样考]
(1)若X为N2,Y为NH3,Z为NO,能否满足题图中的转化关系?
________________________________________________________________________。
(2)有下列转化关系:
金属碱性氧化物碱盐,满足上述关系的金属有哪些?
________________________________________________________________________。
(3)有下列转化关系:
非金属酸性氧化物酸盐,满足上述转化关系的非金属有哪些?
________________________________________________________________________。
(4)物质A、B、C、D满足下列连续氧化的转化关系:
ABCD(酸或碱)
①若D为碱,则A、B、C、D分别为何种物质?并写出其转化关系。
________________________________________________________________________。
②若为酸,则满足上述转化关系的物质分别有哪些?并写出其转化关系。
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(5)非金属氧化物都是酸性氧化物吗?酸性氧化物都能与水反应生成相应的酸吗?试举例说明。________________________________________________________________________
________________________________________________________________________。
(6)金属氧化物都是碱性氧化物吗?碱性氧化物都能与水反应生成相应的碱吗?试举例说明。________________________________________________________________________
________________________________________________________________________。
答案: (1)能;其转化关系图为:N2NH3NON2
(2)K、Na、Ca、Ba (3)C、S、P
(4)①Na 转化关系为NaNa2ONa2O2NaOH
②N2;N2NONO2HNO3
NH3;NH3NONO2HNO3
S;SSO2SO3H2SO4
H2S;H2SSO2SO3H2SO4
C;CCOCO2H2CO3
(5)CO、NO、NO2等都不是酸性氧化物,SiO2是酸性氧化物,但不与水反应
(6)Al2O3是两性氧化物,Mn2O7是酸性氧化物,CuO、Fe2O3等是碱性氧化物,但不能与水反应
[课堂随笔]
课时训练 物质的组成、分类及胶体
1.(2016·四川理综,1)化学与生产和生活密切相关。下列过程中没有发生化学变化的是( )
A.氯气作水的杀菌消毒剂
B.硅胶作袋装食品的干燥剂
C.二氧化硫作纸浆的漂白剂
D.肥皂水作蚊虫叮咬处的清洗剂
解析: A.氯气与水反应生成盐酸和次氯酸,次氯酸有强氧化性,能杀菌消毒,发生了化学变化,A项不符合题意;B.硅胶能够吸收水分,可用作袋装食品的干燥剂,没有发生化学变化,B项符合题意;C.二氧化硫在漂白过程中与有色物质反应生成了无色物质,发生了化学变化,C项不符合题意;D.蚊虫叮咬过程中释放出的酸性物质能与肥皂水发生反应,发生了化学变化,D项不符合题意。
答案: B
2.下列物质属于纯净物的是( )
①氨水 ②重水 ③明矾 ④纯碱 ⑤天然气 ⑥氧气
⑦漂白粉 ⑧铝热剂
A.①④⑤⑦ B.②③④⑥
C.④⑦⑧ D.③⑤⑥⑧
答案: B
3.(2016·福建泉州五校联考)符合图中阴影部分的物质的是( )
A.Na2CO3
B.Cu2(OH)2CO3
C.NaCl
D.NaHCO3
解析: Na2CO3分别属于正盐、碳酸盐和钠盐,故A正确;Cu2(OH)2CO3属于碱式盐,故B错误;NaCl不属于碳酸盐,故C错误;NaHCO3属于酸式盐,故D错误。
答案: A
4.(2016·安徽省示范高中联考)下列物质归类正确的是( )
A.电解质:冰醋酸、小苏打、明矾、氧化铝
B.化合物:液氯、干冰、烧碱、纯碱
C.混合物:漂白粉、铝热剂、矿泉水、磁性氧化铁
D.胶体:豆浆、墨水、血液、生理盐水
解析: 明矾是十二水合硫酸铝钾,溶于水电离出钾离子、铝离子和硫酸根离子,为电解质,冰醋酸在水溶液中部分电离,为电解质,小苏打在水溶液中完全电离,为电解质,氧化铝为熔融状态下能导电的化合物,为电解质,故A正确;液氯是由同种元素组成的纯净物,为单质,故B错误;磁性氧化铁为四氧化三铁,为纯净物,故C错误;生理盐水是溶液,不是胶体,故D错误。
答案: A
5.(2016·福建上杭一中质检)辨析以下的说法:①16O与18O的转化可以通过化学反应实现;②灼烧钠的化合物时火焰呈黄色,发生了化学反应;③碱性氧化物一定是金属氧化物;④只由一种元素组成的物质一定是纯净物;⑤石墨与金刚石的转化是化学变化。上述说法中正确的是( )
A.③⑤ B.②④
C.④⑤ D.①③
解析: ①16O与18O属于同位素,同位素之间的转化不属于化学反应,错误;②焰色反应属于物理变化,错误;③碱性氧化物一定是金属氧化物,正确;④只由一种元素组成的物质不一定是纯净物,如氧气与臭氧组成的物质属于混合物,错误;⑤石墨与金刚石属于不同的物质,两者之间的转化是化学变化,正确。
答案: A
6.(2016·河南安阳八校联考)下列关于物质分类的说法正确的是( )
A.根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸和多元酸
B.混合物:铝热剂、福尔马林、水玻璃、漂白粉
C.根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素
D.明矾、水银、烧碱、硫酸均为强电解质
解析: 根据酸分子电离出的氢离子个数,将酸分为一元酸、二元酸和多元酸,故A错误;铝热剂是铝粉与金属氧化物等的混合物,福尔马林是甲醛的水溶液,水玻璃是硅酸钠的水溶液,都是混合物,漂白粉是氯化钙和次氯酸钙的混合物,故B正确;最外层电子数少的不一定是金属元素,如氢元素的最外层电子数为1,但为非金属元素,故C错误;强电解质是指在水溶液中能完全电离的电解质,而电解质是在水溶液中或熔融状态下能导电的化合物,水银是单质,既不是电解质也不是非电解质,故D错误。
答案: B
7.(2016·吉林长春十校联考)下列分类或归类正确的是( )
①铝热剂、纯净矿泉水、冰水混合物均为混合物 ②NaOH、HD、IBr均为化合物 ③明矾、烧碱、硫酸均为强电解质 ④C60、金刚石、石墨均为碳的同素异形体 ⑤碘酒、淀粉溶液、水雾、纳米材料均为胶体
A.①③④⑤ B.③④⑤
C.②④⑤ D.③④
解析: ①铝热剂为金属铝和金属氧化物等的混合物,纯净矿泉水属于混合物,冰水混合物属于纯净物,故错误;②HD是单质,故错误;③硫酸是强酸,烧碱是强碱,明矾是盐,它们均为强电解质,故正确;④C60、金刚石、石墨都是碳的同素异形体,故正确;⑤碘酒属于溶液,不是胶体,纳米材料也不是胶体,故错误。
答案: D
8.化学概念在逻辑上存在如下关系:
对下列概念的说法正确的是( )
A.化合物与电解质属于重叠关系
B.化合物与碱性氧化物属于交叉关系
C.溶液与胶体属于并列关系
D.离子化合物和电解质属于交叉关系
解析:
化合物与电解质属于包含关系,A错;化合物与碱性氧化物属于包含关系,B错;离子化合物与电解质属于包含关系,D错。
答案: C
9.若X+酸===盐+水,则X不可能属于( )
A.氧化物 B.单质
C.碱 D.电解质
解析: 碱性氧化物和酸反应生成盐和水,所以X可能是氧化物;单质和酸反应不可能只生成盐和水,所以X不可能是单质;碱和酸发生中和反应生成盐和水,所以X可能是碱;碱及金属氧化物都属于电解质,能和酸反应生成盐和水,所以X可能是电解质。
答案: B
10.下列实验与物质微粒大小无直接关系的是( )
答案: C
11.(2016·四川雅安期末)“纳米材料”是粒子直径为1~100 nm(纳米)的材料,纳米碳就是其中的一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )
①是溶液 ②是胶体 ③能透过滤纸 ④不能透过滤纸
⑤能产生丁达尔效应 ⑥静置后,会析出黑色沉淀
A.①④⑥ B.②③④
C.②③⑤ D.①③④⑥
解析: 若将纳米碳均匀地分散到蒸馏水中,形成的分散系是胶体,具有丁达尔现象,不能透过半透膜,能透过滤纸,具有介稳性,静置不生成沉淀,故②③⑤正确。
答案: C
12.下列事实或性质与胶体没有直接关系的是 ( )
A.在冶金厂和水泥厂常用高压电除去大量的烟尘,以减少其对空气的污染
B.将植物油倒入水中用力振荡形成油水混合物
C.清晨,阳光穿过茂密的林木枝叶所产生的美丽的光柱
D.在Fe(OH)3胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解
答案: B
13.无机化合物可根据其组成和性质进行分类,
(1)如上图所示的物质分类方法名称是________。
(2)
物质
类别
酸
碱
盐
氧化物
氢化物
化学式
①HCl
②______
③______
④Ba(OH)2
⑤Na2CO3
⑥______
⑦CO2
⑧Na2O
⑨NH3
⑩H2O2
以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表中②③⑥后面的横线上。
(3)写出⑦转化为⑤的化学方程式:
_______________________________________________________________________ 。
(4)写出实验室由⑩制备O2的化学方程式:
_______________________________________________________________________ 。
(5)实验室制备⑦常用________和________反应,检验该气体的方法是
________________________________________________________________________
__________________________。
解析: 常见的酸有H2SO4、HNO3、HCl;碱有NaOH、KOH、Ba(OH)2、Ca(OH)2;盐有NaCl、Na2SO4、Na2CO3、NaNO3、Na2SO3等。酸、碱、盐、氧化物之间可以相互转化,如:CO2(少量)+2NaOH===Na2CO3+H2O。实验室制备O2常利用H2O2在催化剂作用下的分解反应:2H2O22H2O+O2↑,制备CO2常利用大理石或石灰石(CaCO3)与稀盐酸反应:CaCO3+2HCl===CaCl2+CO2↑+H2O,将产生的气体通入澄清石灰水,若石灰水变浑浊即可证明气体是CO2。
答案: (1)树状分类法
(2)②H2SO4(或HNO3或H2CO3均可) ③NaOH(或KOH) ⑥Na2SO4(或K2CO3或Na2SO3或NaNO3或KNO3或K2SO3)
(3)CO2+2NaOH===Na2CO3+H2O
(4)2H2O22H2O+O2↑
(5)稀盐酸 大理石(或石灰石) 将气体通入澄清石灰水中,若石灰水变浑浊,即可证明气体是CO2
14.某化学兴趣小组的同学按照下面的实验方法制备氢氧化铁胶体:首先取少量蒸馏水于洁净的烧杯中,用酒精灯加热至沸腾,向烧杯中逐滴滴加饱和的FeCl3溶液继续煮沸,至液体呈透明的红褐色。
(1)判断胶体制备是否成功,可利用胶体的________。
(2)在做制备氢氧化铁胶体的实验时,有些同学没有按要求进行,结果没有观察到胶体,请你预测其现象并分析原因。
①甲同学没有选用饱和氯化铁溶液,而是将稀氯化铁溶液滴入沸水中,结果没有观察到
________________________________________________________________________,
其原因是
________________________________________________________________________。
②乙同学在实验中没有使用蒸馏水,而是用自来水,结果会
________________________________________________________________________
________________________________________________________________________,
原因是
________________________________________________________________________。
③丙同学向沸水中滴加饱和氯化铁溶液后,长时间加热,结果会
________________________________________________________________________,
原因是
________________________________________________________________________。
(3)丁同学按要求制备了Fe(OH)3胶体,但是他又向Fe(OH)3胶体中逐滴加入了稀H2SO4溶液,结果出现了一系列变化。
①先出现红褐色沉淀,原因是
________________________________________________________________________
________________________________________________________________________。
②随后沉淀溶解,此反应的离子方程式是
________________________________________________________________________
________________________________________________________________________。
解析: (2)①若用稀FeCl3溶液,则水解产生的Fe(OH)3量太少,看不到红褐色液体。②自来水中含有较多的电解质,使胶体聚沉。③长时间加热使胶体发生聚沉。(3)加入稀H2SO4后,Fe(OH)3会聚沉而产生红褐色沉淀,随后H2SO4会与Fe(OH)3发生中和反应,使沉淀溶解。
答案: (1)丁达尔效应
(2)①红褐色液体 FeCl3溶液太稀,生成的Fe(OH)3太少
②生成红褐色沉淀 自来水中含有电解质,胶体发生聚沉
③生成红褐色沉淀 长时间加热使胶体发生聚沉
(3)①电解质H2SO4使Fe(OH)3胶体聚沉而产生沉淀
②Fe(OH)3+3H+===Fe3++3H2O
15.(2016·福建福安联考)要准确掌握化学基本概念和研究方法。按要求回答下列问题:
(1)下列是某同学对有关物质进行分类的列表:
碱
酸
盐
碱性氧化物
酸性氧化物
第一组
Na2CO3
H2SO4
NaHCO3
CaO
CO2
第二组
NaOH
HCl
NaCl
Na2O
CO
第三组
NaOH
CH3COOH
CaF2
Al2O3
SO2
每组分类均有错误,其错误的物质分别是______、________、________(填化学式)。
(2)鉴别胶体和溶液所采用的方法是观察是否能发生______效应。
(3)一个密闭容器中放入M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,按要求回答下列问题:
物质
M
N
Q
P
反应前质量/g
50
1
3
12
反应后质量/g
x
26
3
30
①该变化的基本反应类型是________反应;
②物质Q在反应中可能起的作用是____________。
解析: (1)第一组中的碳酸钠是盐,而不是碱;第二组中的CO与碱不反应,不是酸性氧化物;第三组中的氧化铝是两性氧化物,不是碱性氧化物。
(2)胶体和溶液的本质区别是分散质微粒直径大小;鉴别胶体和溶液所采用的方法是能否发生丁达尔效应。
(3)①N和P的质量增加,说明这二者是生成物,所以M是反应物,则该反应是M的分解反应;②根据表中数据可知反应前后Q的质量不变,因此Q可能是催化剂,起催化作用。
答案: (1)Na2CO3 CO Al2O3
(2)丁达尔
(3)①分解 ②催化作用
相关文档
- 2021届(鲁科版)高考化学一轮复习化学2021-08-234页
- 2020版高考一轮复习化学通用版学案2021-08-236页
- 2020届高考化学一轮复习化学反应速2021-08-2312页
- 2020届高考化学一轮复习化学平衡常2021-08-2339页
- 2020届高考化学一轮复习化学用语学2021-08-076页
- 2021届高考化学一轮复习化学实验常2021-08-075页
- 2020届高考化学一轮复习化学反应中2021-08-0615页
- 2020版高考一轮复习化学通用版学案2021-08-0611页
- 2020届高考化学一轮复习化学平衡状2021-08-0619页
- 2020版高考一轮复习化学通用版学案2021-08-067页