- 490.50 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时作业9
1.下列过程属于化学能转化为电能的是( )
A.行人踩踏发电瓷砖(原理是利用行人踩踏地板产生的振动来发电)
B.智能手机电池放电
C.汽车发电机中汽油燃烧
D.氢氧化钠与盐酸反应
解析:A选项,动能转化为电能,错误;B选项,化学能转化为电能,正确;C选项,化学能转化为动能,错误;D选项,化学能转化为热能,错误。
答案:B
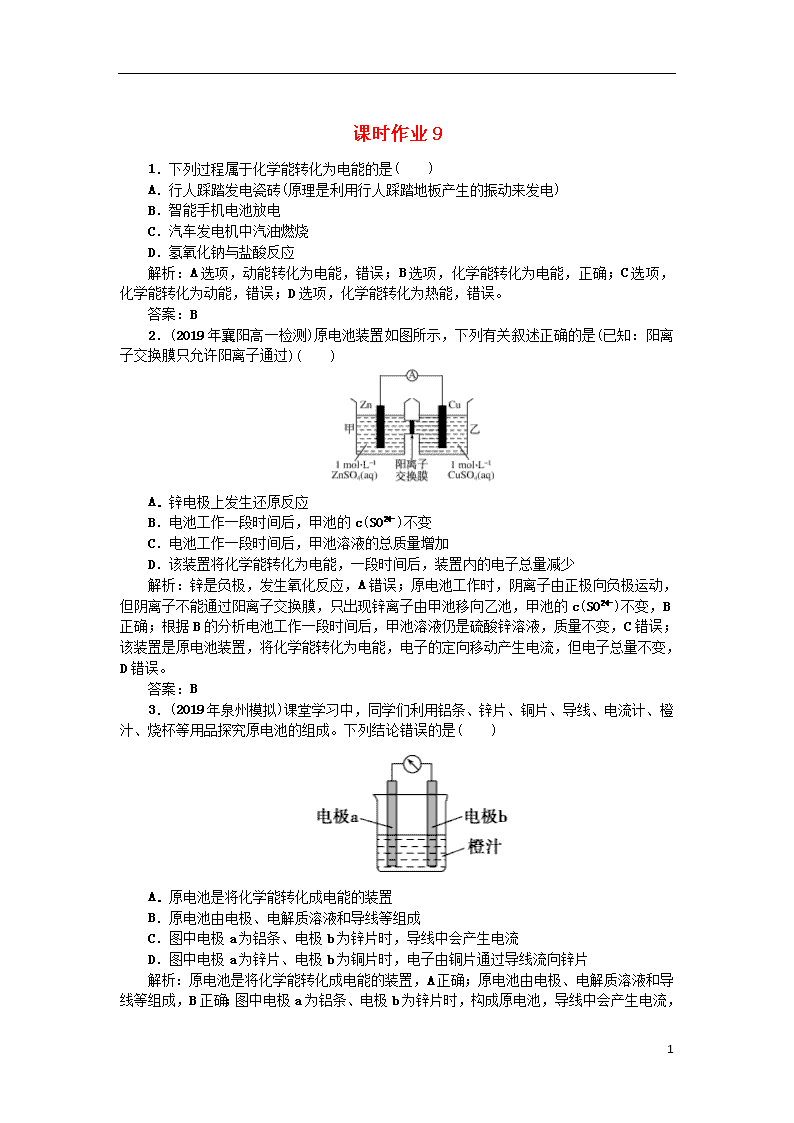
2.(2019年襄阳高一检测)原电池装置如图所示,下列有关叙述正确的是(已知:阳离子交换膜只允许阳离子通过)( )
A.锌电极上发生还原反应
B.电池工作一段时间后,甲池的c(SO)不变
C.电池工作一段时间后,甲池溶液的总质量增加
D.该装置将化学能转化为电能,一段时间后,装置内的电子总量减少
解析:锌是负极,发生氧化反应,A错误;原电池工作时,阴离子由正极向负极运动,但阴离子不能通过阳离子交换膜,只出现锌离子由甲池移向乙池,甲池的c(SO)不变,B正确;根据B的分析电池工作一段时间后,甲池溶液仍是硫酸锌溶液,质量不变,C错误;该装置是原电池装置,将化学能转化为电能,电子的定向移动产生电流,但电子总量不变,D错误。
答案:B
3.(2019年泉州模拟)课堂学习中,同学们利用铝条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成。下列结论错误的是( )
A.原电池是将化学能转化成电能的装置
B.原电池由电极、电解质溶液和导线等组成
C.图中电极a为铝条、电极b为锌片时,导线中会产生电流
D.图中电极a为锌片、电极b为铜片时,电子由铜片通过导线流向锌片
解析:原电池是将化学能转化成电能的装置,A正确;原电池由电极、电解质溶液和导线等组成,B正确;图中电极a为铝条、电极b为锌片时,构成原电池,导线中会产生电流,
8
C正确;图中电极a为锌片、电极b为铜片时,锌片作负极,电子由锌片通过导线流向铜片,D错误。
答案:D
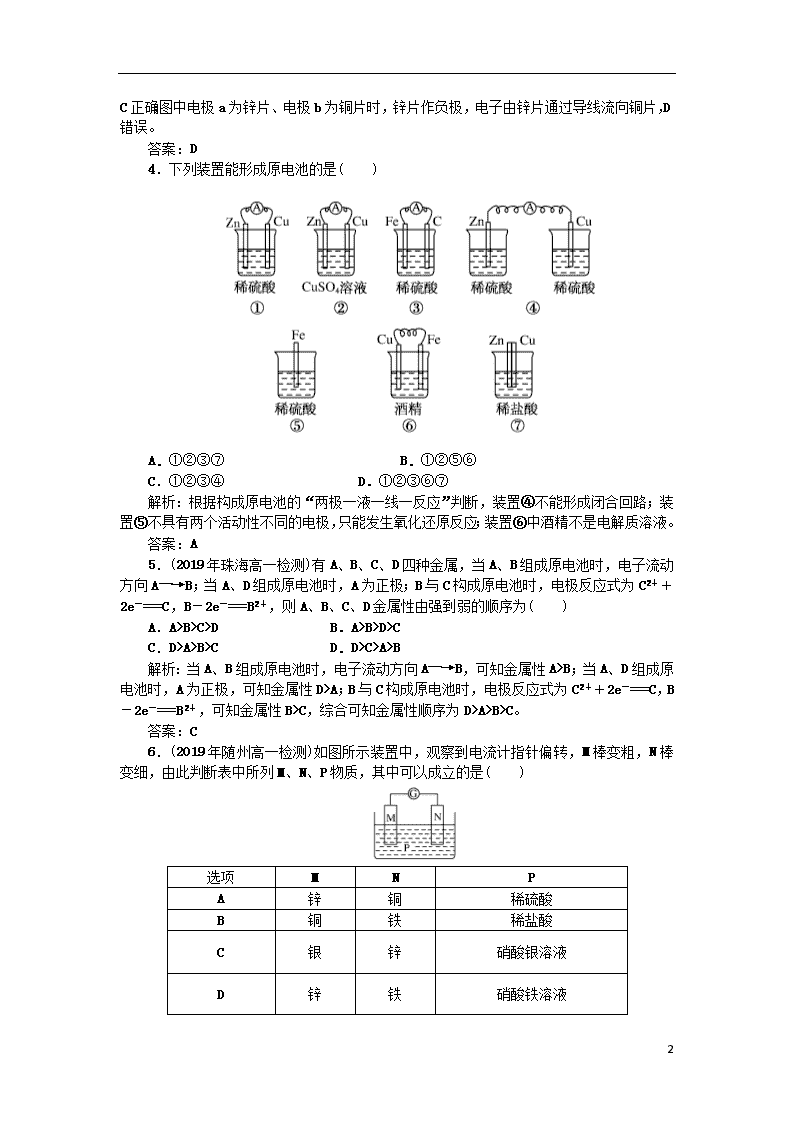
4.下列装置能形成原电池的是( )
A.①②③⑦ B.①②⑤⑥
C.①②③④ D.①②③⑥⑦
解析:根据构成原电池的“两极一液一线一反应”判断,装置④不能形成闭合回路;装置⑤不具有两个活动性不同的电极,只能发生氧化还原反应;装置⑥中酒精不是电解质溶液。
答案:A
5.(2019年珠海高一检测)有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A―→B;当A、D组成原电池时,A为正极;B与C构成原电池时,电极反应式为C2++2e-===C,B-2e-===B2+,则A、B、C、D金属性由强到弱的顺序为( )
A.A>B>C>D B.A>B>D>C
C.D>A>B>C D.D>C>A>B
解析:当A、B组成原电池时,电子流动方向A―→B,可知金属性A>B;当A、D组成原电池时,A为正极,可知金属性D>A;B与C构成原电池时,电极反应式为C2++2e-===C,B-2e-===B2+,可知金属性B>C,综合可知金属性顺序为D>A>B>C。
答案:C
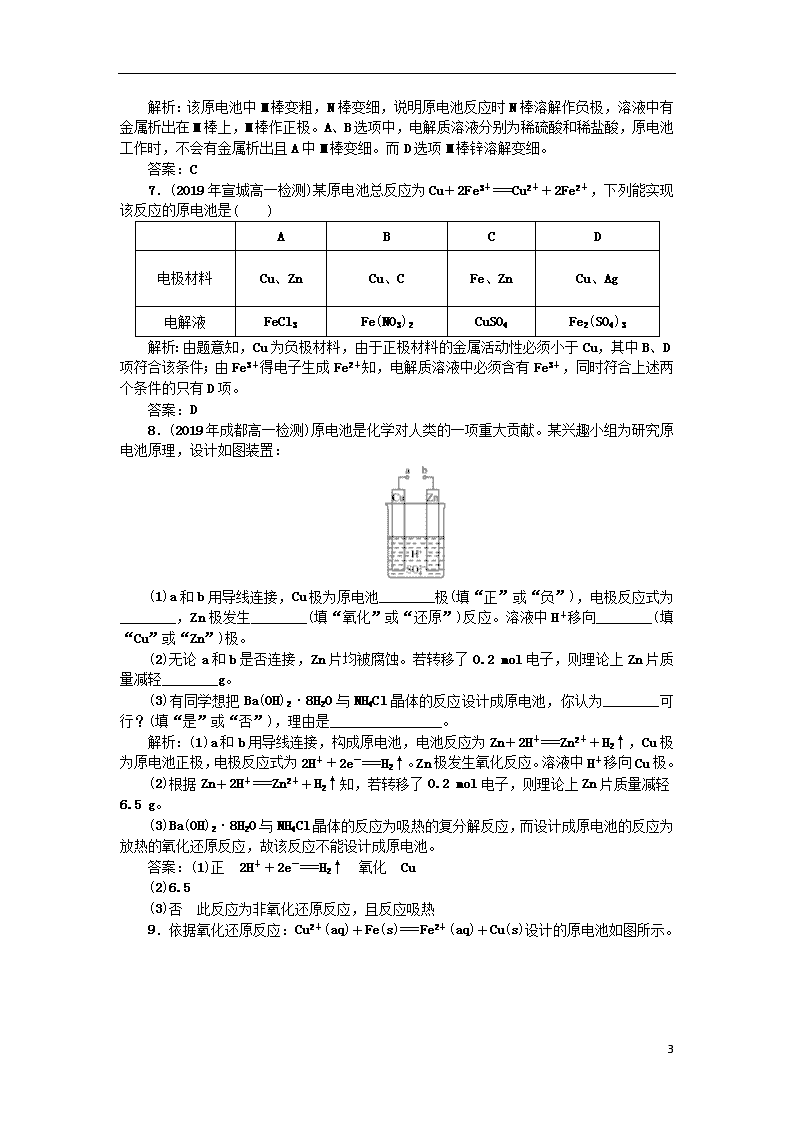
6.(2019年随州高一检测)如图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,由此判断表中所列M、N、P物质,其中可以成立的是( )
选项
M
N
P
A
锌
铜
稀硫酸
B
铜
铁
稀盐酸
C
银
锌
硝酸银溶液
D
锌
铁
硝酸铁溶液
8
解析:该原电池中M棒变粗,N棒变细,说明原电池反应时N棒溶解作负极,溶液中有金属析出在M棒上,M棒作正极。A、B选项中,电解质溶液分别为稀硫酸和稀盐酸,原电池工作时,不会有金属析出且A中M棒变细。而D选项M棒锌溶解变细。
答案:C
7.(2019年宣城高一检测)某原电池总反应为Cu+2Fe3+===Cu2++2Fe2+,下列能实现该反应的原电池是( )
A
B
C
D
电极材料
Cu、Zn
Cu、C
Fe、Zn
Cu、Ag
电解液
FeCl3
Fe(NO3)2
CuSO4
Fe2(SO4)3
解析:由题意知,Cu为负极材料,由于正极材料的金属活动性必须小于Cu,其中B、D项符合该条件;由Fe3+得电子生成Fe2+知,电解质溶液中必须含有Fe3+,同时符合上述两个条件的只有D项。
答案:D
8.(2019年成都高一检测)原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置:
(1)a和b用导线连接,Cu极为原电池________极(填“正”或“负”),电极反应式为________,Zn极发生________(填“氧化”或“还原”)反应。溶液中H+移向________(填“Cu”或“Zn”)极。
(2)无论a和b是否连接,Zn片均被腐蚀。若转移了0.2 mol电子,则理论上Zn片质量减轻________g。
(3)有同学想把Ba(OH)2·8H2O与NH4Cl晶体的反应设计成原电池,你认为________可行?(填“是”或“否”),理由是________________。
解析:(1)a和b用导线连接,构成原电池,电池反应为Zn+2H+===Zn2++H2↑,Cu极为原电池正极,电极反应式为2H++2e-===H2↑。Zn极发生氧化反应。溶液中H+移向Cu极。
(2)根据Zn+2H+===Zn2++H2↑知,若转移了0.2 mol电子,则理论上Zn片质量减轻6.5 g。
(3)Ba(OH)2·8H2O与NH4Cl晶体的反应为吸热的复分解反应,而设计成原电池的反应为放热的氧化还原反应,故该反应不能设计成原电池。
答案:(1)正 2H++2e-===H2↑ 氧化 Cu
(2)6.5
(3)否 此反应为非氧化还原反应,且反应吸热
9.依据氧化还原反应:Cu2+(aq)+Fe(s)===Fe2+(aq)+Cu(s)设计的原电池如图所示。
8
请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是________。
(2)X电极上发生的电极反应式为________________。
(3)针对上述原电池装置,下列说法中不正确的是________。
A.原电池工作时的总反应:Cu2+(aq)+Fe(s)===
Fe2+(aq)+Cu(s),为放热反应
B.原电池工作时,X电极流出电子,发生氧化反应
C.原电池工作时,银电极上发生氧化反应
D.原电池工作时,阳离子不断移向X电极
(4)若Y为稀硫酸,Ag极上出现的现象是________________。
解析:(1)依据方程式可知Fe为负极,Cu2+在正极得电子,所以电解质溶液中一定含有Cu2+。(2)X为负极,电极反应式为Fe-2e-===Fe2+。(3)Ag电极为正极,发生还原反应,C错误;原电池工作时,阳离子不断移向正极(即Ag),D错误。(4)若Y为稀硫酸,Ag极上氢离子发生还原反应生成氢气,故有气泡生成。
答案:(1)Fe 硫酸铜溶液(或氯化铜溶液等)
(2)Fe-2e-===Fe2+
(3)C、D
(4)有气泡生成
能力提升
10.(2019年合肥高一检测)为将反应2Al+6H+===2Al3++3H2↑的化学能转化为电能,下列装置能达到目的的是(铝条均已除去了氧化膜)( )
解析:A项,发生的原电池反应为2Al+2OH-+2H2O===2AlO+3H2↑,错误;B项,发生的原电池反应为2Al+6H+===2Al3++3H2↑,正确;C项,发生的原电池反应为Al+4H++NO===Al3++NO↑+2H2O,错误;D项,电极材料相同,不能构成原电池,错误。
答案:B
11.将铁片和银片用导线连接置于同一稀盐酸溶液中,经过一段时间后,下列各项叙述正确的是( )
A.负极有Cl2逸出,正极有H2逸出
B.负极附近Cl-的浓度减小
C.正极附近Cl-的浓度逐渐增大
D.溶液中Cl-的浓度基本不变
8
解析:铁片和银片用导线连接置于同一稀盐酸溶液中构成原电池,铁作负极,发生反应Fe-2e-===Fe2+,银作正极,发生反应2H++2e-===H2↑,故A错误;溶液中Cl-移向负极,负极附近Cl-的浓度增大,正极附近Cl-的浓度逐渐减小,而溶液中Cl-的浓度基本不变,B、C错误,D正确。
答案:D
12.(2019年沈阳高一检测)将等质量的两份锌粉a、b分别加入两份相同体积、相同物质的量浓度且过量的稀硫酸中,同时向a中加入少量的CuSO4溶液,下列各图为产生H2的体积V(L)与时间t(min)的关系,其中正确的是( )
解析:等质量的两份锌粉a、b,分别加入过量的稀硫酸中,同时向a中加入少量的CuSO4溶液,发生的反应为Zn+Cu2+===Zn2++Cu,铜、锌、稀硫酸形成原电池,反应速率增大,反应用时少于b,但生成的氢气也少于b,图象应为A。
答案:A
13.(2019年雅安高一检测)下列有关原电池的说法正确的是( )
A.铝片和镁片用导线连接后插入NaOH溶液中,Mg较活泼作负极
B.铝片和铜片用导线连接后插入浓硝酸中,铜作负极
C.锌片和铜片用导线连接后插入CuSO4溶液中,铜片作负极
D.只有两种活泼性不同的金属才能构成原电池的两极
解析:判断原电池的正负极,一方面要看电极材料,另一方面要看电解质溶液。A中铝与NaOH溶液会自发反应,铝作负极。B中尽管铝比铜活泼,但铝在浓硝酸中钝化,只有铜片与浓硝酸自发反应,铜作负极。C中锌片和铜片用导线连接后插入CuSO4溶液中,锌片作负极。D中金属与碳棒也可以构成原电池的两极。
答案:B
14.(2019年兰州模拟)完成原电池问题。
Ⅰ.有甲、乙两位同学均想利用原电池反应检测金属的活动性,两人均使用相同镁片与铝片作电极,甲同学将电极放入2 mol·L-1 H2SO4溶液中,乙同学将电极放入2 mol·L-1的NaOH溶液中,如图所示。
请回答:
(1)写出甲池中正极的电极反应式:____________。
(2)写出乙池中负极的电极反应式和总反应的离子方程式。
负极:_______________________________________________;
8
总反应:____________________________________________。
(3)如果甲、乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强(填写元素符号)。
(4)由此实验,可得到如下哪些正确结论?________(填写字母)。
a.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动性顺序已过时,已没有实用价值
d.上述实验反过来证明了“直接利用金属活动性顺序判断原电池中的正负极”的做法是不可靠的
Ⅱ.市场上出售的热敷袋,其主要成分是铁屑、炭粉、木屑和少量氯化钠、水等。热敷袋启用之前用塑料袋使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量。使用完后,会发现有大量铁锈存在。热敷袋放出热量的原理是________。
解析:Ⅰ.(1)甲中镁易失电子作负极,Al作正极,负极上镁发生氧化反应,正极上氢离子发生还原反应,负极反应为Mg-2e-===Mg2+,正极反应为2H++2e-===H2↑。
(2)乙池中铝易失电子作负极,负极上铝失电子发生氧化反应,电极反应式为Al+4OH--3e-===AlO+2H2O,镁作正极,正极发生还原反应,总反应为2Al+2OH-+2H2O===2AlO+3H2↑。
(3)甲中镁作负极,乙中铝作负极,根据作负极的金属活泼性强判断,甲中镁活动性强,乙中铝活动性强。
(4)a.根据甲、乙中电极反应式知,原电池正负极与电解质溶液有关,正确;b.镁的金属性强于铝,但失电子难易程度还与电解质溶液有关,错误;c.该实验说明电解质溶液性质影响电极的正负极,不能说明金属活动性顺序没有使用价值,错误;d.该实验说明化学研究对象复杂,反应与条件有关,电极材料相同,其反应条件不同导致其产物不同,应具体问题具体分析,正确。
Ⅱ.该装置符合原电池构成条件,所以能构成原电池。其中炭粉作正极,正极上氧气得电子发生还原反应,NaCl溶液起电解质溶液作用,加速Fe的氧化。放电时将化学能转化为电能,所以热敷袋放出的热量来自于原电池中的氧化还原反应。
答案:Ⅰ.(1)2H++2e-===H2↑
(2)Al+4OH--3e-===AlO+2H2O
2Al+2OH-+2H2O===2AlO+3H2↑
(3)Mg Al (4)ad
Ⅱ.铁屑、炭粉、空气(氧气)、NaCl溶液构成原电池,铁被氧化(合理即可)
探究拓展
15.如图所示,杠杆A、B两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑铁丝反应及两边浮力的变化)( )
8
A.杠杆为导体和绝缘体时,均为A端高B端低
B.杠杆为导体和绝缘体时,均为A端低B端高
C.当杠杆为绝缘体时,A端低B端高;为导体时,A端高B端低
D.当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高
解析:根据题意,若杠杆为绝缘体,滴入CuSO4溶液后,在铁球表面析出Cu,铁球质量增大,B端下沉;若杠杆为导体,滴入CuSO4溶液后,形成原电池,铁球溶解且在铜球表面析出Cu,A端下沉。
答案:D
16.将两极质量相同的铜棒和锌棒,用导线相连接后插入CuSO4溶液中,经过一段时间后,取出洗净后干燥并称重,两棒质量相差6.45 g,导线中通过的电子的物质的量为( )
A.0.1 mol B.0.2 mol
C.0.3 mol D.0.4 mol
解析:负极:Zn-2e-===Zn2+,Zn失去2 mol电子减重65 g;正极: Cu2++2e-===Cu,Cu2+得到2 mol电子增重64 g。两极质量相差:65 g+64 g=129 g,现在两棒质量相差6.45 g,应转移0.1 mol电子。
答案:A
17.某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目。
(1)方案Ⅰ:有人提出将大小相等的铁片和铜片同时放入稀硫酸(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性。该原理的离子方程式为__________________。
(2)方案Ⅱ:有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性。试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出电极反应式。
(3)方案Ⅲ:结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性的简单实验方案(与方案Ⅰ、Ⅱ不能雷同):________________;用离子方程式表示其反应原理:__________________________________。
解析:方案Ⅰ:金属的金属性越强,与酸反应越剧烈,产生H2的速率越快,Fe能与H+反应生成H2:Fe+2H+===Fe2++H2↑,Cu不与H+反应,无明显现象,所以Fe的活泼性大于Cu。
方案Ⅱ:利用原电池中相对活泼金属失去电子为原电池负极,相对不活泼的金属为原电池的正极来判断金属活动性的相对强弱,所以将Cu片、Fe片用导线连接起来浸入稀硫酸中,产生气泡的电极为正极,也就是活动性较差的Cu,金属溶解的电极为电池负极,也就是活动性较强的Fe。
方案Ⅲ:可根据活动性强的金属能将活动性弱的金属从其金属盐溶液中置换出来设计实验。
答案:(1)Fe+2H+===Fe2++H2↑
(2)原电池装置图如下图所示;电极材料为铜片和铁片;电解质溶液为稀硫酸;正极反应:2H++2e-===H2↑;负极反应:Fe-2e-===Fe2+
8
(3)把铁片插入CuSO4溶液中,一段时间后,观察铁片表面是否生成红色物质
Fe+Cu2+===Fe2++Cu
8
相关文档
- 2020版高中化学 专题2 第三单元 化2021-08-2315页
- 化学能转化为电能 学案2021-08-066页
- 2020届一轮复习鲁科版化学能转化为2021-07-089页
- 高中化学第1章化学反应与能量转化2021-07-0810页
- 2019-2020学年高中化学课时作业112021-07-088页
- 2021版高考化学一轮复习(鲁科版)化学2021-07-0826页
- 2020届一轮复习鲁科版第6章第20讲2021-07-0822页
- 2021新高考化学鲁科版一轮复习同步2021-07-0727页
- 2018届一轮复习鲁科版化学能转化为2021-07-0728页
- 2019届一轮复习鲁科版化学能转化为2021-07-068页