- 1.83 MB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题
3
金属及其化合物
第一单元 钠、镁及其化合物
考点
1:
钠的性质
1.
钠的物理性质
(a)
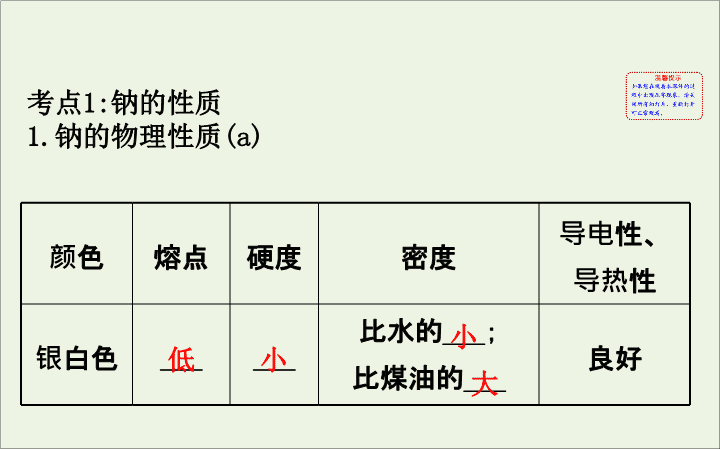
颜色
熔点
硬度
密度
导电性、
导热性
银白色
___
___
比水的
___;
比煤油的
___
良好
低
小
小
大
2.
钠的化学性质
(c)
从原子结构认识钠的化学性质
:
(1)
钠与非金属单质反应
①与
O
2
反应
:
②
与
Cl
2
反应的化学方程式
:________________
。
③与
S
反应的化学方程式
:_____________
。
(2)
钠与水的反应
①钠与水反应的离子方程式
:
________________________
。
△
====
△
====
2Na+Cl
2
2NaCl
2Na+S Na
2
S
2Na+2H
2
O===2Na
+
+2OH
-
+H
2
↑
②
钠与水
(
含酚酞
)
反应的实验现象及解释
:
(3)
钠与酸的反应
:
离子方程式为
____________________
。
(4)
钠与盐溶液的反应
:
如钠投入
CuSO
4
溶液中
,
反应的离子方程式为
___________________________________
。
2Na+2H
+
====2Na
+
+H
2
↑
2Na+2H
2
O+C
u
2+
====2Na
+
+Cu(OH)
2
↓+H
2
↑
3.
钠的制取、保存及用途
(a)
(1)
制取
:
化学方程式为
________________________
。
(2)
保存
:
密封保存
,
通常保存在石蜡油或
_____
中。
(3)
用途。
①钠、钾合金
(
液态
)
可用于原子反应堆的
_______;
②
作强还原剂
,
将某些稀有金属从它们的卤化物中还
原出来
,
如
4Na+TiCl
4
Ti+4NaCl;
③
用作电光源
,
制作高压钠灯。
电解
====
熔融
====
2NaCl(
熔融
) 2Na+Cl
2
↑
煤油
导热剂
4.
焰色反应
(a)
(1)
焰色反应
:
很多金属或它们的化合物在灼烧时都会
使火焰呈现特殊颜色。属于物理变化
,
是元素的性质。
(2)
操作步骤
(3)
常见元素焰色反应的颜色
钠元素
:___
色
;
钾元素
:___
色
(
透过蓝色钴玻璃观察
)
。
黄
紫
【
强化训练
】
1.
下列有关钠的说法中
,
不正确的是
(
)
A.
工业上通过电解氯化钠溶液制取金属钠
B.
高压钠灯常用于道路和广场的照明
C.
钠钾合金可在快中子反应堆中作热交换剂
D.
钠可用于从钛、铌等金属的氯化物中置换出金属单质
【
解析
】
选
A
。钠是活泼的金属
,
工业上通过电解熔融氯化钠制取金属钠
,A
错误
;
高压钠灯常用于道路和广场的照明
,B
正确
;
钠钾合金可在快中子反应堆中作热交换剂
,C
正确
;
钠可用于从钛、铌等金属的氯化物中置换出金属单质
,D
正确。
2.
下列说法中错误的是
(
)
A.
钠在常温下就容易被氧化
B.
钠在受热后能够着火燃烧
C.
钠在空气中能缓慢氧化发生自燃
D.
钠在氧气中燃烧比在空气中更为剧烈
【
解析
】
选
C
。钠在空气中容易被氧化为
Na
2
O,
但不能自燃
,
加热条件下燃烧生成过氧化钠
,
在纯氧中燃烧更剧烈。
3.
向分别盛有
100 mL
水、
100 mL 0.1 mol·L
-1
盐酸、
100 mL 0.01 mol·L
-1
NaOH
溶液的
X
、
Y
、
Z
三
个烧杯中各投入
0.05 mol Na
。下列有关说法正确
的是
(
)
世纪金榜导学号
A.
三个烧杯中均先发生的离子反应为
2Na+2H
2
O==== 2Na
+
+2OH
-
+H
2
↑
B.
三个烧杯中钠均在液面上剧烈反应
,
且
X
烧杯中反应最剧烈
C.
三个烧杯反应后
,
溶质的物质的量浓度相同
D.
三个烧杯反应后
,
生成的气体的质量一定相同
【
解析
】
选
D
。钠与盐酸反应时钠先与
H
+
反应
,
离子方程式表示为
2Na+2H
+
====2Na
+
+H
2
↑,A
项错误
;X
烧杯中生成的溶质为
NaOH,Y
烧杯中生成的溶质为
NaCl,Z
烧杯中生成
NaOH,
由于原溶质为
NaOH,
故
Z
烧杯中物质的量浓度最大
,C
项错误
;
因向三个烧杯中加入钠的物质的量相同且钠全部反应完
,
故生成
H
2
的量相同
,D
项正确。
4.
某化学兴趣小组发现
,
将钠投入硫酸铜溶液中
,
产生无色气体和蓝色沉淀
,
却未置换出红色的铜。该小组同学对此现象进行了如下探究
:
【
分析与讨论
】
(1)
在实验室中通常将钠保存在煤油里
,
煤油的作用是
______
。
(2)
对于钠与水反应的生成物
,
甲同学猜想是
NaOH
和
H
2
,
乙同学猜想是
NaOH
和
O
2
,
你认为
________
同学的猜想不
合理
,
请从化合价的角度解释原因
:______
。
(3)
甲同学认为金属钠与
CuSO
4
溶液的反应之所以没有铜
生成
,
是因为置换生成的铜较少被蓝色沉淀所覆盖。
【
解释与结论
】
(1)
将钠投入硫酸铜溶液中
,
产生无色气体和蓝色沉淀
,
写出发生反应的化学方程式
(
分两步写
):______,
____________
。
(2)
乙同学为验证甲同学的观点是否正确。选择盐酸作为检测试剂
,
请你写出乙同学选择盐酸的原因
:
____________
。
(3)
乙同学在验证甲同学观点是否正确的实验过程中
,
意外发现生成的蓝色沉淀中混有少量的黑色
CuO
。
已知
:Cu(OH)
2
CuO+H
2
O
。请指出生成
CuO
的原因
:
______________
。
(4)
为验证钠与
CuSO
4
溶液反应生成的气体产物
,
丙同学
称取
2.3 g Na,
与足量
CuSO
4
溶液反应后收集产生的气体
,
点燃该气体
,
产生
________
色火焰
,
在火焰上方罩一个
干冷的烧杯
,
实验现象为烧杯内壁出现
_______
。
△
====
【
解析
】【
分析与讨论
】
(1)
钠与氧气和水反应
,
所以在实验室中通常将钠保存在煤油里
,
煤油的作用是将钠与氧气和水隔绝。
(2)
根据在一个化学反应中
,
如果有元素化合价升高
,
同时就有元素化合价降低。若生成
NaOH
和
O
2
,
则该反应中钠元素的化合价由
0
价升高到
+1
价
,
氧元素的化合价由
-2
价升高到
0
价
,
只有元素化合价升高
,
没有元素化合价降低
,
所以乙同学的猜想不合理。
【
解释与结论
】
(1)
钠和水反应生成氢氧化钠和氢气
,
发生反应的化学方程式为
2Na+2H
2
O====2NaOH+H
2
↑;
氢氧化钠和硫酸铜溶液反应生成氢氧化铜蓝色沉淀和硫酸钠
,
发生反应的化学方程式为
CuSO
4
+2NaOH====Cu(OH)
2
↓+Na
2
SO
4
。
(2)
应从
Cu
与
Cu(OH)
2
的不同性质入手
,
最简单的实验是将沉淀分离出来后用盐酸溶解
,
氢氧化铜可溶于盐酸而铜不溶。
(3)
黑色难溶物
CuO,
其解释是
Cu(OH)
2
分解
,
钠与水反
应放出的热使生成的
Cu(OH)
2
部分分解
:Cu(OH)
2
CuO+H
2
O
。
(4)
氢气点燃的现象是产生淡蓝色火焰。氢气燃烧生成
水
,
所以在火焰上方罩一个干冷的烧杯
,
烧杯内壁出现
无色液滴。
△
====
答案
:【
分析与讨论
】
(1)
将钠与氧气和水隔绝
(2)
乙 若生成
NaOH
和
O
2
,
则该反应中钠元素的化合价由
0
价升高到
+1
价
,
氧元素的化合价由
-2
价升高到
0
价
,
只有元素化合价升高
,
没有元素化合价降低
【
解释与结论
】
(1)2Na+2H
2
O====2NaOH+H
2
↑
CuSO
4
+2NaOH====Cu(OH)
2
↓+Na
2
SO
4
(2)
氢氧化铜可溶于盐酸而铜不溶
(3)
钠与水反应放出的热使生成的
Cu(OH)
2
部分分解
(4)
淡蓝 无色液滴
【
归纳总结
】
1.
钠与盐溶液的反应
(1)
反应的实质
:
钠与盐溶液反应
,
实质上是先与水反应生成
NaOH,NaOH
再与盐发生复分解反应
,
而不能置换出盐中的金属。这是因为虽然溶液中存在金属阳离子
,
但是钠的活泼性比较强
,
先与水反应
,
而不是先与金属阳离子反应。
(2)
实例
:
如
Na
与
CuSO
4
溶液的反应
,
发生的反应过程
有
:2Na+2H
2
O====2NaOH+H
2
↑,CuSO
4
+2NaOH====
Cu(OH)
2
↓+Na
2
SO
4
。
总反应方程式
:2Na+2H
2
O+CuSO
4
====Na
2
SO
4
+
Cu(OH)
2
↓+H
2
↑
。
2.
钠和酸的反应
:
实质是
Na
与
H
+
作用。由于在酸溶液中
,H
+
主要来源于酸
,
因此钠先与酸反应
,
当与酸反应完后才与
H
2
O
反应。如钠和足量盐酸反应的化学方程式为
2Na+2HCl====2NaCl+H
2
↑,
若钠有剩余
,
则还会发生
2Na+2H
2
O====2NaOH+H
2
↑
反应。
考点
2:
氧化钠和过氧化钠
1.
氧化钠和过氧化钠的比较
(a
、
c)
2.
过氧化钠的特性
(c)
(1)
化合价与性质的关系
因此
Na
2
O
2
既有氧化性
,
又有还原性
,
但主要表现出较强的氧化性。
(2)
强氧化性的表现
【
典例精析
】
【
典例
】
下列说法正确的是
(
)
A.Na
2
O
2
遇到湿润的紫色石蕊试纸后
,
石蕊试纸最终变成蓝色
B.Na
2
O
2
与
CO
2
反应生成
0.1 mol O
2
时转移电子
0.4 mol
C.Na
2
O
2
投入
CuCl
2
溶液中有蓝色沉淀及气泡产生
D.
向饱和烧碱溶液中加入
2 g Na
2
O
2
,
充分反应后
,
溶液中
c
(Na
+
)
不变
【
解析
】
选
C
。
Na
2
O
2
遇湿润的石蕊试纸时
,
它最终能氧
化石蕊使其褪色
,A
项错误
;
由
2Na
2
O
2
+2CO
2
====
2Na
2
CO
3
+O
2
及
Na
2
O
2
中氧为
-1
价知
,
每生成
1 mol O
2
时会
转移
2 mol
电子
,B
项错误
;Na
2
O
2
投入
CuCl
2
溶液中
,Na
2
O
2
先与水反应生成
NaOH
与
O
2
,NaOH
再与
CuCl
2
反应生成
Cu(OH)
2
沉淀
,C
项正确
;Na
2
O
2
与水反应时能放出大量的
热
,
使溶液温度升高
,NaOH
溶解度增大
,
导致溶液中
c
(Na
+
)
增大
,D
项错误。
【
强化训练
】
1.
密闭容器中充入
CO
2
、
CO
、
CH
4
的混合气体共
m
g,
若加入足量
Na
2
O
2
,
充分振荡并不断用电火花引燃至反应完全
,
测得固体质量增加
m
g,
则
CO
2
与
CH
4
的体积比为 世纪金榜导学号
(
)
A.3∶1
B.2∶1
C.1∶1 D.
任意比
【
解析
】
选
C
。
2CO+O
2
2CO
2
①
2Na
2
O
2
+2CO
2
====
2Na
2
CO
3
+O
2
②
①
+②
得
:Na
2
O
2
+CO
====
Na
2
CO
3
(
虚拟的反应
)
即
:CO
可被
Na
2
O
2
完全吸收
2H
2
+O
2
2H
2
O
③
2Na
2
O
2
+2H
2
O====4NaOH+O
2
↑
④
点燃
====
点燃
====
③+④
得
:Na
2
O
2
+H
2
====
2NaOH(
虚拟的反应
)
即
:H
2
可被
Na
2
O
2
完全吸收
由于
CO
完全被吸收
,
当
CO
2
、
CH
4
的体积比符合
1∶1
时
,
相当于
2CO∶2H
2
,
可被
Na
2
O
2
完全吸收。
2.
如图是
Na
2
O
2
和
CO
2
定性、定量实验的装置示意图。
注射器
1
中抽取了
100 mL CO
2
,U
形管中装有适量小玻璃珠和约
1.5 g Na
2
O
2
粉末。实验开始时
,
打开
K
1
、
K
2
、
K
4
止水夹
,
关闭
K
3
止水夹
,
推动注射器
1
活塞
,
缓缓将
CO
2
压至
U
形管中
,
注射器
2
活塞缓缓向外移动。回答下列问题
(
本题不考虑注射器内壁的摩擦阻力
):
(1)U
形管内的玻璃珠并不参与反应
,
其所起的作用除防止过氧化钠粉末被吹走外
,
另一个重要作用是
_____
。
(2)U
形管中可观察到的反应现象是
___________
。
(3)
注射器
1
活塞推到底后
,
注射器
2
中收集到的气体大于
50 mL,
其原因除可能仍含
CO
2
外
,
还有一个重要原因是
________________________________
。
(4)
为了使剩余气体中二氧化碳能反应完
,
接下来的操作是
_________________
。
(5)
要证明反应产物之一为氧气
,
最为方便的实验方法是
____________________
(6)
本实验结束后固体产物板结
,
难以从
U
形管中取出
,
为了证明固体产物中含有碳酸盐
,
实验时还需要从如下图所示仪器和试剂中选择
________(
填字母
)
。当装置和药品都安装完毕后
,
接下来的操作步骤是
_______
。
【
解析
】
(1)
玻璃珠还可起到增大
Na
2
O
2
与
CO
2
接触面积
,
使之反应完全的作用。
(2)U
形管中
Na
2
O
2
与
CO
2
反应生成
Na
2
CO
3
和
O
2
,
故
U
形管内
淡黄色粉末渐渐变白。
(3)
由
2Na
2
O
2
+2CO
2
====2Na
2
CO
3
+O
2
可知
100 mL CO
2
理论
上应产生
50 mL O
2
,
收集到的气体大于
50 mL
的原因除
部分
CO
2
没反应外
,
还可能是反应放热
,
气体受热膨胀。
(4)
为了让
CO
2
反应完
,
可把注射器
2
中的
CO
2
气体再推入
U
形管中
,
反复数次。
(5)
可利用
O
2
支持燃烧
,
能使带火星的木条复燃的性质
证明。
(6)
要证明有
C ,
可利用
H
+
与
C
反应产生
CO
2
,
检验
CO
2
即可。故选
A
、
D
、
E
或
C
、
D
、
E
。操作时
,
需要关闭
K
1
、
K
4
,
打开
K
2
、
K
3
止水夹
,
通过分液漏斗
(
或胶头滴管
)
将盐酸滴入
U
形管中
,
观察试管内现象即可。
答案
:
(1)
增大过氧化钠和二氧化碳的接触面积
,
使反应完全
(2)
淡黄色粉末渐渐变白
(3)
该反应为放热反应
,
反应后气体温度升高
,
体积变大
(4)
将注射器
2
中气体再推入
U
形管中
,
反复数次
(5)
打开胶塞
,
立即将带火星的木条伸入
U
形管中
,
木条复燃
(6)A
、
D
、
E(
或
C
、
D
、
E)
关闭
K
1
、
K
4
止水夹
,
打开
K
2
、
K
3
止水夹
,
通过分液漏斗
(
或胶头滴管
)
将稀盐酸滴入
U
形管中
,
观察试管内
Ca(OH)
2
溶液是否变浑浊
3.
从氧化还原反应角度探究
Na
2
O
2
的结构与性质。
用双线桥分析
Na
2
O
2
与水反应中电子转移的方向和数目
:________
。
(1)
氧化剂和还原剂是
__________,
氧化产物是
__________,
还原产物是
__________
。
(2)1 mol Na
2
O
2
与水完全反应时转移的电子数
:
_______
。生成
1 mol O
2
转移电子数
:________
。
答案
:
(1)Na
2
O
2
O
2
NaOH
(2)
N
A
(
或
6.02×10
23
)
2
N
A
(
或
1.204×10
24
)
4.200 ℃
时
,11.6 g CO
2
和水蒸气的混合气体与足量的
Na
2
O
2
充分反应后固体质量增加了
3.6 g,
则原混合气体的总物质的量是
________;
原混合物的平均相对分子质量为
________
。
【
解析
】
由反应方程式
2Na
2
O
2
+2H
2
O====4NaOH+O
2
↑
、
2Na
2
O
2
+2CO
2
====2Na
2
CO
3
+O
2
利用质量守恒定律可知
,
生
成
O
2
的质量为
11.6 g-3.6 g=8 g,
n
(O
2
)=
=0.25 mol,
根据
Na
2
O
2
与
H
2
O(g)
、
CO
2
反应的物质的量
的关系可知
CO
2
和
H
2
O(g)
的物质的量之和为
0.25 mol
×2=0.5 mol
。原混合气体的平均摩尔质量为
M
=11.6 g÷0.5 mol=23.2 g
·
mol
-1
,
即原混合气体的平均相对分子质量为
23.2
。
答案
:
0.5 mol
23.2
【
归纳总结
】
1.
过氧化钠的强氧化性
(1)
从化合价的角度分析。
Na
2
O
2
既有氧化性又有还原性
,
但主要表现为氧化性。
(2)
强氧化性的具体表现。
2.Na
2
O
2
与水、
CO
2
反应的四个重要关系
反应方程式
:2Na
2
O
2
+2H
2
O====4NaOH+O
2
↑
2Na
2
O
2
+2CO
2
====2Na
2
CO
3
+O
2
(1)
物质的量关系。
无论是
CO
2
或
H
2
O(g)
的单一物质还是二者的混合物
,
与足量的
Na
2
O
2
反应时
,
消耗
CO
2
或
H
2
O(g)
与放出
O
2
的物质的量之比均为
2∶1,
即气体减小的体积等于生成的
O
2
的体积。
(2)
固体质量关系。
相当于固体
(Na
2
O
2
)
只吸收了
CO
2
中的“
CO”,H
2
O(g)
中的
“
H
2
”;
可以看作发生相应的反应
:Na
2
O
2
+CO====Na
2
CO
3
、
Na
2
O
2
+H
2
====2NaOH(
实际上两反应不能发生
)
。
(3)
先后顺序关系。
一定量的
Na
2
O
2
与一定量
CO
2
和
H
2
O(g)
的混合物反应
,
解决问题时可视作
Na
2
O
2
先与
CO
2
反应
,
待
CO
2
反应完成后
,Na
2
O
2
再与
H
2
O(g)
发生反应
(
实际情况复杂得多
)
。
(4)
电子转移关系。
不论是与
CO
2
还是与
H
2
O(g)
反应
,CO
2
与
H
2
O(g)
均既不是氧化剂也不是还原剂
,
反应的实质都是
Na
2
O
2
自身发生的氧化还原反应
,
所以每有
1 mol O
2
生成时
,
转移的电子均为
2 mol
。
考点
3:
碳酸钠与碳酸氢钠
1.
物理性质及用途
(a)
名称
碳酸钠
碳酸氢钠
化学式
______
______
俗名
_____
、苏打
_______
颜色、状态
白色粉末
细小白色晶体
溶解度
Na
2
CO
3
_____NaHCO
3
碱性
Na
2
CO
3
_____NaHCO
3
Na
2
CO
3
NaHCO
3
纯碱
小苏打
大于
大于
名称
碳酸钠
碳酸氢钠
热稳定性
受热
___
分解
受热
___
分解
主要用途
化工原料
,
可用于制造玻璃、造纸、制皂、制洗涤剂
焙制糕点的
发酵粉、
治疗胃酸过多
难
易
2.
化学性质
(c)
(1)Na
2
CO
3
写出上述序号所表示反应的化学方程式
:
①_____________________________;
②______________________________;
③____________________________
。
Na
2
CO
3
+2HCl====2NaCl+H
2
O+CO
2
↑
Na
2
CO
3
+Ca(OH)
2
====CaCO
3
↓+2NaOH
Na
2
CO
3
+BaCl
2
====BaCO
3
↓+2NaCl
(2)NaHCO
3
写出上述序号①、③、④所表示反应的化学方程式
,
②
反应的离子方程式
:
①____________________________;
②Ca(OH)
2
过量
:____________________________;
Ca(OH)
2
少量
:____________________________________;
③________________________;
④___________________________
。
△
====
NaHCO
3
+HCl====NaCl+H
2
O+CO
2
↑
HC
+OH
-
+Ca
2+
====CaCO
3
↓+H
2
O
Ca
2+
+2OH
-
+2HC
====CaCO
3
↓+C
+2H
2
O
NaHCO
3
+NaOH
====
Na
2
CO
3
+H
2
O
2NaHCO
3
Na
2
CO
3
+H
2
O+CO
2
↑
【
典例精析
】
【
典例
1】
纯碱和小苏打都是白色晶体
,
在日常生活中都可以找到。若要在家中将它们区分开来
,
下面的方法中可行的是
(
)
A.
在水杯中各盛相同质量的样品
,
分别加入等体积的白醋
,
观察反应的剧烈程度
B.
分别用干净铁丝蘸取样品在煤气炉的火焰上灼烧
,
观察火焰颜色
C.
将样品溶解
,
分别加入澄清石灰水
,
观察是否有白色沉淀
D.
分别放在炒锅中加热
,
观察是否有残留物
【
解析
】
选
A
。碳酸钠与酸反应分步进行
,
首先反应产
生碳酸氢钠和氯化钠
,
然后是碳酸氢钠与酸反应产生氯
化钠、二氧化碳和水
,
产生气体
,
而碳酸氢钠中加入酸
马上放出气体
,
所以根据反应放出气体的快慢就可迅速
得到判断
,A
正确
;
纯碱和小苏打都是钠盐
,
焰色反应火
焰都为黄色
,
所以无法区别二者
,B
错误
;
二者都能与氢
氧化钙溶液发生反应产生碳酸钙白色沉淀
,
无法区别
它们
,C
错误
;
碳酸钠稳定
,
受热不分解
,
碳酸氢钠不稳定受热分解产生碳酸钠、二氧化碳和水
,
也有固体残留物
,
所以无法区分二者
,D
错误。
【
典例
2】
将一定量的
NaOH
和一定量的
Na
2
CO
3
混合并配成溶液
,
向溶液中滴加
0.1 mol·L
-1
盐酸。下列图象能正确表示加入盐酸的体积和生成
CO
2
的物质的量的关系的是
(
)
【
解析
】
选
C
。反应可分为三个阶段。
第一阶段
:NaOH
与盐酸反应
,H
+
+OH
-
====H
2
O,
无反应
现象。
第二阶段
:Na
2
CO
3
与盐酸反应生成
NaHCO
3
,C +H
+
====HC ,
无反应现象。
第三阶段
:NaHCO
3
与盐酸反应有
CO
2
生成
,HC +H
+
====H
2
O+CO
2
↑,
有气体放出。
由于第二阶段和第三阶段消耗盐酸的量相等
,
则
NaOH
和
Na
2
CO
3
混合液与盐酸反应时
Oa
段消耗的盐酸的量大于
ab
段消耗盐酸的量
,
图象
C
符合题目要求。
【
考题变式
】
依据你选择的图象
,
能确定混合溶液中
Na
2
CO
3
和
NaOH
的物质的量之比吗
?
提示
:
能。依据选项
C
中的图象及横坐标中消耗盐酸
的量可以确定
Na
2
CO
3
和
NaOH
的物质的量之比为
【
强化训练
】
1.
下列有关纯碱和小苏打的叙述中正确的是
(
)
A.Na
2
CO
3
和
NaHCO
3
都既能与酸反应
,
又能与氢氧化钠溶液反应
B.
等质量
Na
2
CO
3
、
NaHCO
3
分别与相同浓度的盐酸反应
,NaHCO
3
消耗的盐酸体积少
C.
向
NaHCO
3
溶液中滴入
Ba(OH)
2
溶液无沉淀
,
而
Na
2
CO
3
溶液中加入
Ba(OH)
2
溶液出现白色沉淀
D.
等物质的量
Na
2
CO
3
、
NaHCO
3
分别与足量稀
H
2
SO
4
反应
,NaHCO
3
产生的
CO
2
多
【
解析
】
选
B
。
Na
2
CO
3
与盐酸反应生成二氧化碳
,
不与氢
氧化钠反应
,NaHCO
3
属于弱酸强碱盐
,
既能与盐酸反应
,
生成
CO
2
气体
,
又能与氢氧化钠反应
,
生成盐
,A
错误
;
由
方程式
Na
2
CO
3
+2HCl====2NaCl+CO
2
↑+H
2
O,NaHCO
3
+HCl
====NaCl+CO
2
↑+H
2
O
可知
,
等质量
Na
2
CO
3
、
NaHCO
3
分别与相同浓度的盐酸反应
,NaHCO
3
消耗的盐酸体积
少
,B
正确
;Na
2
CO
3
和
NaHCO
3
都与
Ba(OH)
2
溶液反应生成
沉淀
:Ba(OH)
2
+Na
2
CO
3
====BaCO
3
↓+2NaOH,2NaHCO
3
+Ba(OH)
2
====BaCO
3
↓+Na
2
CO
3
+2H
2
O(NaHCO
3
足量
),
C
错误
;
分别与足量稀
H
2
SO
4
反应
,
反应离子方程式为
C +2H
+
====CO
2
↑+H
2
O
、
HC +H
+
====H
2
O+CO
2
↑,
所以等物质的量
Na
2
CO
3
、
NaHCO
3
分别与足量稀
H
2
SO
4
反应
,
产生的
CO
2
一样多
,
故
D
错误。
2.
一定量
CO
2
通入某浓度的
NaOH
溶液得
A
溶液
,
向
A
溶液中逐滴滴入稀盐酸
,
加入
n(HCl)
与生成
n(CO
2
)
的关系如图所示。下列有关叙述正确的是
(
)
世纪金榜导学号
A.
通入的
CO
2
气体在标准状况下可能大于
22.4 L
B.A
溶液中
n
(NaOH)=2
n
(Na
2
CO
3
)
C.A
溶液中既含
Na
2
CO
3
,
又含
NaHCO
3
D.A
溶液中一定只有
Na
2
CO
3
【
解析
】
选
B
。根据碳酸钠与盐酸的反应情况
:
①Na
2
CO
3
+HCl====NaHCO
3
+NaCl;
②NaHCO
3
+HCl====NaCl+CO
2
↑+H
2
O
。
开始滴入
3 mol HCl(
盐酸
)
无气体生成
,
后滴入
1 mol HCl(
盐酸
),
生成
1 mol CO
2
,
而后再滴加盐酸无气体生成
,
说明
A
溶液为氢氧化钠与碳酸钠的混合溶液
,
由生成
1 mol CO
2
可知溶液中碳酸钠的物质的量为
1 mol,
则氢氧化钠的物质的量为
2 mol
。
3.
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体
,
用不同的方法做了以下实验
,
如图
Ⅰ
~
Ⅲ
所示。
(1)
根据图
Ⅰ
所示实验
,
不能够达到实验目的的原因是
___________________________
。
(2)
图
Ⅱ
、
Ⅲ
所示实验均能鉴别这两种物质
,
其反应的化学方程式为
_______________________________
。
(3)
若用实验
Ⅱ
验证碳酸钠和碳酸氢钠的稳定性
,
则试管
B
中装入的固体最好是
____________(
填化学式
)
。
【
解析
】
(1)NaHCO
3
、
Na
2
CO
3
都与盐酸反应放出
CO
2
,
不能达到实验目的。
(2)Ⅱ
、
Ⅲ
都是利用
NaHCO
3
受热易分解的性质进行鉴别。
(3)
试管
B
中装入碳酸氢钠
,
试管
A
中装入碳酸钠
,
这样直接加热的碳酸钠温度高
,
不分解
,
不能使澄清石灰水变浑浊
,
而间接加热的碳酸氢钠分解
,
使澄清石灰水变浑浊
,
表明了碳酸氢钠受热易分解。
答案
:
(1)
无论是
Na
2
CO
3
还是
NaHCO
3
,
均可以与盐酸反应产生
CO
2
,
两者的反应现象相同
,
故达不到鉴别的目的
(2)2NaHCO
3
Na
2
CO
3
+H
2
O+CO
2
↑,
CO
2
+Ca(OH)
2
====CaCO
3
↓+H
2
O
(3)NaHCO
3
△
====
【
归纳总结
】
1.Na
2
CO
3
和
NaHCO
3
性质的应用
(1)Na
2
CO
3
、
NaHCO
3
的鉴别
①固体的鉴别用加热法
:
产生使澄清石灰水变浑浊的气体的是
NaHCO
3
固体。
②
溶液的鉴别可用沉淀法、气体法和测
pH
法。
a.
沉淀法
:
加入
BaCl
2
溶液或
CaCl
2
溶液
,
产生沉淀的是
Na
2
CO
3
溶液。
b.
气体法
:
滴入稀盐酸
,
立即产生气泡的是
NaHCO
3
溶液。
c.
测
pH
法
:
用
pH
试纸测相同浓度的稀溶液
,pH
大的是
Na
2
CO
3
溶液。
(2)Na
2
CO
3
、
NaHCO
3
的除杂
序号
混合物
(
括号内为杂质
)
除杂方法
①
Na
2
CO
3
(s)(NaHCO
3
)
加热法
②
NaHCO
3
(aq)(Na
2
CO
3
)
通入足量
CO
2
③
Na
2
CO
3
(aq)(NaHCO
3
)
滴加适量
NaOH
溶液
2.
利用数形结合的思想理解碳酸钠、碳酸氢钠与盐酸的反应
(1)
向
Na
2
CO
3
溶液中逐滴加入盐酸
,
消耗盐酸的体积与产生
CO
2
的体积的关系如图甲所示。
(2)
向
NaHCO
3
溶液中逐滴加入盐酸
,
消耗盐酸的体积与产生
CO
2
的体积的关系如图乙所示。
(3)
向
NaOH
、
Na
2
CO
3
的混合物中逐滴加入盐酸
,
消耗盐酸的体积与产生
CO
2
的体积的关系如图丙所示
(
设
NaOH
、
Na
2
CO
3
的物质的量之比为
1∶1)
。
(4)
向
Na
2
CO
3
、
NaHCO
3
的混合物中逐滴加入盐酸
,
消耗盐酸的体积与产生
CO
2
的体积的关系如图丁所示
(
设
Na
2
CO
3
、
NaHCO
3
的物质的量之比为
1∶1)
。
考点
4:
镁及其化合物
1.
镁的物理性质
(a)
(1)
镁
:
镁是
_____
色有金属光泽的固体
,
密度较
___,
硬度较
___
、有延展性
,
是电和热的良导体。
(2)
镁合金
:
密度较
___,
硬度和强度都较
___
。
银白
小
低
小
大
2.
镁及其化合物的化学性质
(c)
注意
:①Mg
在空气中燃烧得到的固体物质主要为
MgO
和少量
Mg
3
N
2
及
C
的混合物
;
②Mg
着火后
,
不可用
CO
2
灭火
;
③
由于
Mg(OH)
2
的溶解度比
MgCO
3
的小
,
故水垢的主要成分中含
Mg(OH)
2
,
而非
MgCO
3
。
3.
镁的用途
(a)
镁合金
用于制造火箭、导弹和飞机的部件
镁
制造信号弹和焰火
氧化镁
熔点高
,
可作耐高温材料
4.
从海水中提取镁
(b)
(1)
工艺流程
(2)
基本步骤及主要反应
【
强化训练
】
1.
世界上
60%
的镁是从海水中提取的
,
其提取步骤如下
:①
把贝壳制成生石灰
;②
向海水中加入生石灰
,
过滤
,
洗涤沉淀物
;③
将沉淀物与盐酸反应
,
结晶、过滤
;④
在氯化氢热气流中加热晶体
;⑤
电解上述所得盐
(
熔融条件下
)
。下列说法正确的是
(
)
A.
向洗涤液中滴加碳酸钠溶液可检验沉淀是否洗涤干净
B.
上述变化过程中包括了分解、化合、复分解、置换四种反应类型
C.
在氯化氢热气流中干燥晶体是为了加快干燥速度
D.
步骤⑤也可以采用电解该盐水溶液的方法
【
解析
】
选
A
。洗涤液中如果含有
Ca
2+
,
滴加碳酸钠
溶液会生成白色沉淀
,
所以可检验沉淀是否洗涤干
净
,A
正确。提取镁的过程中涉及的反应主要有
:
CaCO
3
CaO+CO
2
↑
、
CaO+H
2
O====Ca(OH)
2
、
Ca(OH)
2
+MgCl
2
====CaCl
2
+Mg(OH)
2
↓
、
Mg(OH)
2
+2HCl====MgCl
2
+2H
2
O
、
MgCl
2
·
6H
2
O MgCl
2
+6H
2
O↑
、
MgCl
2
(
熔融
) Mg+Cl
2
↑
。
高温
====
电解
====
上述反应中没有置换反应
,
故
B
错误。在氯化氢热气流中干燥晶体是为了抑制
MgCl
2
水解
,
故
C
错误。电解
MgCl
2
溶液将得到氢氧化镁
,
故
D
错误。
2.
镁在空气里点燃可以燃烧
,
放出大量的热并发出耀眼的白光
,
生成白色的氧化镁
,
同时
,
镁在这样的高温条件下
,
还可与空气中的另一种主要成分反应
,
生成少量的物质
A,
气体
C
能够使湿润的红色石蕊试纸变蓝。已知
A
有下列一系列变化
:
(1)
写出
A
、
C
、
D
的化学式
:
A__________
、
C__________
、
D__________
。
(2)
写出下列变化的化学方程式
:
①________________________________________,
②________________________________________
。
【
解析
】
镁在空气里燃烧时
,
主要和氧气反应生成
MgO,
还可以和氮气反应生成
Mg
3
N
2
,
所以
A
为
Mg
3
N
2
。
Mg
3
N
2
和盐
酸反应得到的溶液
B
中一定含有
Mg
2+
和
Cl
-
,
所以沉淀
D
一
定是
Mg(OH)
2
,
能够使湿润的红色石蕊试纸变蓝的气体是
氨气
,N
能够和
NaOH
溶液反应放出
NH
3
,
所以溶液
B
中还
含有
N ,
即它为
MgCl
2
和
NH
4
Cl
的混合物。
答案
:
(1)Mg
3
N
2
NH
3
Mg(OH)
2
(2)①Mg
3
N
2
+8HCl====3MgCl
2
+2NH
4
Cl
②MgCl
2
+2NaOH====Mg(OH)
2
↓+2NaCl,
NH
4
Cl+NaOH NaCl+H
2
O+NH
3
↑
△
====
【
归纳总结
】
镁及其化合物的转化关系
相关文档
- 广东省2021版高考化学一轮复习单元2021-08-2310页
- 2020届高考化学专题二第6讲金属及2021-08-2344页
- 北京版2021高考化学一轮复习专题五2021-08-2318页
- 高一化学必修一金属及其化合物知识2021-08-2338页
- 高中化学(人教版)必修1课件:第三章 金2021-08-2336页
- 2020暑假最新高中化学一轮复习:常见2021-08-235页
- 第四章 非金属及其化合物知识结构2021-08-235页
- 2018届二轮复习第9讲 常见金属及2021-08-2352页
- 2018届高考二轮复习鲁科版专题07非2021-08-2315页
- 2020届化学高考二轮复习(浙江)非金属2021-08-2376页