- 1.56 MB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
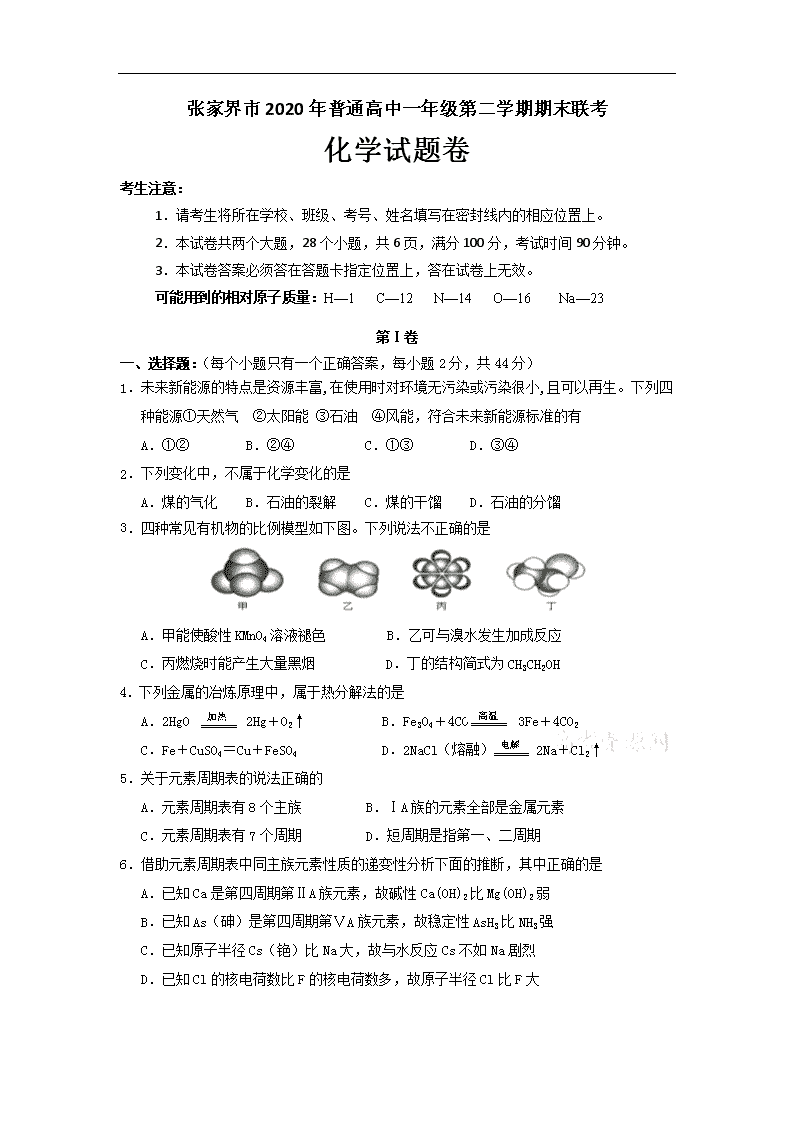
张家界市2020年普通高中一年级第二学期期末联考
化学试题卷
考生注意:
1.请考生将所在学校、班级、考号、姓名填写在密封线内的相应位置上。
2.本试卷共两个大题,28个小题,共6页,满分100分,考试时间90分钟。
3.本试卷答案必须答在答题卡指定位置上,答在试卷上无效。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23
第Ⅰ卷
一、选择题:(每个小题只有一个正确答案,每小题2分,共44分)
1.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列四种能源①天然气 ②太阳能 ③石油 ④风能,符合未来新能源标准的有
A.①② B.②④ C.①③ D.③④
2.下列变化中,不属于化学变化的是
A.煤的气化 B.石油的裂解 C.煤的干馏 D.石油的分馏
3.四种常见有机物的比例模型如下图。下列说法不正确的是
A.甲能使酸性KMnO4溶液褪色 B.乙可与溴水发生加成反应
C.丙燃烧时能产生大量黑烟 D.丁的结构简式为CH3CH2OH
高温
加热
4.下列金属的冶炼原理中,属于热分解法的是
电解
A.2HgO 2Hg+O2↑ B.Fe3O4+4CO 3Fe+4CO2
C.Fe+CuSO4=Cu+FeSO4 D.2NaCl(熔融) 2Na+Cl2↑
5.关于元素周期表的说法正确的
A.元素周期表有8个主族 B.ⅠA族的元素全部是金属元素
C.元素周期表有7个周期 D.短周期是指第一、二周期
6.借助元素周期表中同主族元素性质的递变性分析下面的推断,其中正确的是
A.已知Ca是第四周期第ⅡA族元素,故碱性Ca(OH)2比Mg(OH)2弱
B.已知As(砷)是第四周期第ⅤA族元素,故稳定性AsH3比NH3强
C.已知原子半径Cs(铯)比Na大,故与水反应Cs不如Na剧烈
D.已知Cl的核电荷数比F的核电荷数多,故原子半径Cl比F大
7.朝核问题是全球关注的热点之一,已知是一种重要的核工业原料,下列有关说法正确的是
A.原子核中含有92个中子 B.与互为同位素
C.原子核外有143个电子 D.的摩尔质量为235
8.下面是用电子式表示某些物质的形成过程,其中正确的是
A. B.
C. D.
9.下列物质中,含非极性共价键的化合物是
A.MgCl2 B.Na2O2 C.O2 D.NaOH
10.下列各反应中,符合如图所示能量变化的是
A.HCl和NaOH的反应
B.Al和盐酸的反应
C.甲烷在氧气中的燃烧反应
D.Ba(OH)2·8H2O和NH4Cl的反应
11.燃料电池广泛应用于航天飞机。以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应如下:H2+2OH--2e-=2H2O O2+2H2O+4e-=4OH- 据此判断,下列说法中正确的是
A.H2在正极发生氧化反应
B.供电时的总反应为:2H2+O2=2H2O
C.燃料电池是将燃料燃烧时释放出的热能直接转化为电能
D.燃料电池的电极一定是由两种活泼性不同的金属组成
12.在N2+3H2 2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol/L,在该段时间内用N2表示的平均反应速率为0.15mol/(L·s)。则反应所经过的时间是
A.2s B.2 min C.3s D.3 min
13.苯是重要的化工原料,关于苯的结构和性质叙述中,下列说法正确的是
A.苯分子中含有碳碳双键 B.苯不能与溴发生取代反应
C.苯难溶于水,与水混合分层 D.苯能使KMnO4溶液褪色
14.下图是可逆反应X2+3Y2⇌ 2Z在反应过程中的反应
速率(v)与时间(t)的关系曲线,下列叙述正确的是
A.t1时,只有正方向反应在发生
B.t2时,反应达到最大反应程度
C.t2~t3,反应不再发生
D.t2~t3,各物质的浓度一定相等
15.将甲烷与一定量的氯气混合于一量筒中,倒立于
盛有饱和食盐水的水槽(如图所示),对于此反应,
有关叙述不正确的是
A.该反应的生成物只有四种
B.该反应的条件是光照
C.该反应结束后量筒内液面上升(冷却到室温)
D.该反应属于取代反应
16.下列物质互为同分异构体的一组是
A.乙烯与乙烷 B. 12C与14C
H
H—C—CI
CI
H
CI—C—CI
H
CH3
CH3—CH—CH2—CH3
C.CH3—CH2—CH2—CH2—CH3与 D. 和
—CH3
17.下列有机物分子中,所有碳原子不可能处于同一平面的是
CH3 CH3
CH3—C = C—CH3
CH3
CH3—CH—CH3
A. B.CH3—CH2—CH3
C. D.
18.乙酸是生活中常见的有机物,其结构式如下图所示,下列关于乙酸的说法正确的是
A.乙酸与CaCO3反应,能证明酸性:乙酸﹥碳酸
B.乙酸与乙醇发生酯化反应是②键断裂
C.乙酸显酸性,发生电离是①键断裂
D.乙酸中的官能团是-COOH,叫羟基
19.下列实验中,没有颜色变化的是
A.葡萄糖溶液与新制的Cu(OH)2悬浊液混合加热 B.淀粉溶液中加入碘酒
C.淀粉溶液中加入稀硫酸并加 D.热鸡蛋清中加入浓硝酸
20.已知一定质量的锌粒与稀盐酸反应,生成H2的浓度与反应时间的关系如图所示,下
2 4 6
t/min
c(H2)/(mol·L-1)
0.5
0.36
0.1
0
列结论不正确的是
A.反应速率υ(0-2min)﹥υ(2-4min)﹥υ(4-6min)
B.反应前4min内温度对反应速率的影响比浓度大
C.若将锌粒改为锌粉,可加快产生H2的反应速率
D.反应前4min内生成H2的平均速率
υ(H2)=0.09mol·L-1·min-1
21.几种短周期元素的主要化合价及原子的原子半径数据见下表:
元素代号
L
M
Q
R
T
主要化合价
+2
+3
+6、﹣2
+7、﹣1
﹣2
原子半径/nm
0.160
0.143
0.102
0.099
0.074
据表中信息判断,下列有关叙述中,正确的是
A.常温下,将单质M投入到浓硝酸中,剧烈反应,产生大量红棕色气体。
B.常温下,M与T形成的化合物,易溶于水,且水溶液显碱性。
C.Q、T两元素的氢化物热稳定性比较:Q的氢化物大于T的氢化物。
D.M的氧化物既能和强酸又能和强碱反应,且产物不同。
22.一定量的甲烷恰好与一定量的氧气完全反应后得到CO、CO2和水蒸气共30.4g
,该产物缓缓通过浓硫酸充分吸收后,浓硫酸增重14.4g,则此甲烷完全燃烧还需要氧气的体积(标准状况)为
A.4.48L B.3.36L C.2.24L D. 1.12L
第II卷
二、填空题(每空2分,共56分)
23.现有下列四种物质 A.葡萄糖 B.乙醇 C.苹果汁 D.油脂, 请按下列要求填空 (填代号):
(1)富含维生素 C 的是 ________;
(2)可直接进入血液,补充能量的是________;
(3)医药上常用作消毒剂,能有效杀灭2019-nCoV的是____________。
(4)工业上制备肥皂的主要原料是________________;
24.下表列出了①~⑥六种元素在周期表中的位置:
族
周期
IA
0
1
①
IIA
IIIA
IVA
VA
VIA
VIIA
2
②
③
④
3
⑤
⑥
(1)画出元素⑤的原子结构示意图_________ ;
(2)写出元素⑤的最高价氧化物的水化物的电子式__________;
(3)②、③、⑥三种元素的非金属性由强到弱的顺序为_________(用元素符号表示)
(4) 写出Cu与③的最高价氧化物的水化物稀溶液反应的离子方程式____________
25.某兴趣小组用下图装置研究原电池的工作原理。
H2→
H2O←
O2←(空气)
→H2O
乙
电解质
甲
Cu
K
Zn
e
-
e
-
→
H+
H+
so
2-
4
(1)甲中K断开时,装置中发生反应的离子方程式为_________;K闭合时,Cu棒上的现象为________,外电路电流的方向由_______(填“Cu到Zn”或“Zn到Cu”)。
(2)乙图为氢氧燃料电池构造示意图,其中通入氧气的电极为电池的____极(填“正”或负”),电极反应为________________。
26.已知B的产量可以用来衡量一个国家的石油化工发展水平。A、B、C、D、E之间能进行如图所示的反应。
(1)A的官能团的名称________________,D的结构简式为________________。
(2)写出①发生的化学反应方程式________。
(3)写出反应②的化学反应类型_________。
(4)下列关于化合物B的说法正确的是___(填字母)。
A.B分子中所有原子都在同一平面上
B.B分子中不含官能团
C.B可以与Cl2发生加成反应
D.B不能使溴的四氯化碳溶液褪色
27.某温度下,在密闭容器中,X、Y、Z三种气体随时间变化的曲线如图所示。
请回答下列问题:
0.4
0.3
0.2
0.1
0 2 3 4 5 6
Y
X
Z
时间/min
浓渡/(mol·L-1)
(1)由图中数据分析:该反应的化学方程式为____。
(2)反应开始至2 min,X的平均反应速率为_____。
(3)不改变反应条件,3min至4 min时Z的生成速
率与5min至6min时Z的生成速率相比较,前
者______后者(填“大于”、“小于”或“等于”)。
(4) 上述反应过程中,如果降低温度,则其反应速率
_____(填“增大”、“减小”或“不变)。
(5)下列各项中不可以说明上述反应达到平衡的是_______(填字母)。
A.X、Y、Z的反应速率之比为2∶2∶1
B.Y物质的物质的量保持不变 C.X的浓度保持不变
D.同一物质的正反应速率等于逆反应速率 E.消耗2 mol X同时生成1 mol Z
28.某化学课外小组设计了如图所示的装置制取乙酸乙酯,回答下列问题:
(1) 反应前加入三种药品(a.乙醇b.乙酸c.98%浓硫酸)的顺序是_____。
A. abc B. cba C. bca D. acb
乙酸、乙醇
浓H2SO4
A
B
(2)已知下列数据:
乙醇
乙酸
乙酸乙酯
98%浓硫酸
熔点/℃
-117.3
16.6
-83.6
—
沸点/℃
78.5
117.9
77.5
338.0
资料:Ⅰ.温度高于140℃ 时发生副反应:2CH3CH2OH→CH3CH2OCH2CH3+H2O
Ⅱ.乙酸乙酯是无色透明液体,相对密度(水=1)为0.90,在水中会出现分层现象
①酯化反应的化学方程式为_________________________________。
②考虑到反应速率等多种因素,用上述装置制备乙酸乙酯时,反应的最佳温度范围是_____(填序号)。
A.T<77.5℃ B.T>140℃ C.105℃
相关文档
- 湖南省张家界市慈利县2019-2020学2021-08-2316页
- 2018-2019学年安徽省宣城市高一下2021-08-237页
- 福建莆田第二十四中学2019-2020学2021-08-238页
- 山东省泰安市2019-2020学年高一下2021-08-2325页
- 2018-2019学年陕西省黄陵中学高新2021-08-237页
- 2018-2019学年内蒙古集宁一中(西校2021-08-238页
- 2018-2019学年上海市金山中学高一2021-08-2317页
- 2018-2019学年安徽省宣城市高一下2021-08-2317页
- 2018-2019学年广东省实验中学高一2021-08-239页
- 2018-2019学年安徽省阜阳市第三中2021-08-2320页