- 324.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题讲座(二) 无机化学工艺流程题的解题策略
工艺流程题就是将化工生产中的生产流程用框图形式表示出来,并根据生产流程中有关的化学知识步步设问,是无机框图题的创新,题目常常以现代工业生产为基础,将化学工艺流程进行简化,与化工生产成本、环境保护等相融合,考查物质的制备、检验、分离等基本实验原理在化工生产中的实际应用,是近几年高考化学命题中的常考题型。
一、题型结构
1.化工流程线路示意图
(1)箭头:箭头进入的是投料(即反应物)、出去的是生成物(包括主产物和副产物)。
(2)三线:物料进出线、操作流程线、循环操作线。
2.涉及问题
(1)原料的预处理。
(2)反应条件的控制(温度、压强、催化剂、原料配比、pH、溶剂等)。
(3)反应原理(化学平衡、水解平衡、化学反应速率、反应热、电化学等)。
(4)绿色化学问题(物质循环利用、废物的处理、原子利用率、能量充分利用等)。
(5)化工安全(防爆、防污染、防中毒等)。
二、解题思路及方法
1.解题方法
(1)首尾分析法:对一些线型流程工艺(从原料到产品为一条龙的生产工序)试题,首先对比分析流程图中第一种物质(原材料)与最后一种物质(产品),从对比分析中找出原料与产品之间的关系,弄清生产过程中原料转化为产品的基本原理和除杂、分离、提纯产品的化工工艺,然后再结合题设的问题,逐一推敲解答。
(2)分段分析法:对于用同样的原材料生产多种(两种或两种以上)产品(包括副产品)的工业流程题,用分段分析法更容易找到解题的切入点。
(3)交叉分析法:有些化工生产选用多组原材料,先合成一种或几种中间产品,再用这一中间产品与部分其他原材料生产所需的主流产品,这种题适合用交叉分析法。就是将提供的工业流程示意图结合常见化合物的制取原理划分成几条生产流水线,然后上下交叉分析。
2.答题步骤
(1)从题干中获取有用信息,了解生产的产品。
(2)整体浏览一下流程,基本辨别出预处理、反应、提纯、分离等阶段。
(3)分析流程中的每一步骤,并获取以下信息:
①知道“四个什么”。
反应物是什么,发生了什么反应,该反应造成了什么后果,对制造产品有什么作用。
②抓住“一个关键”。
一切反应或操作都是为获得产品而服务。
(4)从问题中获取信息,帮助解题。
3.规范解答
(1)文字叙述类的题目要规范解答,防止出现因叙述不严谨导致的失分。例如:
①如何洗涤沉淀:往漏斗中加入蒸馏水至浸没沉淀,待蒸馏水自然流下后,重复以上操作2~3次。
②如何证明沉淀完全:如向含SO的溶液中加BaCl2溶液,将沉淀静置,取上层清液,再加BaCl2溶液,若无白色沉淀生成,说明沉淀完全。
③如何从溶液中得到晶体:蒸发浓缩—冷却结晶—过滤—洗涤—干燥。
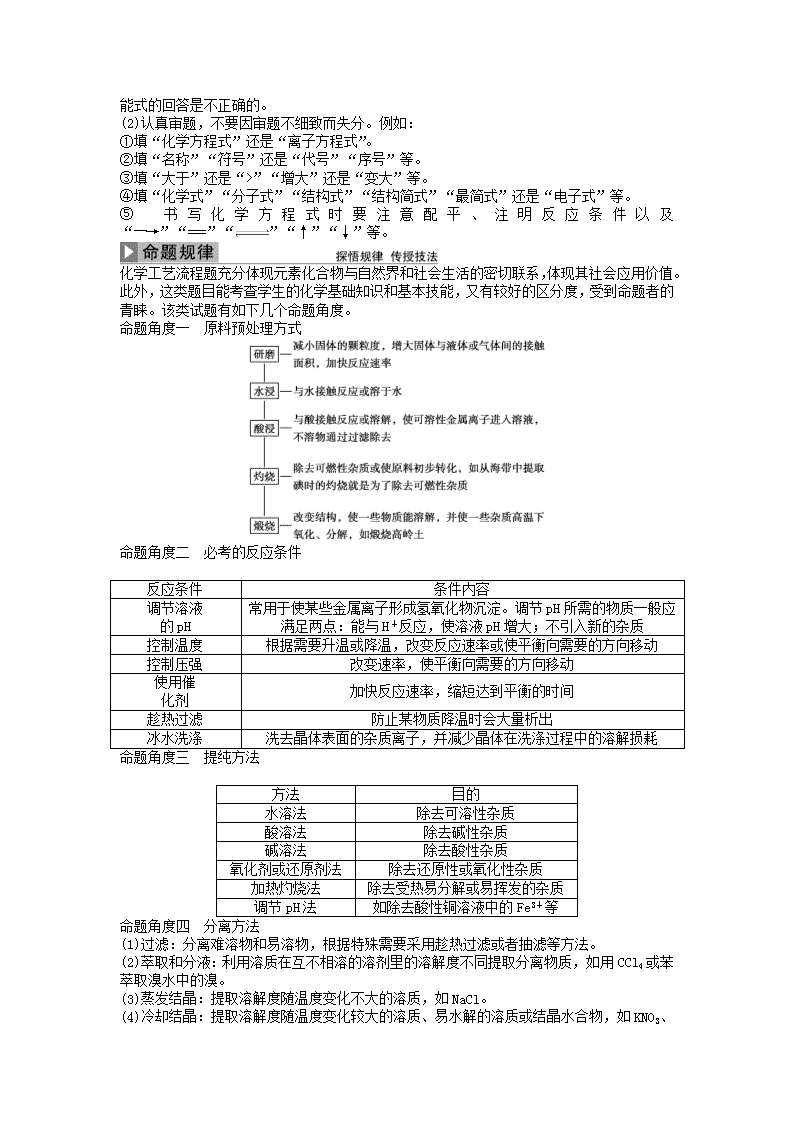
④在写某一步骤是为了除杂时,应该注明“是为了除去××杂质”,只写“除杂”等一类万能式的回答是不正确的。
(2)认真审题,不要因审题不细致而失分。例如:
①填“化学方程式”还是“离子方程式”。
②填“名称”“符号”还是“代号”“序号”等。
③填“大于”还是“>”“增大”还是“变大”等。
④填“化学式”“分子式”“结构式”“结构简式”“最简式”还是“电子式”等。
⑤书写化学方程式时要注意配平、注明反应条件以及“―→”“===”“”“↑”“↓”等。
化学工艺流程题充分体现元素化合物与自然界和社会生活的密切联系,体现其社会应用价值。此外,这类题目能考查学生的化学基础知识和基本技能,又有较好的区分度,受到命题者的青睐。该类试题有如下几个命题角度。
命题角度一 原料预处理方式
命题角度二 必考的反应条件
反应条件
条件内容
调节溶液
的pH
常用于使某些金属离子形成氢氧化物沉淀。调节pH所需的物质一般应满足两点:能与H+反应,使溶液pH增大;不引入新的杂质
控制温度
根据需要升温或降温,改变反应速率或使平衡向需要的方向移动
控制压强
改变速率,使平衡向需要的方向移动
使用催
化剂
加快反应速率,缩短达到平衡的时间
趁热过滤
防止某物质降温时会大量析出
冰水洗涤
洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗
命题角度三 提纯方法
方法
目的
水溶法
除去可溶性杂质
酸溶法
除去碱性杂质
碱溶法
除去酸性杂质
氧化剂或还原剂法
除去还原性或氧化性杂质
加热灼烧法
除去受热易分解或易挥发的杂质
调节pH法
如除去酸性铜溶液中的Fe3+等
命题角度四 分离方法
(1)过滤:分离难溶物和易溶物,根据特殊需要采用趁热过滤或者抽滤等方法。
(2)萃取和分液:利用溶质在互不相溶的溶剂里的溶解度不同提取分离物质,如用CCl4或苯萃取溴水中的溴。
(3)蒸发结晶:提取溶解度随温度变化不大的溶质,如NaCl。
(4)冷却结晶:提取溶解度随温度变化较大的溶质、易水解的溶质或结晶水合物,如KNO3
、FeCl3、CuCl2、CuSO4·5H2O、FeSO4·7H2O等。
(5)蒸馏或分馏:分离沸点不同且互溶的液体混合物,如分离乙醇和甘油。
(6)冷却法:利用气体易液化的特点分离气体,如合成氨工业采用冷却法分离氨气与氮气、氢气。
1.(2015·高考山东卷)毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
(1)毒重石用盐酸浸取前需充分研磨,目的是____________________________________。实验室用37%的盐酸配制15%的盐酸,除量筒外还需使用下列仪器中的________。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)加入NH3·H2O调pH=8可除去________(填离子符号),滤渣Ⅱ中含________________(填化学式)。加入H2C2O4时应避免过量,原因是________________________________________________________________________
________________________________________________________________________。
Ca2+
Mg2+
Fe3+
开始沉淀时的pH
11.9
9.1
1.9
完全沉淀时的pH
13.9
11.1
3.2
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO2-4+2H+===Cr2O2-7+H2O Ba2++CrO2-4===BaCrO4↓
步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的____________(填“上方”或“下方”)。BaCl2溶液的浓度为________mol·L-1。若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将________(填“偏大”或“偏小”)。
解析:(1)毒重石用盐酸浸取前需充分研磨,目的是增大与盐酸的接触面积,加快反应速率。实验室配制一定质量分数的溶液时,需用到的仪器是量筒、烧杯和玻璃棒。(2)由流程图和表中数据可知,pH=8时,可除去Fe3+;调节pH=12.5时,Mg2+完全沉淀,Ca2+部分沉淀,故滤渣Ⅱ中含有Mg(OH)2和Ca(OH)2;加入H2C2O4的目的是除去溶液中剩余的Ca2+,使Ca2+(aq)+C2O(aq)===CaC2O4(s),当H2C2O4过量时,也可能使c(Ba2+)·c(C2O)>Ksp(BaC2O4),而生成BaC2O4沉淀,导致产品BaCl2·2H2O的量减少。(3)由方程式2CrO+2H+===Cr2O+H2O知,步骤Ⅰ中加入的CrO的总物质的量为b mol·L-1× L= mol。步骤Ⅱ中,加入BaCl2充分反应后,剩余的CrO的物质的量为b mol·L-1× L= mol,与Ba2+反应的CrO的物质的量为 mol- mol= mol,由方程式Ba2++CrO===BaCrO4↓得,n(Ba2+)=n(CrO),所以BaCl2溶液的浓度:c(BaCl2)== mol·L-1。若步骤Ⅱ中滴加盐酸时,有少量待测液溅出,造成V1的用量减小,所以
的测量值将偏大。
答案:(1)增大接触面积从而使反应速率加快 ac
(2)Fe3+ Mg(OH)2、Ca(OH)2 H2C2O4过量会导致生成BaC2O4沉淀,产品产量减少
(3)上方 偏大
2.(2014·高考安徽卷)LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:
已知:HCl的沸点是-85.0 ℃,HF的沸点是19.5 ℃。
(1)第①步反应中无水HF的作用是________、________。反应设备不能用玻璃材质的原因是________________________________________________________________________
(用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的________溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:________________________________________________________________________
________________________________________________________________________。
(3)第④步分离采用的方法是________;第⑤步分离尾气中的HF、HCl采用的方法是____________。
(4)LiPF6产品中通常混有少量LiF。取样品w g,测得Li的物质的量为n mol,则该样品中LiPF6的物质的量为________________________________________________________________________
mol(用含w、n的代数式表示)。
解析:(1)由流程可知,第①步反应中无水HF除作为反应物外,还起到溶剂的作用。玻璃中含有SiO2,可与HF发生反应而被腐蚀,化学方程式为SiO2+4HF===SiF4↑+2H2O。HF具有酸性,沾到皮肤上,可选用碱性较弱的NaHCO3溶液进行冲洗。
(2)PF5中P元素显+5价,F元素显-1价,迁移应用盐类水解反应知识推出PF5发生水解反应应生成H3PO4和HF,化学方程式为PF5+4H2O===H3PO4+5HF。
(3)第④步分离得到滤液和LiPF6固体,显然该步操作为过滤。HCl、HF的沸点分别为-85.0 ℃和19.5 ℃,第⑤步分离尾气中的HCl和HF,可采用冷凝的方法,使HF液化,再予以分离。
(4)由题意可知,152 g·mol-1×n(LiPF6)+26 g·mol-1×n(LiF)=w g,n(LiPF6)+n(LiF)=n mol,解得 n(LiPF6)=(w-26n)/126 mol。
答案:(1)反应物 溶剂 SiO2+4HF===SiF4↑+2H2O NaHCO3
(2)PF5+4H2O===H3PO4+5HF
(3)过滤 冷凝
(4)(w-26n)/126
(本题部分小题属于开放试题,合理答案均可)
排查落实练三 金属及其化合物[学生用书单独成册]
一、重要化学方程式的书写(是离子反应的仅写出
离子方程式)
1.(1)Na与H2O的反应________________________________________________________________________;
(2)Na在空气中燃烧________________________________________________________________________;
(3)Na2O2与H2O的反应________________________________________________________________________;
(4)Na2O2与CO2反应________________________________________________________________________;
(5)向NaOH溶液中通入过量CO2________________________________________________________________________;
(6)将Na2CO3溶液与石灰乳混合________________________________________________________________________;
(7)向Na2CO3稀溶液中通入过量CO2________________________________________________________________________;
(8)将NaHCO3溶液和NaOH溶液等物质的量混合
________________________________________________________________________;
(9)将NaHCO3溶液与足量澄清石灰水混合
________________________________________________________________________。
(10)将NaHCO3溶液与少量澄清石灰水混合
________________________________________________________________________。
答案:(1)2Na+2H2O===2Na++2OH-+H2↑
(2)2Na+O2Na2O2
(3)2Na2O2+2H2O===4Na++4OH-+O2↑
(4)2Na2O2+2CO2===2Na2CO3+O2
(5)OH-+CO2===HCO
(6)CO+Ca(OH)2===CaCO3↓+2OH-
(7)CO+CO2+H2O===2HCO
(8)HCO+OH-===CO+H2O
(9)HCO+Ca2++OH-===CaCO3↓+H2O
(10)2HCO+Ca2++2OH-===CaCO3↓+CO+2H2O
2.(1)Al与NaOH溶液的反应
________________________________________________________________________;
(2)Al(OH)3与NaOH溶液的反应
________________________________________________________________________;
(3)Al(OH)3与盐酸的反应
________________________________________________________________________;
(4)Al2O3与NaOH溶液的反应
________________________________________________________________________;
(5)Al2O3与盐酸的反应
________________________________________________________________________;
(6)NaAlO2与过量盐酸的反应
________________________________________________________________________;
(7)向NaAlO2溶液中通入过量CO2气体
________________________________________________________________________;
(8)将NaAlO2溶液与NaHCO3溶液混合
________________________________________________________________________;
(9)将NaAlO2溶液与AlCl3溶液混合
________________________________________________________________________;
(10)向AlCl3溶液中加入过量NaOH溶液
________________________________________________________________________;
(11)向AlCl3溶液中加入过量氨水
________________________________________________________________________;
(12)将AlCl3溶液与NaHCO3溶液混合
________________________________________________________________________。
答案:(1)2Al+2OH-+2H2O===2AlO+3H2↑
(2)Al(OH)3+OH-===AlO+2H2O
(3)Al(OH)3+3H+===Al3++3H2O
(4)Al2O3+2OH-===2AlO+H2O
(5)Al2O3+6H+===2Al3++3H2O
(6)AlO+4H+===Al3++2H2O
(7)AlO+CO2+2H2O===Al(OH)3↓+HCO
(8)AlO+HCO+H2O===Al(OH)3↓+CO
(9)3AlO+Al3++6H2O===4Al(OH)3↓
(10)Al3++4OH-===AlO+2H2O
(11)Al3++3NH3·H2O===Al(OH)3↓+3NH
(12)Al3++3HCO===Al(OH)3↓+3CO2↑
3.(1)Fe与过量稀HNO3的反应
________________________________________________________________________;
(2)Fe在高温条件下与水蒸气的反应
________________________________________________________________________;
(3)Fe2O3与Al的反应
________________________________________________________________________;
(4)FeCl3溶液与Cu的反应
________________________________________________________________________;
(5)Fe(OH)3与HI的反应
________________________________________________________________________;
(6)Fe(OH)2长时间露置于空气中
________________________________________________________________________;
(7)FeO与HCl的反应
________________________________________________________________________;
(8)FeO与稀HNO3的反应
________________________________________________________________________。
答案:(1)Fe+4H++NO===Fe3++NO↑+2H2O
(2)3Fe+4H2O(g)Fe3O4+4H2
(3)Fe2O3+2Al2Fe+Al2O3
(4)2Fe3++Cu===2Fe2++Cu2+
(5)2Fe(OH)3+6H++2I-===2Fe2++I2+6H2O
(6)4Fe(OH)2+O2+2H2O===4Fe(OH)3
(7)FeO+2H+===Fe2++H2O
(8)3FeO+10H++NO===3Fe3++NO↑+5H2O
4.(1)Cu在硫蒸气中燃烧
________________________________________________________________________;
(2)铜在空气中生成铜绿
________________________________________________________________________;
(3)惰性电极电解硫酸铜溶液
________________________________________________________________________;
(4)Cu与浓HNO3的反应
________________________________________________________________________;
(5)Cu与稀HNO3的反应
________________________________________________________________________;
(6)Cu与浓H2SO4的反应
________________________________________________________________________。
答案:(1)2Cu+SCu2S
(2)2Cu+O2+CO2+H2O===Cu2(OH)2CO3
(3)2Cu2++2H2O2Cu+4H++O2↑
(4)Cu+4H++2NO===Cu2++2NO2↑+2H2O
(5)3Cu+8H++2NO===3Cu2++2NO↑+4H2O
(6)Cu+2H2SO4(浓)Cu2++SO+SO2↑+2H2O
二、简答类语言规范再落实
1.向饱和Na2CO3溶液中通入CO2气体,有什么现象?为什么?
答案:有晶体析出。因为反应生成的NaHCO3的溶解度小于Na2CO3的溶解度,且反应过程中消耗水,反应方程式为Na2CO3+CO2+H2O===2NaHCO3↓,所以会有晶体析出。
2.不用其他试剂,怎样鉴别Na2CO3溶液和稀盐酸。
答案:取少量的一种溶液于试管中,滴加另外一种溶液,若开始无气泡产生,滴加一段时间后产生气泡,则试管中的溶液为Na2CO3溶液;若立即产生气泡,则试管中的溶液为稀盐酸。
3.简述在实验室如何配制Fe2(SO4)3溶液。
答案:把称量好的Fe2(SO4)3固体在稀H2SO4中溶解,再加水稀释到指定的浓度。
4.怎样检验某未知溶液中含有Fe2+而不含Fe3+?简述操作步骤及现象。
答案:取未知溶液于试管中,滴加几滴KSCN溶液,无明显变化,再滴加几滴氯水(或H2O2),溶液变成红色,则证明溶液中含有Fe2+,不含有Fe3+。
相关文档
- 2021届高考化学一轮复习化学反应速2021-08-2413页
- 2020版高考一轮复习化学通用版学案2021-08-236页
- 2021版高考化学一轮复习化学常用仪2021-08-2312页
- 2020届高考化学一轮复习化学反应速2021-08-2318页
- 2020届高考化学一轮复习化学反应与2021-08-239页
- 2021届(鲁科版)高考化学一轮复习化学2021-08-234页
- 2020版高考一轮复习化学通用版学案2021-08-236页
- 2020届高考化学一轮复习化学反应速2021-08-2312页
- 2020届高考化学一轮复习化学平衡常2021-08-2339页
- 2020届高考化学一轮复习化学用语学2021-08-076页