- 359.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
(八)氯气的实验室制法及其性质探究
(对应学生用书第70页)
突破1| 氯气的实验室制法
[考纲知识整合]
1.Cl2的实验室制备原理
用强氧化剂(如KMnO4、K2Cr2O7、KClO3、MnO2等)氧化浓盐酸。
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
[或2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O]
2.实验装置及说明
提醒:(1)Cl2的验满方法
①将湿润的淀粉碘化钾试纸靠近盛Cl2的瓶口,观察到试纸立即变蓝,则证明已集满。
②将湿润的蓝色石蕊试纸靠近盛Cl2的瓶口,观察到试纸先变红后褪色,则证明已集满。
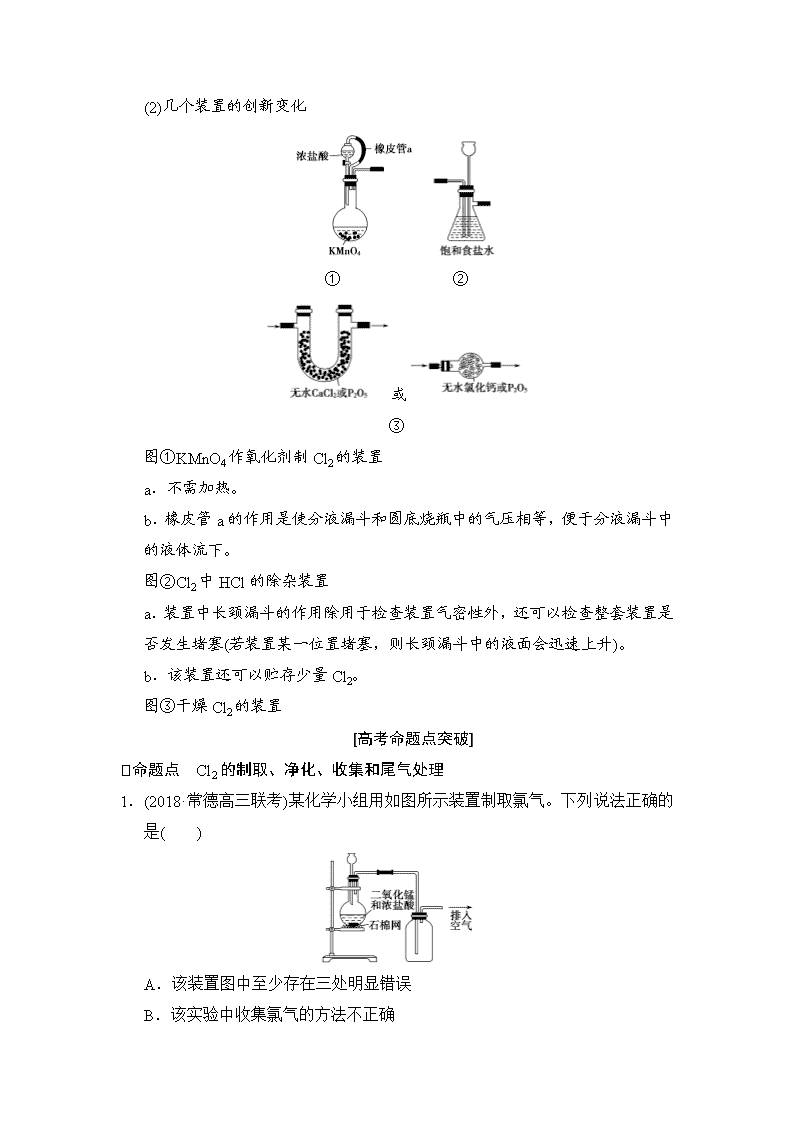
(2)几个装置的创新变化
① ②
或
③
图①KMnO4作氧化剂制Cl2的装置
a.不需加热。
b.橡皮管a的作用是使分液漏斗和圆底烧瓶中的气压相等,便于分液漏斗中的液体流下。
图②Cl2中HCl的除杂装置
a.装置中长颈漏斗的作用除用于检查装置气密性外,还可以检查整套装置是否发生堵塞(若装置某一位置堵塞,则长颈漏斗中的液面会迅速上升)。
b.该装置还可以贮存少量Cl2。
图③干燥Cl2的装置
[高考命题点突破]
命题点 Cl2的制取、净化、收集和尾气处理
1.(2018·常德高三联考)某化学小组用如图所示装置制取氯气。下列说法正确的是( )
A.该装置图中至少存在三处明显错误
B.该实验中收集氯气的方法不正确
C.如果需要得到干燥纯净的Cl2,只需在气体发生装置和收集装置之间连接
一个装有浓硫酸的洗气瓶即可
D.含有2 mol HCl的某浓盐酸与足量MnO2混合,在一定条件下反应,转移
1 mol电子
A [A项,该装置的错误有:缺少加热仪器,MnO2不与浓盐酸发生反应,从而得不到Cl2;装置中没有用分液漏斗而采用长颈漏斗导致气体外逸和HCl的挥发;没有进行尾气处理;B项,Cl2的密度比空气大,该收集方法正确;C项,要得到干燥纯净的Cl2,首先应将气体通过饱和食盐水除去HCl,再通过浓硫酸除去水蒸气;D项,根据反应方程式:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,盐酸浓度变稀后便不再反应,使产生的Cl2的物质的量小于0.5 mol,转移的电子的物质的量也小于1 mol。]
2.(2018·南昌模拟)为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学设计了如图所示的实验装置,按要求回答问题:
(1)请根据甲同学的意图,连接相应的装置,接口顺序:
b接________,________接________,________接a。
(2)U形管中所盛试剂的化学式为 ___________________________________。
(3)装置③中CCl4的作用是_________________________________________。
(4)乙同学认为甲同学实验有缺陷,不能证明最终通入AgNO3溶液的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某个装置之后再加装置⑤。你认为装置⑤应加在________之后(填装置序号),瓶中可以放入________。
(5)丙同学看到甲同学设计的装置后提出无须多加装置⑤,只需将原烧杯中AgNO3溶液换成其他溶液。你认为可将溶液换成________,如果观察到________________________的现象,则证明制Cl2时有HCl挥发出来。
(6)若取过量的MnO2与一定体积的浓HCl(含溶质HCl为0.4 mol)制备Cl2(假设HCl的挥发不计,装置气密性良好),则制备的Cl2总小于0.1 mol的原因是_______________________________________________________________
________________________________________________________________。
【解析】 为验证其猜测,应先检验水蒸气的存在,之后再检验HCl的存在。水蒸气的检验一般使用无水CuSO4(变蓝),HCl的检验一般使用AgNO3溶液(生成白色沉淀)。但是Cl2的存在会干扰HCl的检验,故在检验HCl之前应先除去其中的Cl2(用CCl4吸收)。在检验HCl之前为确认Cl2已经除尽,可在③之后增加装置⑤,其中可以放入湿润的KI淀粉试纸或湿润的有色布条等。由于HCl的水溶液有酸性,能够使酸碱指示剂变为红色,而氯气的水溶液既有酸性也有漂白性,能够使紫色的石蕊试液先变红,后褪色,所以丙同学看到甲同学设计的装置后提出无需多加装置⑤,只需将原烧杯中AgNO3溶液换成其他溶液,可将溶液换成紫色石蕊试液,如果观察到紫色石蕊试液变红而不褪色的现象,则证明制Cl2时有HCl挥发出来。
【答案】 (1)e f d c (e和f顺序可以交换)
(2)CuSO4 (3)吸收Cl2
(4)③ 湿润的KI淀粉试纸(或湿润的有色布条等其他合理答案)
(5)紫色石蕊试液 紫色石蕊试液变红而不褪色
(6)随着反应的进行,浓盐酸变为稀盐酸,稀盐酸与MnO2不反应,反应停止,故盐酸中的HCl不可能全部参加反应
(1)反应物的选择:必须用浓盐酸,稀盐酸与MnO2不反应,且随着反应的进行,浓盐酸变为稀盐酸时,反应停止,故盐酸中的HCl不可能全部参加反应。
(2)加热温度:不宜过高,以减少HCl挥发。
(3)尾气吸收:Cl2有毒,必须有尾气吸收装置,常用吸收剂为NaOH溶液或碱石灰,不用澄清石灰水,因澄清石灰水中Ca(OH)2浓度小,吸收慢且吸收不完全。
(4)实验结束后,先使反应停止并排出残留的Cl2后,再拆卸装置,避免污染空气。
突破2| 以Cl2制备为载体的性质探究
[考纲知识整合]
常见Cl2性质探究的一般装置及说明
装置
试剂
实验现象
实验目的
A
浓硫酸
-
验证干燥的氯气无漂白作用,湿润的氯气(含HClO)有漂白作用
B
干燥红色布条
无明显变化
C
湿润红色布条
红布条褪色
D
FeCl2溶液
溶液由浅绿
色变棕黄色
验证氯气具有强氧化性,可与金属及还原性化合物反应
E
淀粉KI溶液
溶液变蓝色
F
Fe(或Cu、Al)
-
G
NaOH溶液
-
吸收多余的氯气
注意:在制备FeCl3、AlCl3、CuCl2的装置中还要注意防止它们的水解问题,即F装置的前后分别加干燥装置。
[高考命题点突破]
命题点 以Cl2的性质探究为主题的综合试题分析
1.某研究性学习小组的同学利用MnO2、浓盐酸反应来制取干燥的氯气并验证其有无漂白性,所用装置(数量可满足需要,不含制气装置)如下,下列说法正确的是( )
A.按气流流动的先后顺序,装置连接顺序依次为dacbe
B.按气流流动的先后顺序,装置连接顺序依次为dabae
C.装置e的主要用途是制备NaClO
D.若实验中使用到装置c且布条褪色,则说明湿润的氯气有漂白性
B [为确定干燥氯气有无漂白性,需要进入到装置b中的氯气中不含HCl及水蒸气,故应先用饱和食盐水除去HCl,再用浓硫酸除去水,为防止装置e中的水蒸气进入装置b中,在装置b、e之间还应加装一个装置a,尾气用NaOH溶液吸收,A、C错误;B正确;由装置b中现象可判断Cl2有无漂白性,湿润有色布条褪色是因氯气与水反应生成的HClO引起的,D错误。]
2.(2017·专家原创)PCl3是一种重要的化工原料,实验室用如图装置制取PCl3。已知PCl3的熔点是-112 ℃,沸点是75.5 ℃,极易水解,受热易被氧气氧化。
请回答下列问题:
(1)B仪器的名称是_________________________________________________。
(2)实验开始前的操作依次是:①组装仪器,②__________________,③加药品,④________________________,⑤最后点燃酒精灯。
(3)导管a的作用是_________________________________________________
________________________________________________________________;
E装置的作用是___________________________________________________
________________________________________________________________。
(4)F装置中的药品是________;F装置不能换成C装置,理由是___________
________________________________________________________________。
【解析】 由于PCl3极易水解,所以氯气必须干燥,C装置中可盛装浓硫酸干燥氯气。利用二氧化碳排尽装置中的空气,防止PCl3受热被氧气氧化。根据PCl3的沸点数据,利用E装置收集PCl3。因尾气中含有有毒气体氯气且空气中的水蒸气可能进入装置,所以用F装置中的碱石灰吸收多余的氯气,同时防止空气中的水蒸气进入烧瓶与PCl3反应。
【答案】 (1)分液漏斗
(2)检查装置的气密性 打开弹簧夹K通一段时间的CO2,然后关闭弹簧夹K
(3)平衡三颈瓶与分液漏斗上方的气压,使B仪器中的液体能够顺利滴下 冷凝并收集PCl3
(4)碱石灰 C装置只能吸收水,而F装置还可以吸收多余的氯气,同时防止空气中的水蒸气进入烧瓶和PCl3反应
[答题模板] 有关实验装置或装置试剂作用的答题模板
发生装置 生成……或产生……或制取……
⇓
除杂装置 除去(吸收)……防止……干扰(影响)或
除去……中的杂质,以免影响测量结果)
⇓
性质实验装置 与……反应或验证……说明……或比较……或检验……
⇓
收集装置 用……收集方法,利用……装置
⇓
尾气吸收装置 吸收……防止……的污染(影响)
相关文档
- 2020版高考一轮复习化学通用版学案2021-08-245页
- 2021届高考化学一轮复习化学反应速2021-08-2413页
- 2020版高考一轮复习化学通用版学案2021-08-236页
- 2021版高考化学一轮复习化学常用仪2021-08-2312页
- 2020届高考化学一轮复习化学反应速2021-08-2318页
- 2020届高考化学一轮复习化学反应与2021-08-239页
- 2021届(鲁科版)高考化学一轮复习化学2021-08-234页
- 2020版高考一轮复习化学通用版学案2021-08-236页
- 2020届高考化学一轮复习化学反应速2021-08-2312页
- 2020届高考化学一轮复习化学平衡常2021-08-2339页