- 797.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学能转化为电能——电池
考点一 原电池的工作原理
【基础知识梳理】
1.概念和反应本质
原电池是把化学能转化为电能的装置,其反应本质是________________。
2.原电池的构成条件
(1)一看反应:看是否有能自发进行的氧化还原反应发生(一般是活泼性强的金属与电解质溶液反应)。
(2)二看两电极:一般是活泼性不同的两电极。
(3)三看是否形成闭合回路,形成闭合回路需三个条件:①电解质溶液;②两电极直接或间接接触;③两电极插入电解质溶液中。
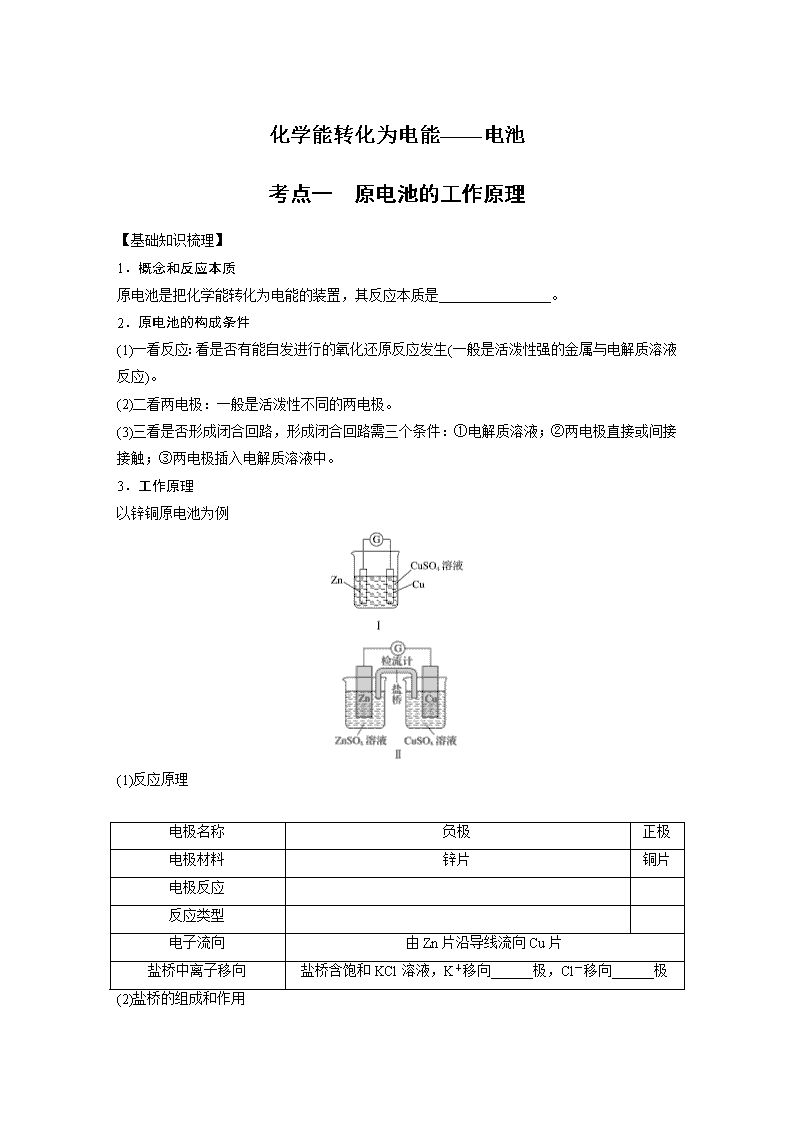
3.工作原理
以锌铜原电池为例
(1)反应原理
电极名称
负极
正极
电极材料
锌片
铜片
电极反应
反应类型
电子流向
由Zn片沿导线流向Cu片
盐桥中离子移向
盐桥含饱和KCl溶液,K+移向______极,Cl-移向______极
(2)盐桥的组成和作用
①盐桥中装有饱和的KCl、KNO3等溶液和琼胶制成的胶冻。
②盐桥的作用:a.连接内电路,形成闭合回路;b.平衡电荷,使原电池不断产生电流。
深度思考
正误判断,正确的打“√”,错误的打“×”
(1)在原电池中,发生氧化反应的一极一定是负极( )
(2)在原电池中,负极材料的活泼性一定比正极材料强( )
(3)在原电池中,正极本身一定不参与电极反应,负极本身一定要发生氧化反应( )
(4)在锌铜原电池中,因为有电子通过电解质溶液形成闭合回路,所以有电流产生( )
(5)原电池工作时,溶液中的阳离子向负极移动,盐桥中的阳离子向正极移动( )
(6)两种活泼性不同的金属组成原电池的两极,活泼金属一定作负极( )
【解题探究】
题组一 原电池的形成条件及正负极的判断
1.有关电化学知识的描述正确的是( )
A.CaO+H2O===Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能
B.原电池的两极一定是由活动性不同的两种金属组成
C.从理论上讲,任何能自发进行的氧化还原反应都可设计成原电池
D.原电池工作时,正极表面一定有气泡产生
2.在如图所示的8个装置中,属于原电池的是__________________。
3.(2017·福州质检)分析下图所示的四个原电池装置,其中结论正确的是( )
A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C.③中Fe作负极,电极反应式为Fe-2e-===Fe2+
D.④中Cu作正极,电极反应式为2H++2e-===H2↑
【反思归纳】
1.规避原电池工作原理的3个失分点
(1)原电池闭合回路的形成有多种方式,可以是导线连接两个电极,也可以是两电极相接触。
(2)电解质溶液中阴、阳离子的定向移动,与导线中电子的定向移动共同组成了一个完整的闭合回路。
(3)无论在原电池还是在电解池中,电子均不能通过电解质溶液。
2.判断原电池正、负极的5种方法
说明 原电池的正极和负极与电极材料的性质有关,也与电解质溶液有关,不要形成活泼电极一定作负极的思维定势。
题组二 应用原电池原理比较金属活动性强弱
4.有A、B、C、D、E五块金属片,进行如下实验:
(1)A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极,活动性________;
(2)C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C,活动性________;
(3)A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡,活动性________;
(4)B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应,活动性________;
(5)用惰性电极电解含B离子和E离子的溶液,E先析出,活动性________。
综上所述,这五种金属的活动性从强到弱的顺序为________________。
5.(2016·襄阳一模)有A、B、C、D四种金属,做如下实验:①将A与B用导线连接起来,
浸入电解质溶液中,B不易腐蚀;②将A、D分别投入等物质的量浓度的盐酸中,D比A反应剧烈;③将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是( )
A.A>B>C>D B.C>D>A>B
C.D>A>B>C D.A>B>D>C
题组三 聚焦“盐桥”原电池
6.根据下图,下列判断中正确的是( )
A.烧杯a中的溶液pH降低
B.烧杯b中发生氧化反应
C.烧杯a中发生的反应为2H++2e-===H2↑
D.烧杯b中发生的反应为2Cl--2e-===Cl2↑
7.控制适合的条件,将反应2Fe3++2I-2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.检流计读数为零时,反应达到化学平衡状态
D.检流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
8.下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO+2I-+2H+AsO+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
下列叙述中正确的是( )
A.甲组操作时,检流计(G)指针发生偏转
B.甲组操作时,溶液颜色变浅
C.乙组操作时,C2作正极
D.乙组操作时,C1上发生的电极反应为I2+2e-===2I-
规律总结
当氧化剂得电子速率与还原剂失电子速率相等时,可逆反应达到化学平衡状态,电流表指针示数为零;当电流表指针往相反方向偏转,暗示电路中电子流向相反,说明化学平衡移动方向相反。
考点二 化学电源
【基础知识梳理】
1.日常生活中的三种电池
(1)碱性锌锰干电池——一次电池
正极反应:2MnO2+2H2O+2e-===2MnOOH+2OH-;
负极反应:__________________________________________________________________;
总反应:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2。
(2)锌银电池——一次电池
负极反应:Zn+2OH--2e-===Zn(OH)2;
正极反应:Ag2O+H2O+2e-===2Ag+2OH-;
总反应:______________________________________________________________________。
(3)二次电池(可充电电池)
铅蓄电池是最常见的二次电池,负极材料是__________,正极材料是________。
①放电时的反应
a.负极反应:________________________________________________________________;
b.正极反应:________________________________________________________________;
c.总反应:Pb+PbO2+2H2SO4===2PbSO4+2H2O。
②充电时的反应
a.阴极反应:_________________________________________________________________;
b.阳极反应:_________________________________________________________________;
c.总反应:2PbSO4+2H2O===Pb+PbO2+2H2SO4。
注:可逆电池的充、放电不能理解为可逆反应。
2.“高效、环境友好”的燃料电池
氢氧燃料电池是目前最成熟的燃料电池,可分酸性和碱性两种。
种类
酸性
碱性
负极反应式
2H2-4e-===4H+
正极反应式
O2+2H2O+4e-===4OH-
电池总反应式
2H2+O2===2H2O
备注
燃料电池的电极不参与反应,有很强的催化活性,起导电作用
深度思考
1.可充电电池充电时电极与外接电源的正、负极如何连接?
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
2.(1)氢氧燃料电池以KOH溶液作电解质溶液时,工作一段时间后,电解质溶液的浓度将________(填“减小”、“增大”或“不变”,下同),溶液的pH_______________________。
(2)氢氧燃料电池以H2SO4溶液作电解质溶液时,工作一段时间后,电解质溶液的浓度将________(填“减小”、“增大”或“不变”,下同),溶液的pH________。
【解题探究】
1.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2OCd(OH)2+2Ni(OH)2,有关该电池的说法正确的是( )
A.充电时阳极反应:Ni(OH)2+OH--e-===NiOOH+H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
2.有一种MCFC型燃料电池,该电池所用燃料为H2,电解质为熔融的K2CO3。电池的总反应为2H2+O2===2H2O,负极反应:H2+CO-2e-===H2O+CO2。下列说法正确的是( )
A.电路中的电子经正极、熔融的K2CO3、负极后再到正极,形成闭合回路
B.电池放电时,电池中CO的物质的量将逐渐减少
C.正极反应为:2H2O+O2+4e-===4OH-
D.放电时CO向负极移动
3.铅蓄电池是典型的可充电电池,它的正、负极板是惰性材料,电池总反应式为
Pb+PbO2+4H++2SO2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是____________________________________________
________________________________________________________________________;
电解液中H2SO4的浓度将变________;当外电路通过1mol电子时,理论上负极板的质量增加________g。
(2)在完全放电耗尽PbO2和Pb时,若按如图连接,电解一段时间后,则在A电极上生成________,B电极上生成________,此时铅蓄电池的正极、负极的极性将__________________。
反思归纳
可充电电池常考查内容
(1)充、放电时电极的判断。
(2)充、放电时电极反应及反应类型的判断。
(3)充、放电时离子(外电路中电子的移动方向的判断)。
(4)充、放电时电解质溶液离子浓度的变化,特别是酸、碱性的变化。
考点三 金属的腐蚀与防护
【基础知识梳理】
1.金属腐蚀的本质
金属原子____________变为____________,金属发生____________。
2.金属腐蚀的类型
(1)化学腐蚀与电化学腐蚀
类型
化学腐蚀
电化学腐蚀
条件
金属跟__________________接触
不纯金属或合金跟______________接触
现象
______电流产生
________电流产生
本质
金属被______
较活泼金属被______
联系
两者往往同时发生,________腐蚀更普遍
(2)析氢腐蚀与吸氧腐蚀
以钢铁的腐蚀为例进行分析:
类型
析氢腐蚀
吸氧腐蚀
条件
电极
反应
负极
正极
总反应式
联系
____________更普遍
3.金属的防护
(1)电化学防护
①牺牲阳极的阴极保护法—__________原理
a.________极:比被保护金属活泼的金属;
b.________极:被保护的金属设备。
②外加电流的阴极保护法—________原理
a.________极:被保护的金属设备;
b.________极:惰性金属或石墨。
(2)改变金属的内部结构,如制成合金、不锈钢等。
(3)加防护层,如在金属表面喷油漆、涂油脂、电镀、喷镀或表面钝化等方法。
深度思考
1.正误判断,正确的打“√”,错误的打“×”
(1)纯银器表面变黑和钢铁表面生锈腐蚀原理一样( )
(2)Al、Fe、Cu在潮湿的空气中腐蚀均生成氧化物( )
(3)钢铁发生电化学腐蚀时,负极铁失去电子生成Fe3+( )
(4)在金属表面覆盖保护层,若保护层破损后,就完全失去了对金属的保护作用( )
(5)外加电流的阴极保护法,构成了电解池;牺牲阳极的阴极保护法构成了原电池。二者均能有效地保护金属不容易被腐蚀( )
2.写出钢铁在潮湿的空气中发生吸氧腐蚀生成铁锈的原理。
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
【解题探究】
题组一 腐蚀快慢与防护方法的比较
1.如图所示,各烧杯中盛有海水,铁在其中被腐蚀的速率由快到慢的顺序为( )
A.②①③④⑤⑥ B.⑤④③①②⑥
C.⑤④②①③⑥ D.⑤③②④①⑥
2.下列与金属腐蚀有关的说法,正确的是( )
A.图1中,铁钉易被腐蚀
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
反思归纳
1.判断金属腐蚀快慢的规律
(1)对同一电解质溶液来说,腐蚀速率的快慢:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐措施的腐蚀。
(2)对同一金属来说,在不同溶液中腐蚀速率的快慢:强电解质溶液中>弱电解质溶液中>非电解质溶液中。
(3)活动性不同的两种金属,活动性差别越大,腐蚀速率越快。
(4)对同一种电解质溶液来说,电解质溶液浓度越大,金属腐蚀越快。
2.两种保护方法的比较
外加电流的阴极保护法保护效果大于牺牲阳极的阴极保护法。
题组二 正确判断析氢腐蚀和吸氧腐蚀
3.(2016·郑州高三模拟)一定条件下,碳钢腐蚀与溶液pH的关系如下表。
pH
2
4
6
6.5
8
13.5
14
腐蚀快慢
较快
慢
较快
主要产物
Fe2+
Fe3O4
Fe2O3
FeO
下列说法错误的是( )
A.当pH<4时,碳钢主要发生析氢腐蚀
B.当pH>6时,碳钢主要发生吸氧腐蚀
C.当pH>14时,正极反应为O2+4H++4e-===2H2O
D.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓
4.利用下图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是( )
A.a管发生吸氧腐蚀,b管发生析氢腐蚀
B.一段时间后,a管液面高于b管液面
C.a处溶液的pH增大,b处溶液的pH减小
D.a、b两处具有相同的电极反应式:Fe-2e-===Fe2+
题组三 高考对金属腐蚀与防护的考查
5.正误判断,正确的打“√”,错误的打“×”
(1)验证铁的吸氧腐蚀,可以将铁钉放入试管中,用盐酸浸没( )
(2015·福建理综,8D)
(2)钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀( )
(2015·江苏,11C)
(3)( )
(2015·四川理综,3C)
6.(2015·上海,14)研究电化学腐蚀及防护的装置如下图所示。下列有关说法错误的是( )
A.d为石墨,铁片腐蚀加快
B.d为石墨,石墨上电极反应为O2+2H2O+4e-―→4OH-
C.d为锌块,铁片不易被腐蚀
D.d为锌块,铁片上电极反应为2H++2e-―→H2↑
答案解析
考点一
基础知识梳理
1.氧化还原反应
3.(1)(从左到右,从上到下)Zn-2e-===Zn2+
Cu2++2e-===Cu 氧化反应 还原反应 正 负
深度思考
(1)√ (2)× (3)× (4)× (5)× (6)×
解题探究
1.C
2.②④⑥⑦
3.B [②中Mg不与NaOH溶液反应,而Al能和NaOH溶液反应失去电子,故Al是负极;③中Fe在浓硝酸中钝化,Cu和浓HNO3反应失去电子作负极,A、C错;②中电池总反应为2Al+2NaOH+2H2O===2NaAlO2+3H2↑,负极反应式为2Al+8OH--6e-===2AlO+4H2O,二者相减得到正极反应式为6H2O+6e-===6OH-+3H2↑,B正确;④中Cu是正极,电极反应式为O2+2H2O+4e-===4OH-,D错。]
4.(1)A>B (2)C>D (3)A>C (4)D>B(5)B>E A>C>D>B>E
5.C
6.B [由题给原电池装置可知,电子经过导线,由Zn电极流向Fe电极,则O2在Fe电极发生还原反应:O2+2H2O+4e-===4OH-,烧杯a中c(OH-)增大,溶液的pH升高;烧杯b中,Zn发生氧化反应:Zn-2e-===Zn2+。]
7.D [由图示结合原电池原理分析可知,Fe3+得电子变成Fe2+被还原,I-失去电子变成I2被氧化,所以A、B正确;检流计读数为零时,Fe3+得电子速率等于Fe2+失电子速率,反应达到平衡状态,C正确;D项,在甲中溶入FeCl2固体,平衡2Fe3++2I-2Fe2++I2
向左移动,I2被还原为I-,乙中石墨为正极,D不正确。]
8.D
考点二
基础知识梳理
1.(1)Zn+2OH--2e-===Zn(OH)2
(2)Zn+Ag2O+H2O===Zn(OH)2+2Ag
(3)Pb PbO2
①Pb+SO-2e-===PbSO4
PbO2+4H++SO+2e-===PbSO4+2H2O
②PbSO4+2e-===Pb+SO
PbSO4+2H2O-2e-===PbO2+4H++SO
2.(从左到右,从上到下)2H2+4OH--4e-===4H2O
O2+4e-+4H+===2H2O
深度思考
1.
2.(1)减小 减小 (2)减小 增大
解题探究
1.A
2.D [电子不能通过熔融的K2CO3,故A项错误;该电池的正极反应为O2+4e-+2CO2===2CO,根据电子守恒,放电时负极消耗CO与正极生成CO的物质的量相等,电池中CO的物质的量不变,故B、C错误;放电时阴离子向负极移动,D项正确。]
3.(1)PbO2+2e-+4H++SO===PbSO4+2H2O 小 48
(2)Pb PbO2 对换
考点三
基础知识梳理
1.失去电子 金属阳离子 氧化反应
2.(1)(从左到右,从上到下)非金属单质直接 电解质溶液 无 有微弱 氧化 氧化 电化学(2)水膜酸性较强(pH≤4.3) 水膜酸性很弱或呈中性Fe-2e-===Fe2+
2H++2e-===H2↑ O2+2H2O+4e-===4OH- Fe+2H+===Fe2++H2↑
2Fe+O2+2H2O===2Fe(OH)2 吸氧腐蚀
3.(1)①原电池 负 正 ②电解 阴 阳
深度思考
1.(1)× (2)× (3)× (4)× (5)√
2.铁锈的形成
负极:2Fe-4e-===2Fe2+
正极:O2+4e-+2H2O===4OH-
2Fe+O2+2H2O===2Fe(OH)2
4Fe(OH)2+O2+2H2O===4Fe(OH)3
2Fe(OH)3===Fe2O3·xH2O(铁锈)+(3-x)H2O
解题探究
1.C
2.C [A项,图1中,铁钉处于干燥环境,不易被腐蚀;B项,负极反应为Fe-2e-===Fe2+,Fe2+与K3[Fe(CN)6]反应生成KFe[Fe(CN)6]蓝色沉淀;D项,为牺牲阳极的阴极保护法,镁块相当于原电池的负极。]
3.C [C项正极反应为O2+4e-+2H2O===4OH-。]
4.C [根据装置图判断,左边铁丝发生吸氧腐蚀,右边铁丝发生析氢腐蚀,其电极反应为
左边 负极:Fe-2e-===Fe2+
正极:O2+4e-+2H2O===4OH-
右边 负极:Fe-2e-===Fe2+
正极:2H++2e-===H2↑
a、b处的pH均增大,C错误。]
5.(1)× (2)√ (3)√
6.D
相关文档
- 2020届高考化学一轮复习化学实验常2021-08-2414页
- 2020届高考化学一轮复习化学工艺流2021-08-2414页
- 2020版高考一轮复习化学通用版学案2021-08-245页
- 2021届高考化学一轮复习化学反应速2021-08-2413页
- 2020版高考一轮复习化学通用版学案2021-08-236页
- 2021版高考化学一轮复习化学常用仪2021-08-2312页
- 2020届高考化学一轮复习化学反应速2021-08-2318页
- 2020届高考化学一轮复习化学反应与2021-08-239页
- 2021届(鲁科版)高考化学一轮复习化学2021-08-234页
- 2020版高考一轮复习化学通用版学案2021-08-236页