- 114.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
素养说明:通过对盐酸、硝酸和硫酸的工业制取的探究,体现学生学以致用的原则,以及赞赏化学对社会发展的重大贡献提高考生分析与解决实际问题的能力。
1.工业制硝酸——氨氧化法
(1)催化氧化
设备:氧化炉
反应:4NH3+5O24NO+6H2O 2NO+O2===2NO2
(2)NO2的吸收
设备:吸收塔
反应:3NO2+H2O===2HNO3+NO
说明:工业制硝酸过程中,由于有循环氧化吸收作用,故理论上1 mol NH3可制得1 mol HNO3。
2.工业制硫酸——接触法
(1)造气
①设备:沸腾炉
②原理:4FeS2+11O22Fe2O3+8SO2
(2)接触氧化
①设备:接触室
②原理:2SO2+O22SO3
(3)三氧化硫的吸收
①设备:吸收塔
②原理:SO3+H2O===H2SO4
(4)工业处理:
①炉气要净化,以防催化剂中毒。
②常压下(400 ℃~500 ℃)转化率已经很高,反应没必要采用高压操作。
③为了防止形成酸雾,提高吸收率,吸收SO3时不用水而用98.3%的浓H2SO4。
3.工业制盐酸——燃烧法
(1)制取:工业上制取盐酸时,首先在反应器中将氢气点燃,然后通入氯气进行反应,制得氯化氢气体。氯化氢气体冷却后被水吸收成为盐酸。在氯气和氢气的反应过程中,有毒的氯气被过量的氢气所包围,使氯气得到充分反应,防止了对空气的污染。
(2)应用:盐酸是化学工业重要原料之一,广泛用于化工原料、染料、医药、食品、印染、皮革、制糖、冶金等行业。
[题型专练]
1.在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见图)。下列说法错误的是( )
A.a、b两处的混合气体成分含量相同,温度不同
B.c、d两处的混合气体成分含量相同,温度不同
C.热交换器的作用是预热待反应的气体,冷却反应后的气体
D.c处气体经热交换后再次催化氧化的目的是提高SO2的转化率
答案 B
2.工业制取盐酸的方法是:H2和Cl2反应,生成的HCl用水吸收即得盐酸。试完成:
(1)工业制得的盐酸为何显黄色(即如何混入了________________________
Fe3+)_______________________________ _________________________________
____________________________________________________________________
_____________________________________________________________________。
(2)有两种制得HCl的方案:a.H2在Cl2中燃烧,b.Cl2在H2中燃烧。试分析工业实际采用的方案是选择了________(填序号),理由是______________________________________________________________________
____________________________________________________________________。
答案 (1)因输送Cl2的管道是钢管,在有少量水分存在时Cl2将Fe氧化成FeCl3,少量的FeCl3随着Cl2带入生成的HCl中
(2)b 因Cl2有毒,对环境污染较大,H2在Cl2中燃烧,必然是H2在管口,而Cl2易散逸造成污染,此方法的关键是设法在H2中点燃Cl2,即方案b
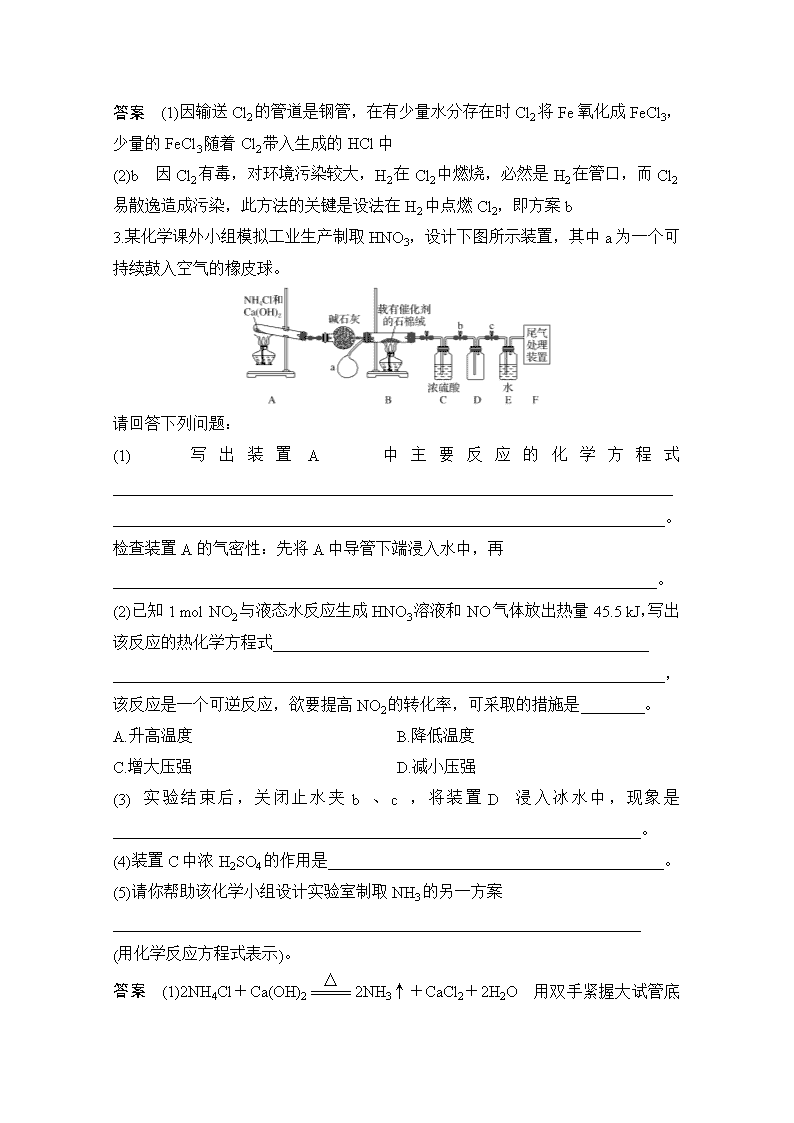
3.某化学课外小组模拟工业生产制取HNO3,设计下图所示装置,其中a为一个可持续鼓入空气的橡皮球。
请回答下列问题:
(1)写出装置A中主要反应的化学方程式______________________________________________________________________
_____________________________________________________________________。
检查装置A的气密性:先将A中导管下端浸入水中,再
____________________________________________________________________。
(2)已知1 mol NO2与液态水反应生成HNO3溶液和NO气体放出热量45.5 kJ,写出该反应的热化学方程式_______________________________________________
_____________________________________________________________________,
该反应是一个可逆反应,欲要提高NO2的转化率,可采取的措施是________。
A.升高温度 B.降低温度
C.增大压强 D.减小压强
(3)实验结束后,关闭止水夹b、c,将装置D浸入冰水中,现象是__________________________________________________________________。
(4)装置C中浓H2SO4的作用是__________________________________________。
(5)请你帮助该化学小组设计实验室制取NH3的另一方案
__________________________________________________________________
(用化学反应方程式表示)。
答案 (1)2NH4Cl+Ca(OH)22NH3↑+CaCl2+2H2
O 用双手紧握大试管底部,若导管口有气泡产生,双手离开,导管产生一段水柱,说明装置A不漏气
(2)3NO2(g)+H2O(l)===2HNO3(aq)+NO(g) ΔH=-136.5 kJ·mol-1 BC
(3)颜色变浅 (4)干燥气体、吸收多余的氨气
(5)NH3·H2ONH3↑+H2O
相关文档
- 2019届高考化学一轮复习化学与自然2021-08-247页
- 2021届(鲁科版)高考化学一轮复习化学2021-08-2414页
- 2020届高考化学一轮复习化学与STSE2021-08-247页
- 2021届高考化学一轮复习化学能与热2021-08-2413页
- 2020届高考化学一轮复习化学实验常2021-08-2414页
- 2020届高考化学一轮复习化学工艺流2021-08-2414页
- 2020版高考一轮复习化学通用版学案2021-08-245页
- 2021届高考化学一轮复习化学反应速2021-08-2413页
- 2020版高考一轮复习化学通用版学案2021-08-236页
- 2021版高考化学一轮复习化学常用仪2021-08-2312页