- 3.63 MB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
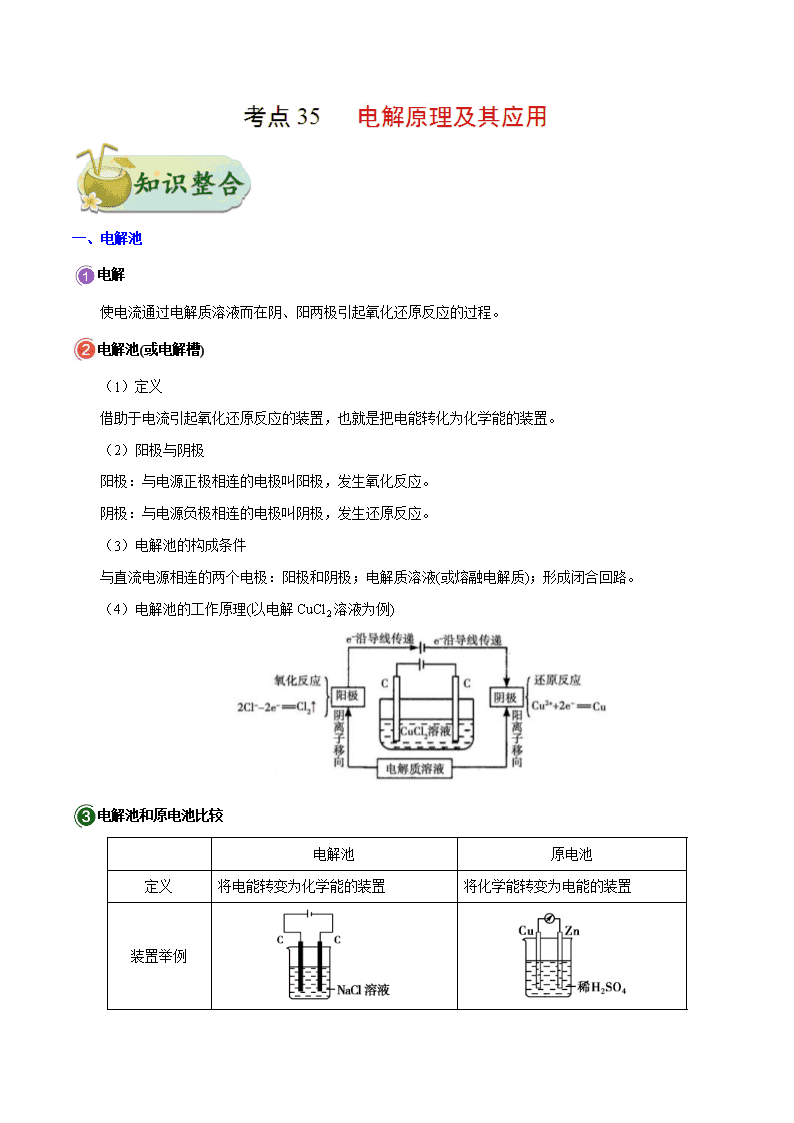
一、电解池
电解
使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程。
电解池(或电解槽)
(1)定义
借助于电流引起氧化还原反应的装置,也就是把电能转化为化学能的装置。
(2)阳极与阴极
阳极:与电源正极相连的电极叫阳极,发生氧化反应。
阴极:与电源负极相连的电极叫阴极,发生还原反应。
(3)电解池的构成条件
与直流电源相连的两个电极:阳极和阴极;电解质溶液(或熔融电解质);形成闭合回路。
(4)电解池的工作原理(以电解CuCl2溶液为例)
电解池和原电池比较
电解池
原电池
定义
将电能转变为化学能的装置
将化学能转变为电能的装置
装置举例
形成条件
①两个电极与直流电源相连
②电解质溶液
③形成闭合回路
①活泼性不同的两电极(连接)
②电解质溶液
③形成闭合回路
④能自发进行氧化还原反应
电极名称
阳极:与电源正极相连的极
阴极:与电源负极相连的极
负极:较活泼金属(电子流出的极)
正极:较不活泼金属(或能导电的非金属)(电子流入的极)
电极反应
阳极:溶液中的阴离子失电子,或电极金属失电子,发生氧化反应
阴极:溶液中的阳离子得电子,发生还原反应
负极:较活泼电极金属或阴离子失电子,发生氧化反应
正极:溶液中的阳离子或氧气得电子,发生还原反应
溶液中的离子移向
阴离子移向阳极,阳离子移向阴极
阴离子移向负极,阳离子移向正极
电子流向
电源负极阴极阳极电源正极
负极正极
实质
均发生氧化还原反应,两电极得失电子数相等
联系
原电池可以作为电解池的电源,二者共同形成闭合回路
电解池阴、阳极的判断
(1)由电源的正、负极判断:与电源负极相连的是电解池的阴极;与电源正极相连的是电解池的阳极。
(2)由电极现象确定:通常情况下,在电解池中某一电极若不断溶解或质量不断减少,则该电极发生氧化反应,为阳极;某一电极质量不断增加或电极质量不变,则该电极发生还原反应,为阴极。
(3)由反应类型判断:失去电子发生氧化反应的是阳极;得到电子发生还原反应的是阴极。
电解产物的判断
(1)阳极产物的判断
首先看电极,若是活性电极(一般是除Au、Pt外的金属),则电极材料本身失电子,电极被溶解形成阳离子进入溶液;若是惰性电极(如石墨、铂、金等),则根据溶液中阴离子放电顺序加以判断。
阳极放电顺序:
金属(一般是除Au、Pt外)>S2−>I−>Br−>Cl−>OH−>含氧酸根>F−。
(2)阴极产物的判断
直接根据溶液中阳离子放电顺序加以判断。阳离子放电顺序:
Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>H+>Al3+>Mg2+>Na+>Ca2+>K+。
(1)处理有关电解池两极产物的问题,一定要先看电极是活性电极还是惰性电极。活性电极在阳极放电,电极溶解生成相应的金属离子,此时阴离子在阳极不放电。对于惰性电极,则只需比较溶液中定向移动到两极的阴阳离子的放电顺序即可。
(2)根据阳离子放电顺序判断阴极产物时,要注意下列三点:
①阳离子放电顺序表中前一个c(H+)与其他离子的浓度相近,后一个c(H+)很小,来自水的电离;
②Fe3+得电子能力大于Cu2+,但第一阶段只能被还原到Fe2+;
③Pb2+、Sn2+、Fe2+、Zn2+控制一定条件(即电镀)时也能在水溶液中放电;Al3+、Mg2+、Na+、Ca2+、K+只有在熔融状态下放电。
二、电解原理的应用
1.电解饱和食盐水——氯碱工业
(1)电极反应
阳极:2Cl−−2e−===Cl2↑(反应类型:氧化反应)。
阴极:2H++2e−===H2↑(反应类型:还原反应)。
检验阳极产物的方法是:用湿润的KI淀粉试纸靠近阳极附近,若试纸变蓝,证明生成了Cl2。电解时向食盐水中加酚酞,阴极附近溶液变红,说明该电极附近产生的物质为NaOH。
(2)电解方程式
化学方程式:2NaCl+2H2O2NaOH+H2↑+Cl2↑
离子方程式:2Cl−+2H2O2OH−+H2↑+Cl2↑
2.电解精炼铜
电镀(Fe表面镀Cu)
电解精炼铜
阳极
电极材料
镀层金属铜
粗铜(含Zn、Fe、Ni、Ag、Au等杂质)
电极反应
Cu−2e−===Cu2+
Cu−2e−===Cu2+
Zn−2e−===Zn2+
Fe−2e−===Fe2+
Ni−2e−===Ni2+
阴极
电极材料
待镀金属铁
纯铜
电极反应
Cu2++2e−===Cu
电解质溶液
含Cu2+的盐溶液
注:电解精炼铜时,粗铜中的Ag、Au等不反应,沉积在电解池底部形成阳极泥
3.电镀
利用电解原理,在金属表面上镀上一层其它金属或合金的过程叫电镀。
①电极的连接:镀层金属或惰性电极做阳极,和外加电源的正极相连;镀件金属做阴极,和外加电源的负极相连。如铁上镀铜,铜(或石墨)做阳极,铁做阴极。学@科网
②电镀液的选择:选择含有镀层金属离子的溶液做电镀液,如铁上镀铜,选择硫酸铜溶液做电镀液。
③电极反应:阳极:Cu===Cu2+ +2e−,阴极:Cu2+ +2e−===Cu
④电镀的特点:若镀层金属做阳极,电镀过程中溶液中阳离子浓度不变;若用惰性电极做阳极,电镀过程中溶液中阳离子浓度减小。学*科网
电镀过程中,溶液中离子浓度不变;电解精炼铜时,由于粗铜中含有Zn、Fe、Ni等活泼金属,反应过程中失去电子形成阳离子存在于溶液中,而阴极上Cu2+被还原,所以电解精炼过程中,溶液中的阳离子浓度会发生变化。
4.电冶金
冶炼钠、钙、镁、铝等活泼金属,必须用电解法。如电解熔融氯化钠得到钠时:
注意:①电解熔融MgCl2冶炼镁,而不能电解熔融MgO冶炼镁,因MgO的熔点很高;
②电解熔融Al2O3冶炼铝,而不能电解AlCl3冶炼铝,因AlCl3是共价化合物,其熔融态不导电。
考向一 电解规律的考查
典例1 四个电解装置都以Pt作电极,它们分别装着如下电解质溶液进行电解,电解一段时间后,测定其pH变化,所记录的结果正确的是
选项
A
B
C
D
电解质溶液
HCl溶液
AgNO3溶液
KOH溶液
BaCl2溶液
pH变化
减小
增大
增大
不变
【答案】C
1.用石墨作电极电解CuSO4溶液。通电一段时间后,欲使电解液恢复到起始状态,应向溶液中加入适量的
A.CuSO4 B.H2O
C.CuO D.CuSO4·5H2O
用惰性电极电解电解质溶液的规律
类型
电解质特点
实例
电极反应
电解方程式
电解
对象
电解质溶液的变化
电解质溶液复原的方法
阴极
阳极
含氧酸
H2SO4
4H++4e−
4OH−−4e−
2H2O
水
浓度增大
加水
电解
水型
2H2↑
2H2O+O2↑
2H2↑+O2↑
可溶性强碱
NaOH
活泼金属含氧酸盐
KNO3
电解电
解质型
无氧酸
HCl
2H++2e− H2↑
2Cl−−2e− Cl2↑
2HCl
H2↑+Cl2↑
电解质
浓度减小
加HCl
不活泼金属无氧酸盐
CuCl2
Cu2++2e− Cu
2Cl−−2e−
Cl2↑
CuCl2
Cu+Cl2↑
加CuCl2
放H2
生碱型
活泼金属无氧酸盐
NaCl
2H++2e− H2↑
2Cl−−2e− Cl2↑
2NaCl+2H2O2NaOH+H2↑+Cl2↑
电解质
和水
生成新
电解质
加HCl
放O2
生酸型
不活泼金属含氧酸盐
CuSO4
Cu2++2e− Cu
4OH−−4e−
2H2O+O2↑
2CuSO4+2H2O2Cu+
2H2SO4+O2↑
电解质
和水
生成新
电解质
加CuO
考向二 电解原理的“常规”应用
典例1 金属镍有广泛的用途,粗镍中含有Fe、Zn、Cu、Pt等杂质,可用电解法制得高纯度的镍。下列叙述中正确的是(已知:氧化性Fe2+锌>铜>银发生氧化反应溶解,所以铁、锌、铜先后溶解反应变成离子,而银沉积形成阳极泥;纯铜作阴极与电源负极相连,发生还原反应Cu2++2e−Cu,有大量铜析出,所以①⑤错误。而电子只经过外电路,在电解池中是离子的相互移动,②错误;由于阳极失电子的有铁、锌、铜,阴极析出的只有铜,所以随着电解进行,铜离子的浓度逐渐减小,④正确,答案选D。
9.【答案】(1)Cu2++2e− ===Cu A
(1)Cu+2H+===Cu2++H2↑
(3)AgNO3 Ag N Zn−2e−===Zn2+ Cu−2e−===Cu2+
(4)3.92
板发生氧化反应,反应式为 Zn−2e−===Zn2+,Cu−2e−===Cu2+;
(4)当装置A中Cu电极质量改变6.4 g时,n(Cu)=0.1 mol,则转移0.2 mol电子,装置D中n(NaCl)=0.1 mol,阳极首先发生2Cl−2e−===Cl2↑、其次发生4OH−4e−===2H2O+O2↑,则阳极首先生成0.05 mol Cl2,其次生成0.025 mol O2,阴极只发生2H++2e−===H2↑,生成0.1 mol H2,则总共生成0.175 mol气体,体积为0.175 mol×22.4 L/mol=3.92 L。
【名师点睛】本题考查了原电池和电解池原理,为高频考点,侧重于学生的分析能力和计算能力的考查,难点是电极反应式的书写。在图中确定原电池和电解池是解得本题的关键,B和C装置形成原电池,锌作负极,铜作正极,正极上铜离子得电子生成铜,盐桥中的K+、Cl−的移动方向为K+移向正极,Cl−移向负极。
直通高考
1.【答案】C
【解析】
A、根据原理可知,Al要形成氧化膜,化合价升高失电子,因此铝为阳极,故A说法正确;B、不锈钢网接触面积大,能增加电解效率,故B说法正确;C、阴极应为阳离子得电子,根据离子放电顺序应是H+放电,即2H++2e−H2↑,故C说法错误;D、根据电解原理,电解时,阴离子移向阳极,故D说法正确。
【名师点睛】本题考查电解原理的应用,如本题得到致密的氧化铝,说明铝作阳极,因此电极方程式应是2Al−6e−+3H2OAl2O3+6H+,这就要求学生不能照搬课本知识,注意题干信息的挖掘,本题难度不大。
2.【答案】A
【解析】A、此装置为电解池,总反应是N2+3H22NH3,Pd电极b上是氢气发生反应,即氢气失去电子化合价升高,Pd电极b为阳极,故A说法错误;B、根据A选项分析,Pd电极a为阴极,反应式为N2+6H++6e−2NH3,故B说法正确;C、根据电解池的原理,阳离子在阴极上放电,即有阳极移向阴极,故C说法正确;D、根据装置图,陶瓷隔离N2和H2,故D说法正确。
【名师点睛】本题考查电解原理,首先判断阴阳两极,阴极连接电源的负极,阴极上得到电子化合价降低,发生还原反应,阳极连接电源的正极,阳极上失去电子化合价升高,发生氧化反应,然后判断电极材料,惰性电极还是活动性金属作电极,活动性金属作阳极,活动性金属先失电子,如果是惰性材料作阳极,则是还原性强的阴离子先失电子,氧化性强的离子在阴极上得电子;电极反应式的书写是高考的热点,一般需要根据装置图完成,需要看清反应环境。
3.【答案】B
应2H++2e− H2↑,一段时间后,Cu2+移动到m和n处,m、n处附近Cu2+浓度增大,发生反应Cu2++2e− Cu,m、n处能生成铜,D正确。
4.【答案】B
【解析】本题考查电解池原理,意在考查考生运用所学知识分析、解决问题的能力。该装置为电解池。H2O在正(阳)极区放电,生成O2和H+,中间隔室中的阴离子
通过cd膜移向正(阳)极,故正(阳)极区得到H2SO4,当电路中通过1 mol电子时生成0.25 mol O2,正(阳)极区溶液pH减小,H2O在负(阴)极区放电,生成OH−和H2,负(阴)极区溶液pH增大,A、C、D项错误。H2O在负(阴)极区放电生成H2和OH−,中间隔室中的阳离子Na+通过ab膜移向负(阴)极,故负(阴)极区可得到NaOH,而正(阳)极区可得到H2SO4,故B项正确。学¥科网
5.【答案】D
之比为2∶1,D项错误。
为什么古人“三天打鱼,两天晒网”
因为过去的渔网是用麻纤维织的,麻纤维吸水易膨胀,潮湿时易腐烂,所以渔网用上两三天后要晒两天,以延长渔网的寿命。现在用不着这样做了,因为现在一般选用尼龙纤维来编织渔网。尼龙纤维学名为聚酰胺纤维,聚酰胺纤维最突出的优点为耐磨,耐腐。
相关文档
- 2019届高考化学一轮复习化学与自然2021-08-247页
- 2021届(鲁科版)高考化学一轮复习化学2021-08-2414页
- 2020届高考化学一轮复习化学与STSE2021-08-247页
- 2021届高考化学一轮复习化学能与热2021-08-2413页
- 2020届高考化学一轮复习化学实验常2021-08-2414页
- 2020届高考化学一轮复习化学工艺流2021-08-2414页
- 2020版高考一轮复习化学通用版学案2021-08-245页
- 2021届高考化学一轮复习化学反应速2021-08-2413页
- 2020版高考一轮复习化学通用版学案2021-08-236页
- 2021版高考化学一轮复习化学常用仪2021-08-2312页