- 463.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
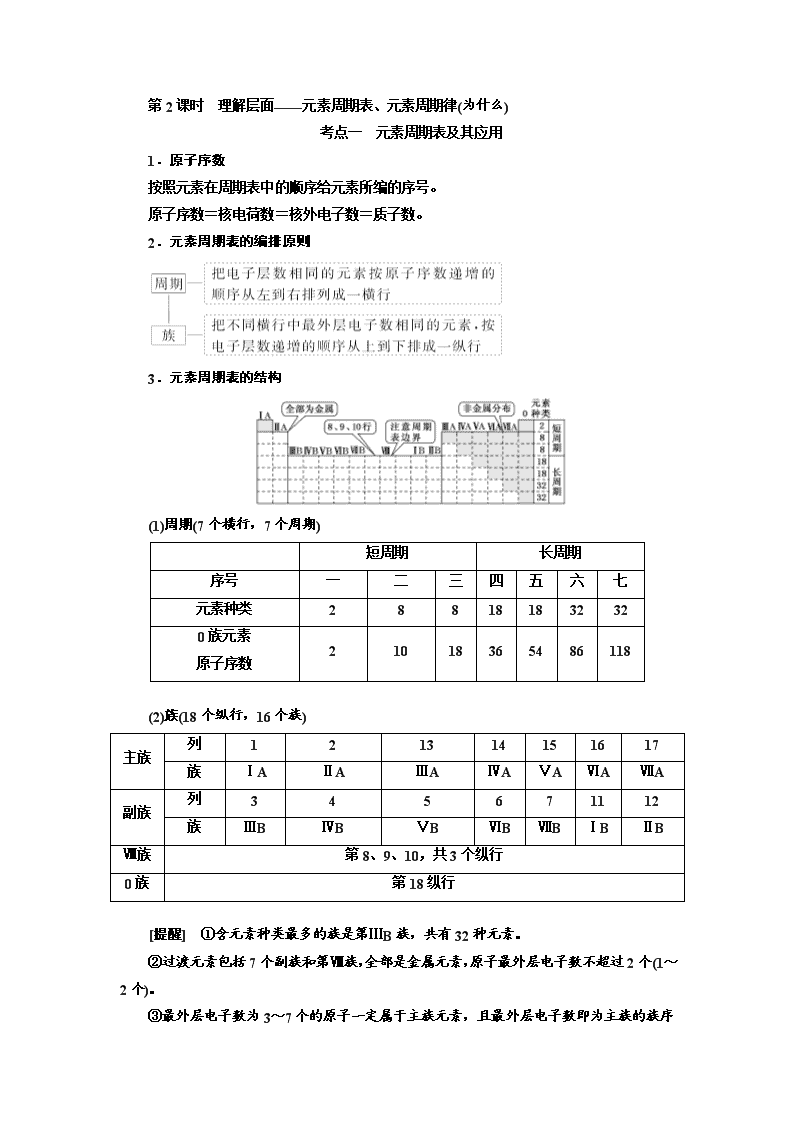
第2课时 理解层面——元素周期表、元素周期律(为什么)
考点一 元素周期表及其应用
1.原子序数
按照元素在周期表中的顺序给元素所编的序号。
原子序数=核电荷数=核外电子数=质子数。
2.元素周期表的编排原则
3.元素周期表的结构
(1)周期(7个横行,7个周期)
短周期
长周期
序号
一
二
三
四
五
六
七
元素种类
2
8
8
18
18
32
32
0族元素
原子序数
2
10
18
36
54
86
118
(2)族(18个纵行,16个族)
主族
列
1
2
13
14
15
16
17
族
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
副族
列
3
4
5
6
7
11
12
族
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
ⅠB
ⅡB
Ⅷ族
第8、9、10,共3个纵行
0族
第18纵行
[提醒] ①含元素种类最多的族是第ⅢB族,共有32种元素。
②过渡元素包括7个副族和第Ⅷ族,全部是金属元素,原子最外层电子数不超过2个(1~2个)。
③最外层电子数为3~7
个的原子一定属于主族元素,且最外层电子数即为主族的族序数。
(3)元素周期表中元素的分区
①分界线:如图所示,沿着元素周期表中铝、锗、锑、钋与硼、硅、砷、碲、砹的交界处画一条斜线,即为金属元素区和非金属元素区分界线(氢元素除外)。
②各区位置:分界线左下方为金属元素区,分界线右上方为非金属元素区。
③分界线附近元素的性质:既表现金属元素的性质,又表现非金属元素的性质。
(4)元素周期表中的特殊位置
过渡元素
元素周期表中从第ⅢB族到第ⅡB族10个纵列共60多种元素,这些元素都是金属元素
镧系
元素周期表第六周期中,57号元素镧到71号元素镥共15种元素
锕系
元素周期表第七周期中,89号元素锕到103号元素铹共15种元素
超铀元素
在锕系元素中,92号元素铀(U)以后的各种元素
4.元素周期表的三大应用
(1)科学预测
为新元素的发现及预测他们的原子结构和性质提供了线索。
(2)寻找新材料
(3)用于工农业生产
对探矿有指导意义的是地球化学元素的分布与它们在元素周期表中的位置关系,研制农药材料等。
[考法精析]
考法一 元素周期表的结构及应用
[典例1] 如图为元素周期表中前四周期的一部分,若B元素的核电荷数为x,则这五种元素的核电荷数之和为( )
A.5x+10 B.5x
C.5x+14 D.5x+16
[解析] 前四周期五种元素在周期表中的相对位置为
故五种元素的核电荷数之和为5x+10。
[答案] A
[备考方略] 同主族、邻周期元素的原子序数差的关系
①第ⅠA族元素,随电子层数的增加,原子序数依次相差2、8、8、18、18、32。
②第ⅡA族和0族元素,随电子层数的增加,原子序数依次相差8、8、18、18、32。
③第ⅢA~ⅦA族元素,随电子层数的增加,原子序数依次相差8、18、18、32、32。
考法二 元素在周期表中的位置推测
[典例2] 国际理论与应用化学联合会已正式确定了第114号和第116号元素的名称缩写为Fl、Lv。下列有关这两种元素的说法错误的是( )
A.两种元素位于同一周期
B.116号元素位于第ⅥA族
C.两种元素都是活泼的非金属元素
D.114号元素的原子半径比116号元素的大
[解析] 第114号元素和第116号元素分别处于第七周期ⅣA族和ⅥA族,均为金属元素,A、B正确,C错误;依据同周期原子半径递变规律判断114号元素的原子半径比116号元素的原子半径大,D正确。
[答案] C
[备考方略]
由稀有气体元素的原子序数确定元素在周期表中位置
原子序数-最邻近的稀有气体元素的原子序数=ΔZ。
若ΔZ<0,则与稀有气体元素同周期,族序数为8-|ΔZ|;
若ΔZ>0,则在稀有气体元素下一周期,族序数为ΔZ。
例如①35号元素(最邻近的是36Kr),则35-36=-1,故周期数为4,族序数为8-|-1|=7,即第四周期第ⅦA族,为溴元素。
②87号元素(相邻近的是86Rn),则87-86=1,故周期数为7,族序数为1,即第七周期第ⅠA族,为钫元素。
[综合训练]
1.下列说法正确的是( )
A.原子序数为7的元素的最高化合价为+4价
B.114号元素位于第七周期第 ⅣA族
C.位于同一主族的甲、乙两种元素,甲的原子序数为m,则乙的原子序数可能为m+4
D.位于同一周期的甲、乙两种元素,甲位于第ⅠA族,原子序数为m,乙位于第ⅢA族,则乙原子序数可能为m+19
解析:选B 原子序数为7的元素为氮元素,其最高化合价为+5价,A错误;118号元素位于第七周期0族,114号元素位于第七周期第ⅣA族,B正确;同一主族的元素相差2、8、18、32或上述数字间的和,C错误;同一周期第ⅠA族与第ⅢA族之间的差可能为2、12、26,D错误。
2.A、B、C均为短周期元素,它们在周期表中的相对位置如图所示。已知:B、C两元素原子最外层电子数之和等于A元素原子最外层电子数的2倍;B、C两元素的核电荷数之和是A元素原子序数的4倍。则A、B、C分别是( )
A.O、P、Cl B.N、Si、S
C.C、Al、P D.F、S、Ar
解析:选A 设A、B、C三种元素的原子序数分别为a、b、c,由三种元素在元素周期表中的相对位置可知a+8-1=b,a+8+1=c,且b+c=4a,所以a=8,b=15,c=17,即A、B、C分别是O、P、Cl。
考点二 元素周期律及其应用
1.元素周期律
2.具体表现形式
项目
同周期(左→右)
同主族(上→下)
原子结构
核电荷数
逐渐增大
逐渐增大
电子层数
相同
逐渐增多
原子半径
逐渐减小
逐渐增大
离子半径
阳离子逐渐减小
阴离子逐渐减小
r(阴离子)>r(阳离子)
逐渐增大
性 质
化合价
最高正化合价由+1→+7(O、F除外)
最低负化合价=-(8-主族序数)
相同,最高正化合价=主族序数(O、F
除外)
元素的金属性和非金属性
金属性逐渐减弱
非金属性逐渐增强
金属性逐渐增强
非金属性逐渐减弱
离子的氧化性、还原性
阳离子氧化性逐渐增强
阴离子还原性逐渐减弱
阳离子氧化性逐渐减弱
阴离子还原性逐渐增强
气态氢化物稳定性
逐渐增强
逐渐减弱
最高价氧化物对应的水化物的酸碱性
碱性逐渐减弱
酸性逐渐增强
碱性逐渐增强
酸性逐渐减弱
3.元素周期律的两大应用
(1)比较不同周期、不同主族元素的性质
①比较Ca(OH)2和Al(OH)3的碱性强弱方法:
金属性:Mg>Al,Ca>Mg,则碱性:Ca(OH)2>Mg(OH)2>Al(OH)3。
②比较H2O和SiH4的稳定性强弱的方法:
非金属性:C>Si,O>C,则氢化物稳定性:H2O>CH4>SiH4。
(2)预测未知元素的某些性质
①已知Ca(OH)2微溶,Mg(OH)2难溶,可推知Be(OH)2难溶。
②已知卤族元素的性质递变规律,可推知未学元素砹(At)的化合物的性质为HAt不稳定,水溶液呈酸性,AgAt难溶于水。
[考法精析]
考法一 金属性、非金属性的强弱比较
[典例1] 下列实验不能达到实验目的的是( )
选项
实验操作
实验目的
A
Cl2、Br2分别与H2反应
比较氯、溴的非金属性强弱
B
向MgCl2、AlCl3溶液中分别通入氨
比较镁、铝的金属性强弱
C
测定相同物质的量浓度的Na2CO3、Na2SO4溶液的pH
比较碳、硫的非金属性强弱
D
Fe、Cu分别与稀盐酸反应
比较铁、铜的金属性强弱
[解析] A项,Cl2、Br2分别与H2反应,根据反应条件的难易和反应剧烈程度可判断出氯、溴的非金属性强弱;B项,向MgCl2、AlCl3溶液中分别通入氨,MgCl2与AlCl3分别生成Mg(OH)2、Al(OH)3沉淀,不能比较二者的金属性强弱;C
项,测定相同物质的量浓度的Na2CO3、Na2SO4溶液的pH,根据pH可判断出Na2CO3与Na2SO4水解程度的大小,即判断出酸性:H2CO3Cl,但Cl2比O2活泼,原因是O2中存在O双键,比Cl—Cl单键难断裂。
考法二 粒子半径的大小比较
[典例2] 已知短周期元素的四种离子A2+、B+、C3-、D-具有相同的电子层结构,则下列叙述中正确的是( )
A.原子序数:D>C>B>A
B.原子半径:B>A>C>D
C.离子半径:C3->D->A2+>B+
D.氧化性:A2+>B+,还原性:C3-B,C、D在上一周期,为非金属元素,且原子序数D>C。由电子层数越多的原子序数越大,同周期从左向右原子序数增大,所以原子序数为A>B>D>C,故A
错误;电子层越多,半径越大,同周期原子序数越大,半径越小,则原子半径为B>A>C>D,故B正确;具有相同电子层结构的离子,原子序数大的离子半径小,原子序数为A>B>D>C,则离子半径为C3->D->B+>A2+,故C错误;金属性越强,其阳离子的氧化性越弱,金属性为B>A,则氧化性:A2+>B+,非金属性:CD-,故D错误。
[答案] B
[备考方略] 粒子半径大小的比较方法
考法三 根据元素周期律预测元素的性质
[典例3] 应用元素周期律分析下列推断,其中正确的是( )
A.铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
B.气态氢化物的稳定性HF低于HCl
C.硒(Se)位于元素周期表第ⅥA族,其最高价氧化物对应水化物的酸性比硫酸弱
D.第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
[解析] 在元素周期表中,铊位于铝的下面,其金属性比铝的金属性强,不与碱反应,A项错误;氟的非金属性比氯强,气态氢化物稳定性HF较强,B项错误;NH3的水溶液呈碱性,D项错误。
[答案] C
[备考方略] 依据周期律预测元素性质的流程
对于同一主族的陌生元素,首先确定它在元素周期表中的位置,然后确定它是金属元素还是非金属元素,再根据同族元素性质的相似性、递变性及同周期元素的性质变化规律(元素周期律),来推测该元素及其化合物的性质。如已知卤族元素的性质递变规律,可推知元素砹(At)的单质应为有色固体,与H2难化合,HAt不稳定,HAt水溶液呈酸性,AgAt
不溶于水等。
[综合训练]
1.砷(As)和镓(Ga)都是第四周期元素,分别属于ⅤA和ⅢA族。下列说法中不正确的是( )
A.原子半径:Ga>As>P
B.热稳定性:NH3>PH3>AsH3
C.酸性:H3AsO4>H2SO4>H3PO4
D.Ga(OH)3可能是两性氢氧化物
解析:选C 酸性:H2SO4>H3PO4>H3AsO4,故C项错误。
2.下列各性质中不符合图示关系的是( )
A.还原性
B.与水反应的剧烈程度
C.熔点
D.原子半径
解析:选C 图中表示碱金属的某项性质随核电荷数的增大而逐渐增大或升高。A项,随着核电荷数增大,碱金属元素的还原性逐渐增强;B项,随着核电荷数增大,碱金属单质与水反应的剧烈程度逐渐增大;C项,随着核电荷数增大,碱金属的熔点逐渐降低;D项,随着核电荷数增大,碱金属元素的原子半径逐渐增大。
3.X、Y、Z均为短周期元素,其中两种为金属元素,一种为非金属元素,其原子半径分别为
元素
X
Y
Z
原子半径/nm
0.154
0.130
0.071
X、Y处于同一周期,三种元素形成的简单离子具有相同的电子层结构。下列说法正确的是( )
A.原子最外层电子数:Z>X>Y
B.三种元素可能为同周期元素
C.原子序数:Y>X>Z
D.离子半径:X>Y>Z
解析:选C 由已知得三种元素在周期表中相对位置为,最外层电子数Z>Y>X,故A、B错误;由位置可知,原子序数Y>X>Z,故C正确;具有相同电子层结构的离子,原子序数大的离子半径小,则离子半径Z>X>Y,故D错误。
4.X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示。下列说法正确的是( )
A.Y、Z、X三种元素的原子半径依次增大
B.X、Z都是第二周期第ⅥA族元素,单质的氧化性:X>Z
C.Y的气态氢化物的热稳定性比Z的强
D.R元素与W同族且处于相邻周期,则R元素最高价氧化物对应的水化物的酸性比Z的强
解析:选D 根据元素周期表中位置关系可知X为氧元素,W为氟元素,Y为硅元素,Z为硫元素。由于同周期元素原子半径从左到右依次减小,同主族元素原子半径从上而下依次增大,故Y、Z、X三种元素的原子半径依次减小,A错误;X、Z分别是第二周期第ⅥA族元素和第三周期第ⅥA族元素,单质的氧化性:X>Z,B错误;SiH4的热稳定性比H2S的弱,C错误;R元素与W同族且位于相邻周期,则R为氯元素,其最高价氧化物对应的水化物HClO4的酸性比H2SO4强,D正确。
相关文档
- 2019届高考化学一轮复习化学与自然2021-08-247页
- 2021届(鲁科版)高考化学一轮复习化学2021-08-2414页
- 2020届高考化学一轮复习化学与STSE2021-08-247页
- 2021届高考化学一轮复习化学能与热2021-08-2413页
- 2020届高考化学一轮复习化学实验常2021-08-2414页
- 2020届高考化学一轮复习化学工艺流2021-08-2414页
- 2020版高考一轮复习化学通用版学案2021-08-245页
- 2021届高考化学一轮复习化学反应速2021-08-2413页
- 2020版高考一轮复习化学通用版学案2021-08-236页
- 2021版高考化学一轮复习化学常用仪2021-08-2312页