- 142.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时分层作业(十九)
(建议用时:40分钟)
[基础达标练]
1.下列关于原电池的叙述正确的是( )
A.构成原电池的正极和负极必须是两种不同的金属
B.原电池是将化学能转变为电能的装置
C.原电池中电子流出的一极是负极,该极被还原
D.原电池工作时,电流的方向是从负极到正极
B [A项,构成原电池的正极和负极可能是两种不同的金属,也可能是导电的非金属(如石墨棒)和金属,错误;B项,原电池是将化学能转变为电能的装置,正确;C项,在原电池中,负极上失去电子发生氧化反应,正极上得到电子发生还原反应,电子从负极沿导线流向正极,错误;D项,原电池放电时,电子从负极沿导线流向正极,电流的方向是从正极到负极,错误。]
2.可以将反应Zn+Br2===ZnBr2设计成原电池,下列4个电极反应:
①Br2+2e-===2Br- ②2Br--2e-===Br2
③Zn-2e-===Zn2+ ④Zn2++2e-===Zn
其中分别表示放电时负极和正极反应的是( )
A.②和③ B.②和①
C.③和① D.④和①
C [放电时负极为Zn,失电子被氧化,正极为Br2,得电子被还原。 ]
3.如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
A.外电路的电流方向为X→外电路→Y
B.若两电极分别为Zn和碳棒,则X为碳棒,Y为Zn
C.若两电极都是金属,则它们的活动性为X>Y
D.X极上发生的是还原反应,Y极上发生的是氧化反应
C [由图可知,电子的流动方向是X→外电路→Y,则电流的方向就为Y→外电路→X;X为原电池的负极,Y为正极,X的活动性比Y的强;X极应发生氧化反应,Y极应发生还原反应。所以,A、B、D错误,C正确。]
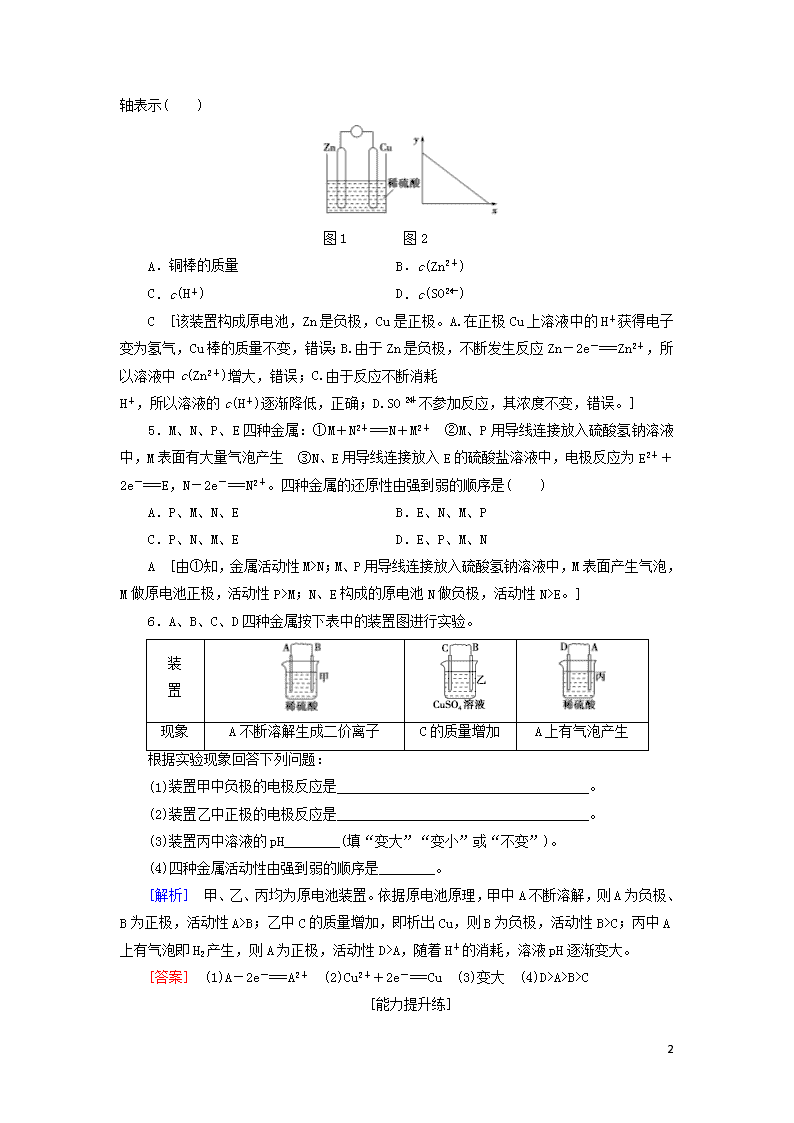
4.图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y
4
轴表示( )
图1 图2
A.铜棒的质量 B.c(Zn2+)
C.c(H+) D.c(SO)
C [该装置构成原电池,Zn是负极,Cu是正极。A.在正极Cu上溶液中的H+获得电子变为氢气,Cu棒的质量不变,错误;B.由于Zn是负极,不断发生反应Zn-2e-===Zn2+,所以溶液中c(Zn2+)增大,错误;C.由于反应不断消耗
H+,所以溶液的c(H+)逐渐降低,正确;D.SO不参加反应,其浓度不变,错误。]
5.M、N、P、E四种金属:①M+N2+===N+M2+ ②M、P用导线连接放入硫酸氢钠溶液中,M表面有大量气泡产生 ③N、E用导线连接放入E的硫酸盐溶液中,电极反应为E2++2e-===E,N-2e-===N2+。四种金属的还原性由强到弱的顺序是( )
A.P、M、N、E B.E、N、M、P
C.P、N、M、E D.E、P、M、N
A [由①知,金属活动性M>N;M、P用导线连接放入硫酸氢钠溶液中,M表面产生气泡,M做原电池正极,活动性P>M;N、E构成的原电池N做负极,活动性N>E。]
6.A、B、C、D四种金属按下表中的装置图进行实验。
装
置
现象
A不断溶解生成二价离子
C的质量增加
A上有气泡产生
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应是____________________________________。
(2)装置乙中正极的电极反应是____________________________________。
(3)装置丙中溶液的pH________(填“变大”“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是________。
[解析] 甲、乙、丙均为原电池装置。依据原电池原理,甲中A不断溶解,则A为负极、B为正极,活动性A>B;乙中C的质量增加,即析出Cu,则B为负极,活动性B>C;丙中A上有气泡即H2产生,则A为正极,活动性D>A,随着H+的消耗,溶液pH逐渐变大。
[答案] (1)A-2e-===A2+ (2)Cu2++2e-===Cu (3)变大 (4)D>A>B>C
[能力提升练]
4
7.将等质量的两份锌粒a、b分别加入过量的稀硫酸中,同时向a中加少许胆矾晶体,下列各图表示产生氢气的体积V(L)与时间t(min)的关系正确的是
( )
A [向a中加入少许胆矾晶体,则有Zn+Cu2+===Cu+Zn2+,消耗一部分Zn,所以产生H2的量较少,但生成的Cu附于Zn上又组成铜锌原电池,加快反应速率,因此曲线a的斜率大于曲线b的斜率。]
8.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是( )
A.由Al、Cu、稀硫酸组成原电池,其负极反应式为Al-3e-===Al3+
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为Al-3e-+4OH-===AlO+2H2O
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为Cu-2e-===Cu2+
D.由Al、Cu、浓硝酸组成原电池,其负极反应式为Cu-2e-===Cu2+
C [Fe、Cu、FeCl3溶液组成的原电池的负极反应为Fe-2e-===Fe2+。]
9.原电池是化学对人类的一项重大贡献。
(1)某兴趣小组为研究原电池原理,设计如图所示装置。
①a和b不连接时,烧杯中发生反应的离子方程式是___________________。
②a和b用导线连接,Cu极为原电池________极(填“正”或“负”),Zn极发生________(填“氧化”或“还原”)反应。
③a和b用导线连接,Zn片上发生的电极反应:_________________________
____________,Cu片上发生的电极反应:______________________。
(2)若a和b相连接,导线上转移0.2 mol电子时,理论上Zn片质量减轻________g。
[解析] (1)①a和b不连接时,该装置不构成原电池,锌和氢离子发生置换反应,离子方程式为Zn+2H+===Zn2++H2↑;②a和b用导线连接,该装置构成原电池,铜作正极,正极上发生还原反应;锌作负极发生氧化反应;③a和b用导线连接,该装置构成原电池,铜作正极,发生还原反应,电极反应式为
2H++2e-===H2↑;锌作负极发生氧化反应,电极反应式为Zn-2e-===Zn2+。(
4
2)锌片减少的质量=×65 g·mol-1=6.5 g。
[答案] (1)①Zn+2H+===Zn2++H2↑ ②正 氧化
③Zn-2e-===Zn2+ 2H++2e-===H2↑
(2)6.5
10.有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性。试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出电极反应式。
正极反应式:________________________________________________;
负极反应式:_______________________________________________。
[答案]
2H++2e-===H2↑ Fe-2e-===Fe2+
4
相关文档
- 2020版高中化学课时分层作业14酸碱2021-08-245页
- 2020-2021学年化学苏教版选修4课时2021-08-244页
- 2020-2021学年新教材化学人教版必2021-08-247页
- 新教材化学人教版必修第二册课时分2021-08-248页
- 2020-2021学年化学苏教版选修4课时2021-08-238页
- 2020版高中化学课时分层作业12水的2021-08-234页
- 2020-2021学年化学苏教版选修4课时2021-08-238页
- 2020-2021学年化学苏教版选修4课时2021-08-239页
- 2020-2021学年化学苏教版选修4课时2021-08-068页
- 2020-2021学年化学苏教版选修4课时2021-07-097页