- 360.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第四章 第三节 第1课时
一、选择题
1.下列叙述正确的是( )
①电解池是将化学能转变成电能的装置
②原电池是将电能转变成化学能的装置
③金属和石墨导电均为物理变化,电解质溶液导电是化学变化
④电解池两个电极材料可以相同
A.①②③④ B.③④
C.②③④ D.③
解析:电解质溶液导电发生了氧化还原反应,是化学变化;金属导电仅是电子的定向移动,是物理变化。电解池的两极只要能导电即可。
答案:B
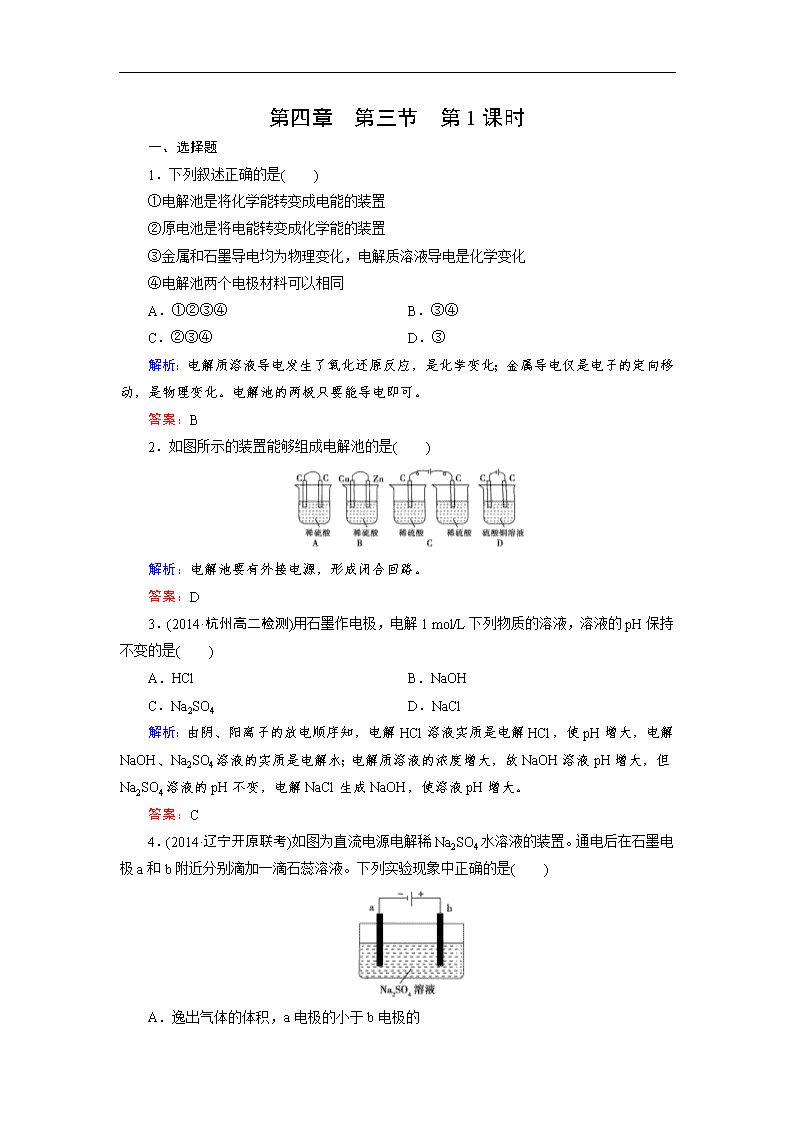
2.如图所示的装置能够组成电解池的是( )
解析:电解池要有外接电源,形成闭合回路。
答案:D
3.(2014·杭州高二检测)用石墨作电极,电解1 mol/L下列物质的溶液,溶液的pH保持不变的是( )
A.HCl B.NaOH
C.Na2SO4 D.NaCl
解析:由阴、阳离子的放电顺序知,电解HCl溶液实质是电解HCl,使pH增大,电解NaOH、Na2SO4溶液的实质是电解水;电解质溶液的浓度增大,故NaOH溶液pH增大,但Na2SO4溶液的pH不变,电解NaCl生成NaOH,使溶液pH增大。
答案:C
4.(2014·辽宁开原联考)如图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊溶液。下列实验现象中正确的是( )
A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
解析:a、b电极分别为电解池的阴极和阳极,其电极反应分别是4H++4e-===2H2↑和4OH--4e-===O2↑+2H2O;即a极气体体积比b极大。a极和b极溶液分别显碱性和酸性,故可以看到a电极附近呈蓝色,b电极附近呈红色。
答案:D
5.(2014·运城高二检测)如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈蓝色。下列说法中不正确的是( )
A.x是正极,y是负极
B.a极产生氢气,b极生成I2
C.a极和Pt电极都有气泡产生
D.U形管中溶液的碱性增强
解析:淀粉遇碘变蓝→b极生I2,即确定b极发生反应2I--2e-===I2,则b极是阳极,x是负极,y是正极,a极H+放电,发生反应2H++2e-===H2↑,产生氢气,U形管中总反应式为2KI+2H2O2KOH+H2↑+I2,溶液的碱性增强,故A错误,B、D正确;石墨为阴极,铂为阳极,电极反应分别是Cu2++2e-===Cu,4OH--4e-===2H2O+O2↑,C正确。
答案:A
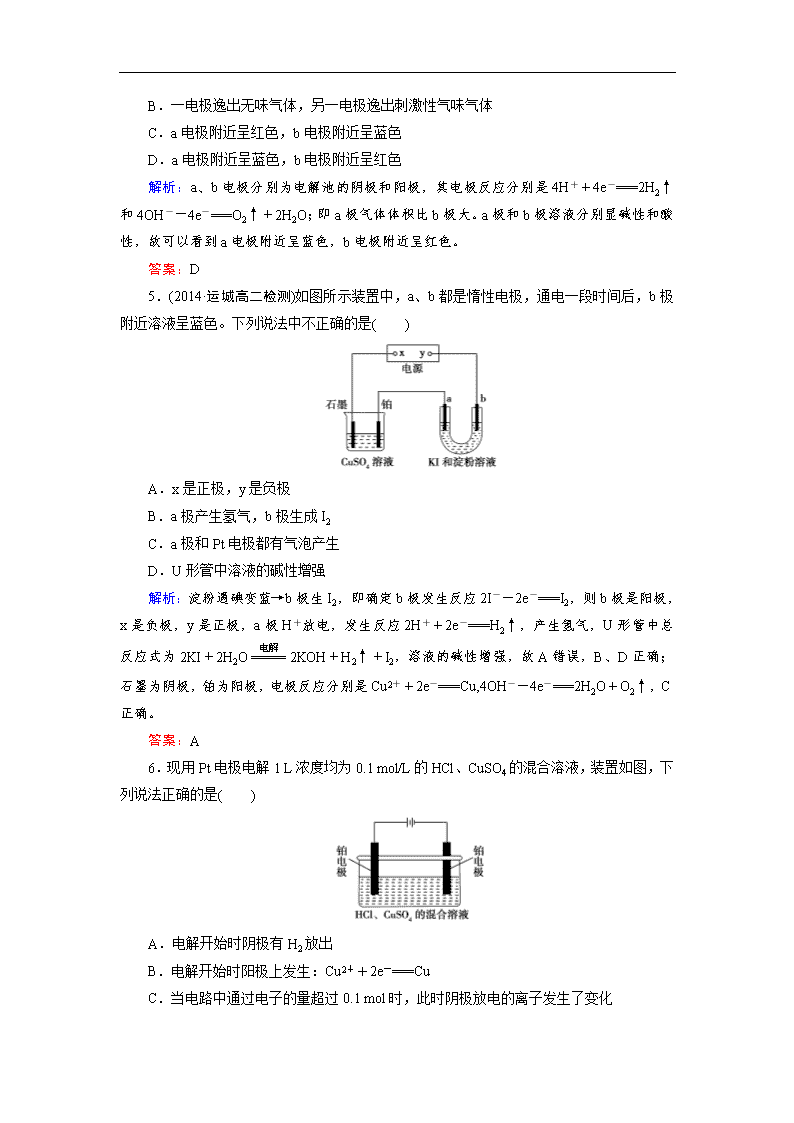
6.现用Pt电极电解1 L浓度均为0.1 mol/L的HCl、CuSO4的混合溶液,装置如图,下列说法正确的是( )
A.电解开始时阴极有H2放出
B.电解开始时阳极上发生:Cu2++2e-===Cu
C.当电路中通过电子的量超过0.1 mol时,此时阴极放电的离子发生了变化
D.整个电解过程中,SO不参与电极反应
解析:依据放电顺序阴极先放电的是Cu2+,故阴极开始析出的是Cu,阳极先放电的是Cl-,故阳极开始产生的是Cl2,答案A、B错;由阴极反应Cu2++2e-===Cu,n(Cu2+)=0.1 mol,当电路中通过电子的量达到0.2 mol时,此时Cu2+消耗完毕,阴极放电离子变为H+。所以C错;阳极先是Cl-放电,当Cl-消耗完毕。此时H2O电离产生的OH-开始在阳极放电,SO不参与电极反应。
答案:D
7.某小组为研究电化学原理,设计下图装置,下列叙述不正确的是( )
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-===Cu
C.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
解析:a和b不连接时,铁片与Cu2+直接发生置换反应,有金属铜析出,A项正确。a和b用导线连接时.该装置形成原电池,铜片作正极,铁片作负极失去电子形成Fe2+,因此无论a和b是否连接。铁片均会溶解,溶液均从蓝色逐渐变成浅绿色,所以B、C项正确。若a和b分别连接直流电源正、负极,a作阳极,铜片失去电子生成Cu2+,Cu2+向铁电极移动。
答案:D
8.(2014·郑州市质检一)如图X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色色斑向d端扩散。下列判断正确的是( )
A.滤纸上c点附近会变红色
B.Cu电极质量减小,Pt电极质量增大
C.烧杯中溶液的pH增大
D.烧杯中SO向Cu电极定向移动
解析:本题考查电解原理,意在考查考生对电化学基础知识融会贯通及正确复述、再现、辨认的能力。由图可知,该装置为电解装置,由通电后Y中央的紫红色色斑向d端扩散知,d为阳极(MnO向阳极移动),b为电源的正极,a为电源的负极。Y为浸透饱和食盐水和酚酞试液的滤纸,c点H+放电,则OH-浓度增大,所以滤纸上c点附近会变红色,故A项正确;Cu电极上Cu2+得到电子生成Cu,Pt电极上OH-失去电子,故Cu电极质量增大,Pt电极质量不变,B项错误;Pt电极上OH-失去电子,故烧杯中溶液的pH减小,C项错误;Cu电极为阴极,Pt电极为阳极,烧杯中SO向Pt电极定向移动,D项错误。
答案:A
9.(2014·山东莱芜期末)CuI是一种不溶于水的白色固体,它可由反应:2Cu2++4I-===2CuI↓+I2而得到。现以石墨为阴极,以Cu为阳极电解KI溶液,通电前向电解液中加入少量酚酞试液和淀粉溶液。电解开始不久阴极区溶液呈红色,而阳极区溶液呈蓝色,对这个现象的正确解释是( )
①阴极:2H++2e-===H2↑使c(OH-)>c(H+) ②阳极:2Cu+4I--4e-===2CuI↓+I2,I2遇淀粉变蓝 ③阳极:Cu-2e-===Cu2+,Cu2+显蓝色 ④阳极:2I--2e-===I2,I2遇淀粉变蓝
A.①② B.①③
C.①④ D.③④
解析:通电后,溶液中的H+、K+移向阴极,而H+的氧化性强于K+,所以H+得电子被还原,破坏了水的电离平衡,使c(OH-)>c(H+),酚酞试液变红;I-和OH-移向阳极,而失电子能力Cu>I->OH-,故Cu失电子产生Cu2+。又据信息,Cu2+与I-能反应产生I2,I2遇淀粉变蓝。
答案:A
10.用Pt电极电解各含有0.1 mol的Cu2+和X3+的溶液,阴极析出固体物质的质量m(g)与溶液中通过电子的物质的量n(mol)的关系见右图所示。则离子的氧化能力由大到小排列正确的是( )
A.Cu2+>X3+>H+ B.H+>X3+>Cu2+
C.X3+>H+>Cu2+ D.Cu2+>H+>X3+
解析:有些学生没认真分析,就将X3+与Fe3+联系起来,选择C答案。这其实是简单记忆阳离子放电顺序导致思维定势造成的结果。本题的解题信息在图像中:一通电就有固体析出,且通过0.2 mol电子后,再没有固体析出了,说明是Cu2+放电的结果。X3+不放电,故答案应为D。
答案:D
二、非选择题
11.(2014·陕西长安一中高二期末)从NO、SO、H+、Cu2+、Ba2+、Ag+、Cl-等离子中选出适当的离子组成电解质,采用惰性电极对其溶液进行电解。
(1)两极分别放出H2和O2时,电解质的化学式可能是________。
(2)若阴极析出金属,阳极放出O2,电解质的化学式可能是________。
(3)两极分别放出气体,且体积比为1∶1,电解质的化学式可能是________。
解析:(1)组为电解水型,即阳极OH-放电,阴极H+放电;
(2)组阳极OH-放电,阴极排在H后的金属阳离子放电;
(3)组气体体积比为1∶1,不是电解水型,经分析可得相应答案。
答案:(1)H2SO4、HNO3、Ba(NO3)2
(2)AgNO3、Cu(NO3)2、CuSO4
(3)HCl、BaCl2
12.(2014·南昌高二月考)如图X是直流电源。Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒。接通电路后,发现d附近显红色。
(1)①电源上b为________极(用“正”、“负”、“阴”或“阳”填空)。
②Z槽中e为极________(用“正”、“负”、“阴”或“阳”填空)。
③连接Y、Z槽线路中,电子流动的方向是d________e(用“―→”或“”填空)。
(2)①写出c极上反应的电极反应式:
________________________________________________________________________。
②写出Y槽中总反应的化学方程式:
________________________________________________________________________。
③写出Z槽中e极上反应的电极反应式:
________________________________________________________________________。
解析:d极附近显红色,说明d为阴极,电极反应式为2H++2e-===H2↑,c为阳极,电极反应式为2Cl--2e-===Cl2↑,Y槽电解NaCl溶液的总反应方程式为2NaCl+2H2O2NaOH+Cl2↑+H2↑;直流电源中a为正极,b为负极,Z槽中f为阴极,e为阳极,电极反应式为Cu-2e-===Cu2+,电子流动方向由e→d。
答案:(1)①负 ②阳 ③←
(2)①2Cl--2e-===Cl2↑
②2NaCl+2H2O2NaOH+H2↑+Cl2↑
③Cu-2e-===Cu2+
13.如下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加,据此回答问题:
①电源的N端为________极;
②电极b上发生的电极反应为:________;
③列式计算电极b上生成的气体在标准状态下的体积:________;
④电极c的质量变化是________g;
⑤电解前后各溶液的酸、碱性大小是否发生变化?简述其原因:
甲溶液____________________________________________________________________;
乙溶液____________________________________________________________________;
丙溶液____________________________________________________________________。
(2)如果电解过程中铜全部析出,此时电解能否继续进行?为什么?
解析:(1)①乙中c电极质量增加,则c处发生的反应为Cu2++2e-===Cu,即c为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极。丙中为K2SO4溶液,相当于电解水,设电解的水的质量为x,由电解前后溶质质量相等有:
100 g×10.00%=(100 g-x)×10.47%,得x≈4.5 g,故为0.25 mol,整个反应中转移0.5 mol电子,而整个电路是串联的,故每个烧杯中的电极上转移电子数是相等的。②甲中相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-===2H2O+O2↑。③转移0.5 mol电子。则生成O2的物质的量为0.5 mol÷4=0.125 mol,标准状况下的体积为0.125 mol×22.4 L·mol-1=2.8 L。④Cu2++2e-===Cu,转移0.5 mol电子,则生成m(Cu)=×64 g·mol-1=16 g。⑤甲中相当于电解水,故NaOH的浓度增大,pH变大;乙中阴极为Cu2+放电,阳极为OH-放电,所以H+增多,故pH减小;丙中为电解水,对于K2SO4而言,其pH几乎不变。(2)铜全部析出后,可以继续电解水。
答案:(1)①正 ②4OH-4e-===2H2O+O2↑ ③水减少的质量为:100 g×(1-
)≈4.5 g,生成O2 的体积为:××22.4 L·mol-1=2.8 L ④16 ⑤碱性增大,因为电解后,水量减少,溶液中NaOH浓度增大 酸性增大,因为阳极上OH-生成O2,溶液中H+浓度增加 酸碱性大小没有变化,因为K2SO4是强酸强碱盐,浓度增加不影响溶液的酸碱性
(2)能继续进行,因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应。
14.某温度下,取一定质量的硫酸铜溶液,用石墨作电极进行电解,当阳极产生标准状况下气体1.12 L时,CuSO4恰好被完全电解,得到密度为1.2 g·cm-3的溶液200 mL。求:
(1)阴极的电极反应式为_____________________________________________________。
总反应的离子方程式为______________________________________________________。
(2)电解后所得溶液的pH为__________________________________________________。
(3)电解前所取CuSO4溶液的质量为________g。
(4)若要使电解后所得溶液恢复至电解前的原状态,需要加入何种物质(只要求写出一种),其化学式为________,加入物质的质量为________g。
解析:(2)由n(O2)=0.05 mol可知通过的电子n(e-)=0.2 mol,产生的n(H+)=0.2 mol,原CuSO4的物质的量为n(CuSO4)=0.1 mol,电解消耗的H2O为0.1
mol即1.8 g。c(H+)==1 mol·L-1,pH=0。(3)电解后的溶液质量为240 g,其中H2SO4的质量是9.8 g,水的质量是230.2 g,所以原CuSO4溶液的质量是:16 g(CuSO4)+1.8 g(消耗的H2O)+230.2 g(剩余的H2O)=248 g。(4)电解产物是0.1 mol Cu和0.05 mol O2,加入0.1 mol CuO或0.1 mol CuCO3均可使溶液恢复到原状态。
答案:(1)Cu2++2e-Cu 2Cu2++2H2O电解,2Cu+O2↑+4H+ (2)0 (3)248 (4)CuO 8(或CuCO3 12.4)
相关文档
- 人教版高中化学选修4练习:第二章第2021-08-247页
- 人教版高中化学选修4练习:第一章第2021-08-2410页
- 人教版高中化学选修4练习:第三章第2021-08-249页
- 人教版高中化学选修4练习:第二章第2021-08-2412页
- 人教版高中化学选修4练习:第一章第2021-08-248页
- 人教版高中化学选修4练习:期中检测2021-08-2414页
- 人教版高中化学选修4练习:专题讲座(2021-08-234页
- 人教版高中化学选修4练习:专题讲座(2021-08-235页
- 人教版高中化学选修4练习:第三章检2021-08-2312页
- 人教版高中化学选修4练习:第三章第2021-08-238页