- 316.40 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2019学年度高三级第三次模拟试题(卷)
化 学
相对分子质量:H:1 C:12 O:16 Na:23 S:32 K:39
一、选择题(每小题只有一个选项符合题意,每小题2分,共44分)
1.化学与科学、技术、社会、环境密切相关。下列有关说法中不正确的是 ( )
A.甲醛的水溶液虽具有杀菌、防腐的作用,不能用于食品保鲜、杀菌;
B.高温能杀死流感病毒是因为构成病毒的蛋白质受热变性;
C.制造光纤的主要材料是二氧化硅,制造太阳能电池板主要材料是硅;
D.煤经过气化和液化两个物理变化,既可变为清洁能源;
2.下列说法正确的是( )
A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B.酒精、碳酸钙和水分别属于电解质、强电解质和弱电解质
C.强电解质溶液的导电能力一定强于弱电解质溶液的导电能力
D.碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物
3.工业中常用FeCl3溶液腐蚀印刷电路板,欲从腐蚀后的废液中回收Cu及制取纯净的
FeCl3溶液,需要下列试剂:①蒸馏水、②铁粉、③浓H2SO4、④浓盐酸、⑤烧碱、⑥浓氨水、⑦Cl2中的( )
A.①②④⑦ B.①③④⑥ C.②④⑥⑦ D.①④⑥⑦
4.一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g)2CO2(g)+S(l) ΔH<0
若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应的平衡常数不变
5.下列叙述错误的是 ( )
A.生铁中含有碳,抗腐蚀能力比纯铁弱
B.用锡焊接的铁质器件,焊接处易生锈
C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液
D.铁管上镶嵌锌块,铁管不易被腐蚀
9
6.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.常温常压下,17 g 甲基(-14CH3)所含的中子数为 9NA
B.T oC 时,pH=1 的盐酸中含有的 H+数为 NA
C.1 mol SO2溶于足量水,溶液中 H2SO3-、HSO3-与 SO32-粒子的物质的量之和为 NA
D.1 mol CnH2n(n≥2)含有的共用电子对数目为3nNA
7.下列各组离子在指定环境中能大量共存的是( )
A.在c(CO32-)=0.1 mol·L-1的溶液中: K+、AlO2-、Cl-、NO3-
B.在常温下由水电离出的c(OH-)=1×10-12 mol·L-1的溶液中:Fe2+、ClO-、Na+、SO4 2-
C.在加入苯酚会显紫色的溶液中:NH4+、Cl-、Na+、SCN-
D.在能使蓝色石蕊试纸变红的溶液中:S2O32-、CO32-、Na+、K+
8.Na3N和NaH都是离子化合物,与水反应都有气体生成,下列说法中正确的是( )
A.两种物质的阴离子半径都比阳离子半径小
B.与水反应时,水都做氧化剂
C.与盐酸反应都只生成一种盐
D.溶于水,所得溶液都能使无色酚酞变红
9.一定条件下,在固定容积密闭容器中发生可逆反应:4NH3(g)+5O2(g)4NO(g)+6H2O(g),下列叙述中正确的是
A.达到化学平衡时,化学反应速率的关系是2v逆 (NH3)=3v正 (H2O)
B.达到化学平衡时,NH3、O2、NO、H2O物质的量之比为4∶5∶4∶6
C.混合气体的密度一定时,该化学反应达到化学平衡
D.若单位时间内生成x mol NO的同时,生成x mol NH3,则反应达到平衡状态
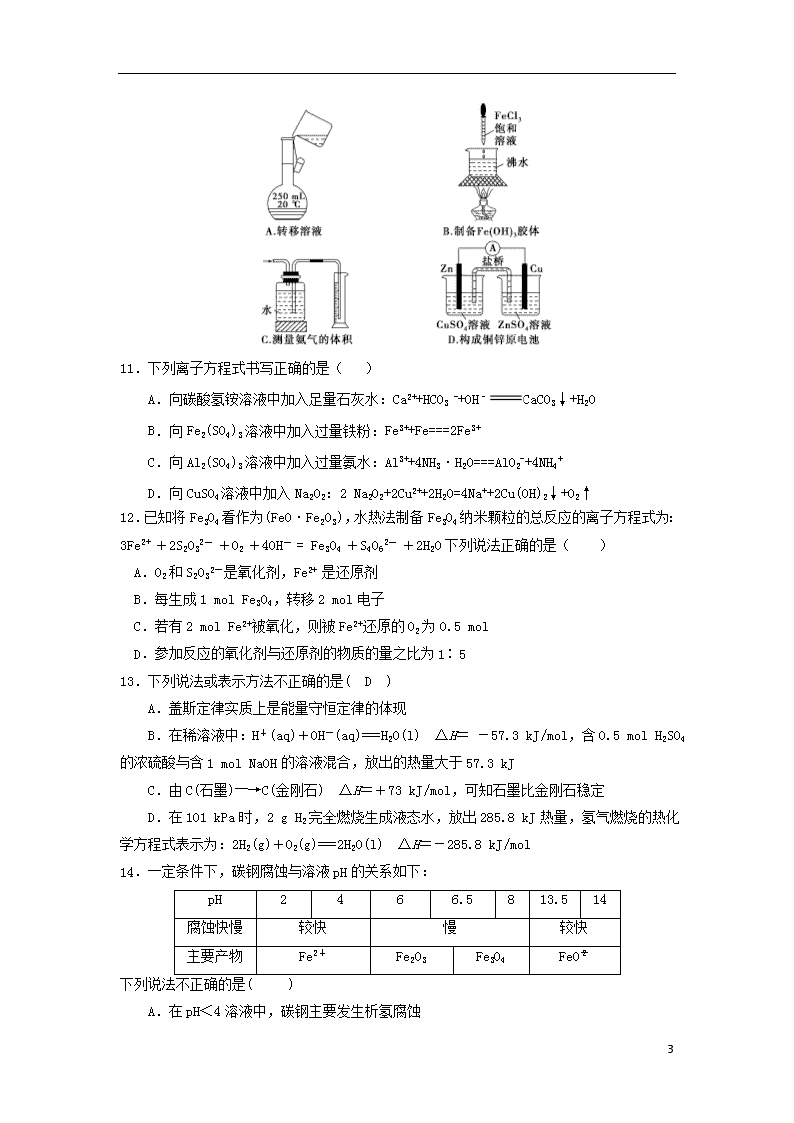
10.下列装置或操作正确且能达到实验目的的是( )
9
11.下列离子方程式书写正确的是( )
A.向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3 -+OH–CaCO3↓+H2O
B.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe===2Fe3+
C.向Al2(SO4)3溶液中加入过量氨水:Al3++4NH3·H2O===AlO2-+4NH4+
D.向CuSO4溶液中加入Na2O2:2 Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑
12.已知将Fe3O4看作为(FeO·Fe2O3),水热法制备Fe3O4纳米颗粒的总反应的离子方程式为:
3Fe2+ +2S2O32- +O2 +4OH- = Fe3O4 +S4O62- +2H2O下列说法正确的是( )
A.O2和S2O32-是氧化剂,Fe2+ 是还原剂
B.每生成1 mol Fe3O4,转移2 mol电子
C.若有2 mol Fe2+被氧化,则被Fe2+还原的O2为0.5 mol
D.参加反应的氧化剂与还原剂的物质的量之比为1∶5
13.下列说法或表示方法不正确的是( D )
A.盖斯定律实质上是能量守恒定律的体现
B.在稀溶液中:H+(aq)+OH-(aq)===H2O(l) ΔH= -57.3 kJ/mol,含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
C.由C(石墨)―→C(金刚石) ΔH=+73 kJ/mol,可知石墨比金刚石稳定
D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ/mol
14.一定条件下,碳钢腐蚀与溶液pH的关系如下:
pH
2
4
6
6.5
8
13.5
14
腐蚀快慢
较快
慢
较快
主要产物
Fe2+
Fe2O3
Fe3O4
FeO
下列说法不正确的是( )
A.在pH<4溶液中,碳钢主要发生析氢腐蚀
9
B.在pH>6溶液中,碳钢主要发生吸氧腐蚀
C.在pH>7溶液中,碳钢腐蚀的正极反应为O2+4H++4e—===2H2O
D.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓
15.用铁片(电极a)、铜片(电极b)和CuSO4溶液可以构成原电池或电解池,如右图所示。则下列说法正确的是( )
A.构成原电池时b极反应为: Cu﹣2e-=Cu2+
B.构成的原电池或电解池工作后就可能产生大量气体
C.构成电解池时b 极质量既可能减少也可能增加
D.构成电解池时a极质量一定会减少
选项
①
②
③
实验结论
A
浓硫酸
Cu
品红溶液
SO2具有漂白性
B
浓盐酸
高锰酸钾
NaBr溶液
氧化性:KMnO4>Cl2>Br2
C
稀盐酸
Na2SO3
Ba(NO3)2溶液
SO2与可溶性钡盐均可以生成白色沉淀
D
浓硝酸
Na2CO3
Na2SiO3溶液
酸性:硝酸>碳酸>硅酸
16.用如图所示装置进行下列实验,能得出相应实验结论的是( )
17.变黑的银器可根据电化学原理进行翻新,其方法如下:在铝制容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后黑色会褪去,该反应的方程式为:2Al+3Ag2S+6H2O===6Ag+3H2S↑+2Al(OH)3,下列有关说法正确的是( )
A.正极反应式:Al-3e-+3H2O===Al(OH)3+3H+
B.每转移0.2 mol电子,理论上生成0.1 mol H2S气体
C.放电过程中,Cl-向正极移动
D.处理过程中银器一直保持恒重
18. 已知:C(s)+O2(g)===CO2(g) ΔH1 CO2(g)+C(s)===2CO(g) ΔH2
2CO(g)+O2(g)===2CO2(g) ΔH3 4Fe(s)+3O2(g)===2Fe2O3(s) ΔH4
3CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是( )
A.ΔH1>0,ΔH3<0 B.ΔH2>0,ΔH4>0
C.ΔH1=ΔH2+ΔH3 D.ΔH3=ΔH4+ΔH5
19.制备下列物质的工业生产流程合理的是( )
A.由SO2制亚硫酸钠:SO2NaHSO3溶液Na2SO3溶液
B.由NaCl制漂粉精:NaCl(aq)Cl2漂粉精
C.由NH3制硝酸:NH3NO2HNO3
9
D.由乙烯制乙酸:H2C===CH2CH3CH2OHCH3CHOCH3COOH
20.短周期非金属元素 W、X、Y、Z的原子序数依次增大, X、Y原子核外 L层的电子数 之比为 3∶4,且原子半径:Y>X,X、Y、Z的最外层电子数之和为 16,W-能与水反应生成 W2。下列说法正确的是( )
A. 原子半径:YX D.气态氢化物的稳定性:X”或“<”)。
(3)温度T1和T2时,分别将0.50 mol CH4和1.2mol NO2充入1 L的密闭容器中发生反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g) △H=bkJ/mol。
测得有关数据如下表:
温度
时间/min
物质的量
0
10
20
40
50
T1
n(CH4)/mol
0.50
0.35
0.25
0.10
0.10
T2
n(CH4)/mol
0.50
0.30
0.18
x
0.15
下列说法正确的是__________________。
A.T1>T2,且b>0
B.当温度为T2、反应进行到40 min时, x>0.15
C.温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,重新达到平衡时,n(N2)<0.70mol
25.(14分)某工厂对工业污泥中的Cr元素回收与再利用的工艺如下(己知硫酸浸取液中的金属离子主要是Cr3+,其次是少量的Fe2+、Fe3+、Al3+、Ca2+、Mg2+):
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
阳离子
Fe3+
Fe2+
Mg2+
Al3+
Cr3+
开始沉淀时 的pH
1.9
7.0
—
一
—
9
沉淀完全时 的pH
3.2
9.0
11.1
8
9 (>9溶解)
(1)实验室用98% (密度为1.84 g/cm3)的浓硫酸配制240mL 4.8 mol·L-1的硫酸溶液,配制时需要量取浓硫酸的体积为 ________mL (保留小数点后一位小数),所用的玻璃仪器除烧杯、玻璃棒、量筒、胶头滴管外,还需___________。
(2)在上述配制稀硫酸过程中,会导致所配溶液浓度偏小的操作是 _____(填序号)
a.定容时俯视刻度线 b.量取浓硫酸时,俯视刻度线
c.将量筒的洗涤液注入容量瓶中 d.转移溶液时,没有等溶液冷却至室温
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr (CrO42-或Cr2O72-),以便于与杂质离子分离;另一方面是________________________。(用离子方程式表示)
(4)调节溶液的pH=8时,除去的主要杂质离子是 ______________。
(5)钠离子交换树脂的原理为:Mn++nNaR=MRn +nNa+,被交换的杂质离子是_________________。
(6)通SO2气体时,将Na2Cr2O7还原为CrOH(H2O)5SO4的化学方程式为:_____________________。
26.(15分)硫化碱法是工业上制备Na2S2O3的方法之一,其反应原理为:2Na2S+Na2CO3+4SO2==3Na2S2O3+CO2(该反应△H>0),某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O的流程如下。
(1)吸硫装置如图所示。
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是 ,表明SO2吸收效率低的实验现象是B中溶液 。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 。(答一条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=10.2)。
9
序号
实验操作
预期现象
结论
①
取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,____________。
有白色沉淀生成
样品含NaCl
②
另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,___________。
有白色沉淀生成,上层清液pH>10.2
样品含NaOH
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:
第一步:准确称取a g KIO3(相对分子质量为214)固体配成溶液;
第二步:加入过量KI固体和H2SO4溶液,滴加指示剂;
第三步: 用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。
则c(Na2S2O3)=_________mol·L-1。
已知:IO3-+5I-+6H+= 3I2+3H2O , 2S2O32-+I2=S4O62-+2I-
(4)某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能 (填“不受影响”、“偏低”或“偏高”),原因是 。(用离子方程式表示)。
9
相关文档
- 高中化学第1章化学反应与能量转化2021-08-247页
- 2019-2020高中化学(人教版 选修4)练2021-08-247页
- 2020版新教材高中化学第3章简单的2021-08-247页
- 人教版高中化学选修2《化学与技术2021-08-2445页
- 高中化学《化学反应原理》4_2化学2021-08-245页
- 高中化学选修4课件_6化学反应速率2021-08-2429页
- 2019-2020学年高中化学专题1认识有2021-08-247页
- 2020高中化学第三章烃的含氧衍生物2021-08-246页
- 高中化学必修1第4章综合检测2021-08-246页
- 2019-2020学年高中化学课时作业222021-08-247页