- 513.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
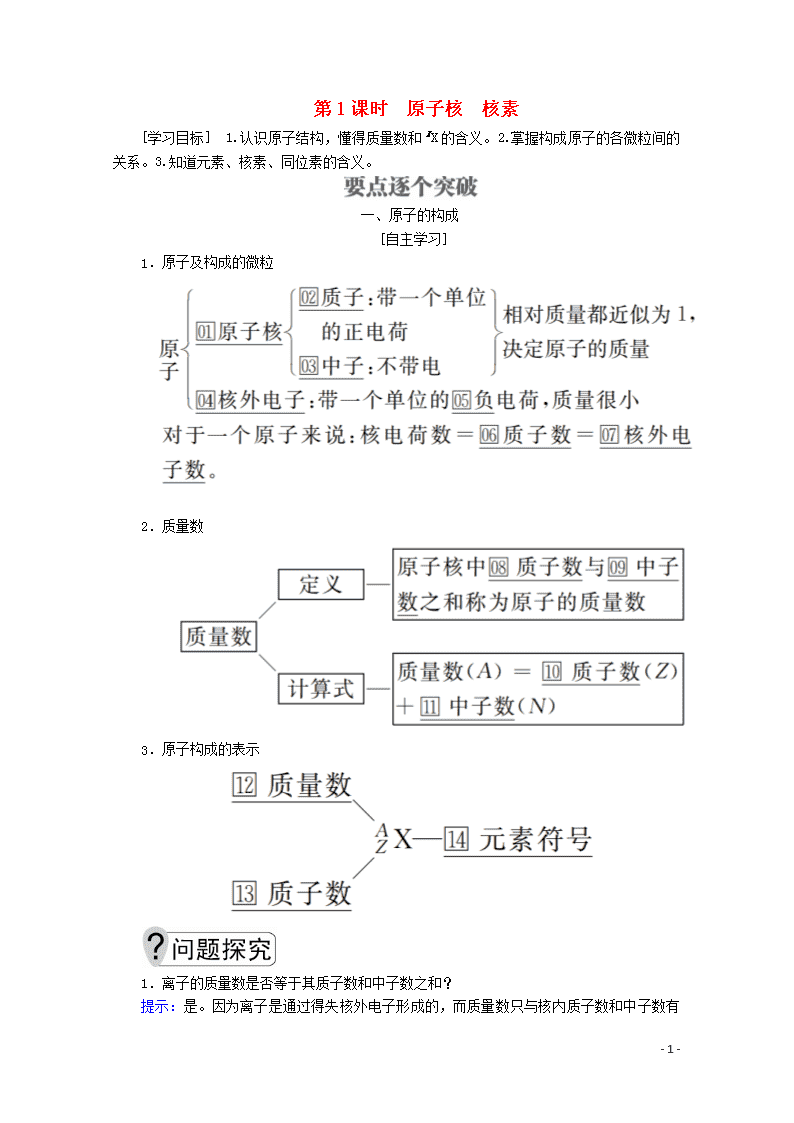
第1课时 原子核 核素
[学习目标] 1.认识原子结构,懂得质量数和X的含义。2.掌握构成原子的各微粒间的关系。3.知道元素、核素、同位素的含义。
一、原子的构成
[自主学习]
1.原子及构成的微粒
2.质量数
3.原子构成的表示
1.离子的质量数是否等于其质子数和中子数之和?
提示:
- 6 -
是。因为离子是通过得失核外电子形成的,而质量数只与核内质子数和中子数有关,与核外电子数无关。
2.任何原子都是由质子、中子和电子构成的吗?
提示:不一定。氢原子(H)中含有一个质子和一个电子,不含有中子。
[点拨提升]
1.原子的相对质量(M)=≈质量数=质子数+中子数。
2.原子、离子组成中的数量关系
(1)核电荷数=质子数=原子核外电子数。
(2)质量数(A)=质子数(Z)+中子数(N)。
(3)阳离子中:质子数=核电荷数=核外电子数+离子电荷数。
(4)阴离子中:质子数=核电荷数=核外电子数-离子电荷数。
[练习与活动]
1.下列关于微粒 Rn-的叙述不正确的是( )
A.所含质子数=A-n B.所含中子数=A-Z
C.所含电子数=Z+n D.所带电荷数=n
答案 A
解析 Rn-的质子数=Z,中子数=A-Z,电子数=Z+n,电荷数=n,A不正确。
2.已知R2+核内共有N个中子,R原子的质量数为A,则m g R2+中所含有的电子的物质的量为( )
A. mol B. mol
C. mol D. mol
答案 B
解析 R原子与R2+的质量数都等于A,其相对原子质量近似等于A,R2+的质子数为A-N,R2+的核外电子数为A-N-2,1 mol R2+含电子的物质的量为(A-N-2) mol, m g R2+的物质的量为 mol,所以m g R2+中含有的电子的物质的量为 mol。
规律方法
(1)原子中不一定含有中子,且中子数不一定等于质子数,如H。
(2)任何微粒中,质量数=质子数+中子数,但质子数与核外电子数不一定相等。
(3)质子数相同的微粒不一定属于同一元素,如Ne和H2O。
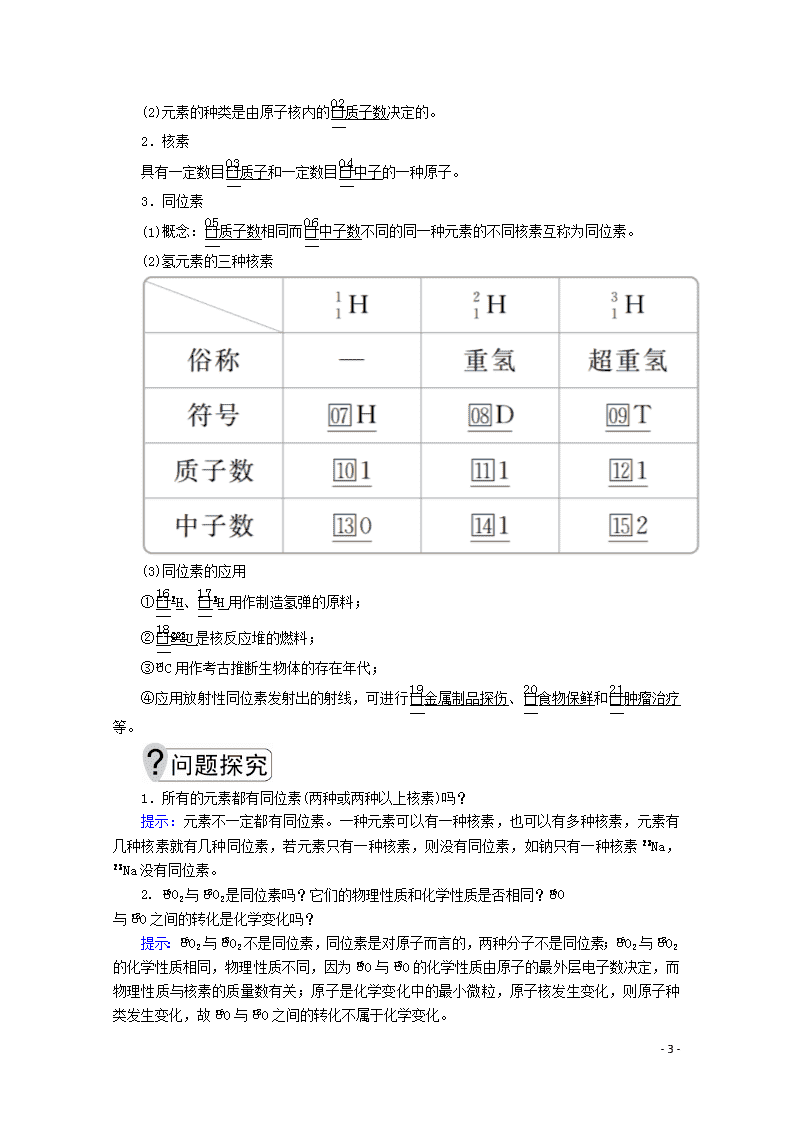
二、核素
[自主学习]
1.元素
(1)概念:具有相同质子数(核电荷数)的同一类原子的总称。
- 6 -
(2)元素的种类是由原子核内的质子数决定的。
2.核素
具有一定数目质子和一定数目中子的一种原子。
3.同位素
(1)概念:质子数相同而中子数不同的同一种元素的不同核素互称为同位素。
(2)氢元素的三种核素
(3)同位素的应用
①H、H用作制造氢弹的原料;
②U是核反应堆的燃料;
③C用作考古推断生物体的存在年代;
④应用放射性同位素发射出的射线,可进行金属制品探伤、食物保鲜和肿瘤治疗等。
1.所有的元素都有同位素(两种或两种以上核素)吗?
提示:元素不一定都有同位素。一种元素可以有一种核素,也可以有多种核素,元素有几种核素就有几种同位素,若元素只有一种核素,则没有同位素,如钠只有一种核素Na,Na没有同位素。
2. O2与O2是同位素吗?它们的物理性质和化学性质是否相同?O
与O之间的转化是化学变化吗?
提示:O2与O2不是同位素,同位素是对原子而言的,两种分子不是同位素;O2与O2的化学性质相同,物理性质不同,因为O与O的化学性质由原子的最外层电子数决定,而物理性质与核素的质量数有关;原子是化学变化中的最小微粒,原子核发生变化,则原子种类发生变化,故O与O之间的转化不属于化学变化。
- 6 -
[点拨提升]
1.元素、核素、同位素和同素异形体的区别与联系
(1)区别
(2)联系
①一种单质可由不同的核素构成,一种核素可以构成不同的单质。
②一种元素可以有若干种不同的核素,也可以只有一种核素,有多少种核素,就有多少种原子。
2.同位素之间的性质
(1)同一种元素的各种核素化学性质几乎相同,物理性质有一定的差异。
- 6 -
(2)天然存在的某元素的核素,不论是游离态还是化合态,各种核素所占的原子个数百分比一般是不变的。
[练习与活动]
A.2种 B.3种 C.4种 D.5种
答案 B
解析 质子数决定元素的种类,题给5种单核粒子质子数有18、19、20三种,故为3种元素。
4.“玉兔”号月球车用Pu作为热源材料,下列关于Pu的说法正确的是( )
A.Pu与U互为同位素
B.Pu与Pu互为同素异形体
C.Pu与U具有完全相同的化学性质
D.Pu与Pu具有相同的最外层电子数
答案 D
解析 Pu与U是两种不同的元素,不属于同位素,A项不正确;Pu与Pu的质子数相同,中子数不同,互为同位素,D项正确;同素异形体的研究对象是单质,Pu与Pu为同种元素的两种核素,是同位素,而
不是同素异形体,B项不正确;Pu与U属于两种元素的核素,化学性质不同,C项不正确。
规律方法
(1)元素、核素、同位素之间的关系可以用下图表示:
(2)判断元素、核素、同位素的方法(原子用X表示)
①只要Z相同就是同种元素;
②Z和A均相同为同种核素;
③Z相同A不相同则互为同位素。
- 6 -
本课归纳总结
- 6 -
相关文档
- 2020版高中化学 第1章 原子结构与2021-08-245页
- 2020高中化学第一章原子结构与元素2021-08-245页
- 2020高考化学冲刺600分练习4原子结2021-08-238页
- 2020高中化学第一章原子结构与元素2021-08-236页
- 2020高中化学第一章原子结构与元素2021-08-239页
- 2020高中化学第一章原子结构与元素2021-08-235页
- 2020版高中化学 第1章 原子结构与2021-08-236页
- 2020版高中化学 第1章 原子结构与2021-08-2319页
- 2020高中化学第一章原子结构与元素2021-08-066页
- 2020版高中化学 第1章 原子结构与2021-08-064页