- 358.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
近年来,高考化学实验命题的一个突出特点是“既来源于教材又高于教材”,很多高考题就是教材实验的改编,如2016全国卷Ⅰ理综26“氨气的制取”;2016全国卷Ⅲ理综26“过滤操作”就是教材实验装置的创新,这都启示我们:对教材内容要多问几个“为什么”,对教材中的实验装置不能盲目认为是唯一方案,要多想想“如何改进”,多想几次“还可怎么办”;要注重知识的“形成过程和生长方向”,用综合的观点建立知识网络,用探究的方式指导学习过程,尽量挖掘教材的潜在价值。
增分点1 套管实验
[知识查补]
套管实验是将一只较小的玻璃仪器装入另一玻璃仪器中,经组装来完成原来需要两套或多套普通玻璃仪器进行的实验。因其具有许多优点,近年来被广泛开发,并应用于化学实验中。套管实验具有操作简便、节约原料、现象连续,易于对比、减少污染的优点,宜在中学化学实验中大力推广,也是我们高考出题的一个热点。
[增分题例]
类型一 教材实验氨气的制取实验拓展
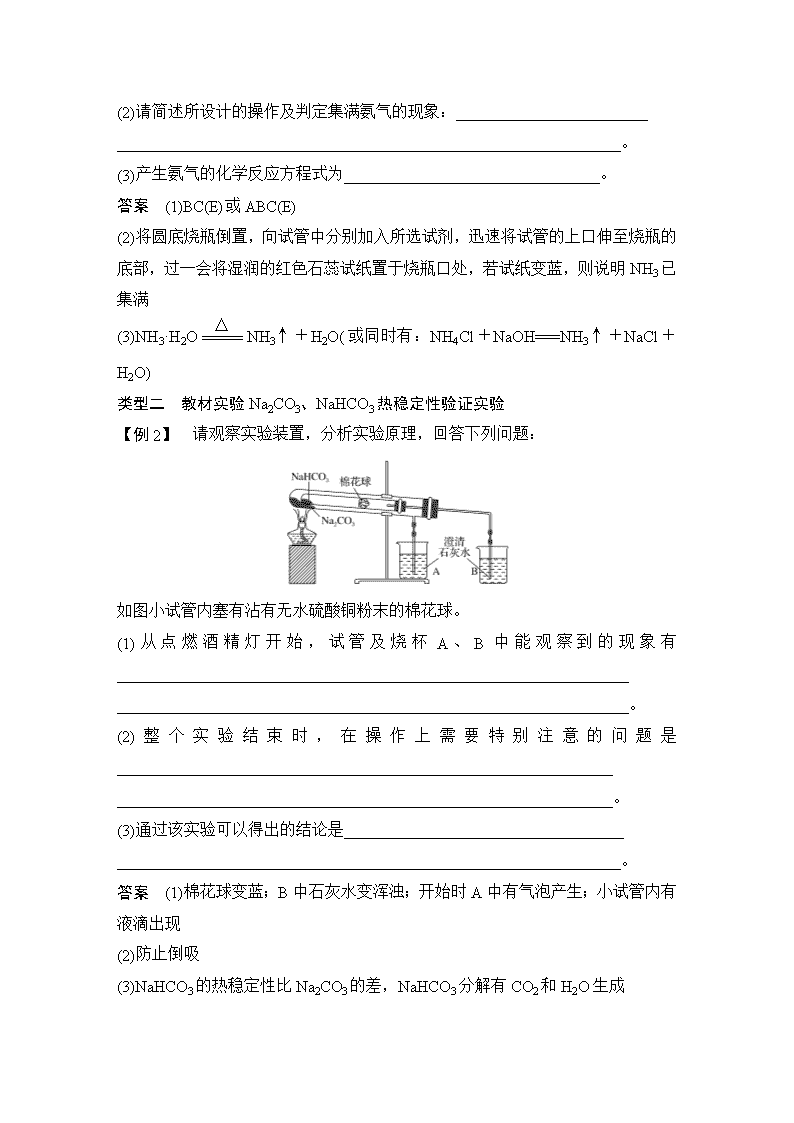
【例1】 在氨气的喷泉实验中,将圆底烧瓶集满氨气的操作很麻烦。请设计一个简单的操作方法,只用一支试管(如下图),选用下列药品:A.氯化铵固体,B.氢氧化钠固体,C.浓氨水,D.浓硫酸,E.湿润的红色石蕊试纸,采用“套管法”在圆底烧瓶中集满喷泉实验的氨气。
试回答下列问题:
(1)所用的试剂为_______________________________________________。
(2)请简述所设计的操作及判定集满氨气的现象:________________________
_______________________________________________________________。
(3)产生氨气的化学反应方程式为________________________________。
答案 (1)BC(E)或ABC(E)
(2)将圆底烧瓶倒置,向试管中分别加入所选试剂,迅速将试管的上口伸至烧瓶的底部,过一会将湿润的红色石蕊试纸置于烧瓶口处,若试纸变蓝,则说明NH3已集满
(3)NH3·H2ONH3↑+H2O(或同时有:NH4Cl+NaOH===NH3↑+NaCl+H2O)
类型二 教材实验Na2CO3、NaHCO3热稳定性验证实验
【例2】 请观察实验装置,分析实验原理,回答下列问题:
如图小试管内塞有沾有无水硫酸铜粉末的棉花球。
(1)从点燃酒精灯开始,试管及烧杯A、B中能观察到的现象有________________________________________________________________
________________________________________________________________。
(2)整个实验结束时,在操作上需要特别注意的问题是______________________________________________________________
______________________________________________________________。
(3)通过该实验可以得出的结论是___________________________________
_______________________________________________________________。
答案 (1)棉花球变蓝;B中石灰水变浑浊;开始时A中有气泡产生;小试管内有液滴出现
(2)防止倒吸
(3)NaHCO3的热稳定性比Na2CO3的差,NaHCO3分解有CO2和H2O生成
增分点2 教材启普发生器原理装置的拓展
[知识查补]
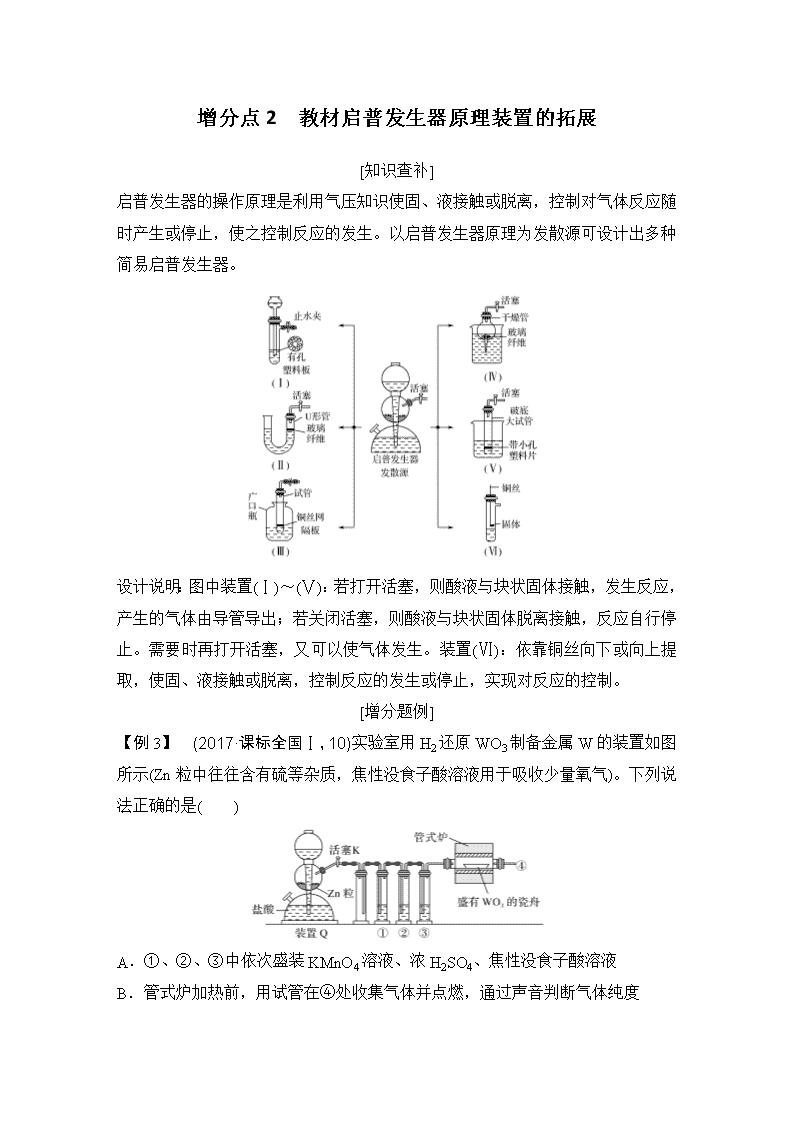
启普发生器的操作原理是利用气压知识使固、液接触或脱离,控制对气体反应随时产生或停止,使之控制反应的发生。以启普发生器原理为发散源可设计出多种简易启普发生器。
设计说明:图中装置(Ⅰ)~(Ⅴ):若打开活塞,则酸液与块状固体接触,发生反应,产生的气体由导管导出;若关闭活塞,则酸液与块状固体脱离接触,反应自行停止。需要时再打开活塞,又可以使气体发生。装置(Ⅵ):依靠铜丝向下或向上提取,使固、液接触或脱离,控制反应的发生或停止,实现对反应的控制。
[增分题例]
【例3】 (2017·课标全国Ⅰ,10)实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。下列说法正确的是( )
A.①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C.结束反应时,先关闭活塞K,再停止加热
D.装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
解析 A项,气体从溶液中逸出易带出水蒸气,所以浓硫酸应放在③中,错误;B项,先通H2以排除空气,加热前应先检验H2的纯度,正确;C项,若先停止通H2,在较高温度下空气有可能重新将W氧化,应先停止加热,再关闭活塞K,错误;D项,MnO2和盐酸反应需要加热,不能用启普发生器制备氯气,错误。
答案 B
【例4】 实验室制取H2、CO2、H2S等气体,往往都用启普发生器。它有开后即制气、关闭即停止的便利,其不足之处在于体积大,浪费药品,制作工艺水平高,价格较贵。某课外兴趣小组的同学设计了以下几种简易的装置:
(1)图①、图②、图③装置是基于什么物理原理设计的________________________________________________________________
______________________________________________________________。
(2)图④装置与图①、图②、图③有很大不同。如果用FeS固体与稀硫酸,用图④装置来制取H2S。请简述操作步骤:________________________________
________________________________________________________________
____________________________________________________________。
(3)如果利用图⑤装置制取一定量的H2,其操作过程是:
________________________________________________________________
________________________________________________________________。
答案 (1)连通器原理
(2)在锥形瓶中注入适量的稀硫酸,把FeS固体装入多孔袋中,用高强度的化纤扎紧袋口,并系好铜丝,将多孔袋悬空,按图示装置放好,打开活塞,塞好橡皮塞,放松铜丝,让袋浸没在稀硫酸中;若要停止反应,抽提铜丝,便可将装有
FeS的袋子脱离稀硫酸而终止反应
(3)打开活塞把装有锌粒的干燥管浸入装有稀硫酸的烧杯中
增分点3 排液法测量气体体积的实验拓展
[知识查补]
利用气体不溶于某些液体的性质,可用排液法粗略测量气体的体积,根据给出的仪器和实验目的不同,教材中的装置(发散源)可拓展和发散成以下几种量气装置,如下图。
设计说明:图中,装置(Ⅰ)读数时应上下移动乙管,使甲、乙两管液面相平。读取反应前后甲管中液面体积读数的差值即为气体体积。装置(Ⅱ)测量收集到气体体积,应先使气体冷却至室温,再慢慢将量筒下移,使量筒内外液面高度相同,再读取读数。装置(Ⅲ)实验中水面要没过漏斗颈,量筒中装满水,反应在漏斗中进行,生成气体的体积即为量筒内气体的体积。装置(Ⅳ)用于测量混合气体中被吸收(或不被吸收)的体积分数,读数时球形容器和量气管液面相平,量气管内增加的水的体积等于不被反应管内溶液吸收的气体的体积。
[增分题例]
【例5】某化学兴趣小组制取氯水并进行有关探究实验。
实验:测定饱和氯水中氯元素的总量
(1)该小组设计的实验方案:使用下图装置,加热15.0 mL 饱和氯水试样,测定产生气体的体积。此方案不可行的主要原因是_________________________。
(不考虑实验装置及操作失误导致不可行的原因)
(2)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):_________________________________________________________________
______________________________________________________________。
资料:i.次氯酸会破坏酸碱指示剂;
ii.次氯酸或氯气可被SO2、H2O2、FeCl2等物质还原成Cl-。
答案 (1)因存在Cl2的重新溶解、HClO分解等,此方案无法测定试样含氯总量(或其他合理答案)
(2)量取一定量的试样,加入足量的H2O2溶液,待反应完全,加热除去过量的H2O2,冷却,再加入足量的硝酸银溶液,过滤、洗涤、干燥、称量沉淀质量(或其他合理答案)
【例6】 为了测定已部分变质的过氧化钠样品的纯度,设计如图所示的实验装置,图中Q为弹性良好的气球,称取一定量的样品放入其中,打开分液漏斗的活塞,将稀硫酸滴入气球中。
请回答下列问题:
(1)Q内发生反应生成________种气体,其中的反应有 ________ 个氧化还原反应。
(2)为测定反应时生成气体的总体积,滴稀H2SO4前必须关闭________(填“K1”、“K2”或“K3”,下同),打开________________________________________。
(3)当上述反应停止时,将K3关闭,然后先打开K2,再缓缓打开K1,这时可观察到的现象是__________________________________________________。
(4)b中装的固体试剂是__________,缓缓打开K1的目的是____________。
(5)实验结束时,量筒Ⅰ中有x mL水,量筒Ⅱ中收集到y
mL气体,则过氧化钠的纯度是________(用含x、y的式子表示,上述体积均已折算成标准状况)。
解析 变质的Na2O2中可能含有碳酸钠,当样品与稀硫酸接触后发生反应:2Na2O2+2H2SO4===2Na2SO4+O2↑+2H2O、H2SO4+Na2CO3===Na2SO4+CO2↑+H2O,因而Q内产生O2与CO2 两种气体,其中的反应有1个为氧化还原反应。测定Na2O2的纯度,可通过直接测定CO2和O2的体积,然后经计算求出。将稀H2SO4加入气球前,关闭K1和K2,打开K3,反应结束时气球膨胀的体积与量筒Ⅰ中所接收水的体积相等,此为CO2与O2的体积之和。待气球中反应停止后,关闭K3,打开K2,再缓缓打开K1,此时气球渐瘪,气体会经干燥管b进入量筒Ⅱ,CO2被干燥管中的吸收剂吸收,量筒Ⅱ中收集到气体的体积即为O2的体积。由题意可知,CO2和O2的总体积为x mL,O2的体积为y mL,故CO2的体积为(x-y) mL,可知Na2O2与Na2CO3的物质的量之比为2y∶(x-y),则Na2O2的纯度为w(Na2O2)=×100%=×100%。
答案 (1)2 1 (2)K1、K2 K3
(3)气球Q慢慢变小,气体进入量筒Ⅱ中
(4)碱石灰 控制气体的流速,使CO2被充分吸收
(5) ×100%
相关文档
- 2020届高考化学一轮复习化学平衡常2021-08-2420页
- 2020版高考一轮复习化学通用版学案2021-08-246页
- 2021届高考化学一轮复习化学平衡状2021-08-2424页
- 2021届高考化学一轮复习化学键作业2021-08-2416页
- 2020届高考化学一轮复习化学实验基2021-08-246页
- 2021届高考化学一轮复习化学能与热2021-08-2423页
- 2020届高考化学一轮复习化学平衡常2021-08-2425页
- 2021届高考化学一轮复习化学实验的2021-08-2415页
- 2020届高考化学一轮复习化学反应中2021-08-2418页
- 2021届高考化学一轮复习化学平衡状2021-08-2415页