- 342.47 KB
- 2021-09-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
揭阳市2019年高中毕业班高考第一次模拟考试
理 科 综 合 化学
可能用到的相对原子质量: H 1 C 12 N 14 Na 23 Al 27 Cu 64
7.下列有关说法正确的是
A.加酶洗衣粉可以很好地洗涤毛织品上的污渍
B.生物柴油与由石油炼得的柴油都属于烃类物质
C.氯水放置数天后,漂白性和酸性均减弱
D.绿色化学的核心是从源头上减少和消除化工生产对环境的污染
8.工业生产苯乙烯是利用乙苯的脱氢反应:
下列说法正确的是
A.乙苯、苯乙烯都能够发生氧化反应和还原反应
B.苯乙烯中所有原子一定共平面
C.平衡后,在恒温恒容条件下,再充入乙苯,平衡正向移动,平衡常数增大
D.苯、乙苯的主要来源是石油的分馏
9.设NA为阿伏加德罗常数的值。下列说法正确的是
A.25℃,101kPa条件下,5.6L甲烷和乙烯的混合气体中含氢原子数为NA
B.将4.6g钠用铝箔包裹并刺小孔,与足量水充分反应生成H2分子数为0.1NA
C.将1mol Cl2通入到足量的水中,则N(HClO)+N(Cl−)+N(ClO−)=2NA(N表示粒子数)
D.50℃时,1L pH=1的H2SO4溶液中,含有H+的数目为0.1NA
10.按如图装置进行实验,下列推断正确的是
选项
I中试剂
II中试剂及现象
推 断
A
铁粉与湿棉花
肥皂水冒泡
铁粉与水蒸气
发生了反应
B
硫酸亚铁
品红溶液褪色
FeSO4分解生成
FeO和SO2
C
涂有石蜡油的碎瓷片
酸性高锰酸钾溶液
褪色
石蜡油分解产物中
含有不饱和烃
D
氯化铵
酚酞溶液不变红色
氯化铵不分解
11.短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数。X与Y位于不同周期,X与W的最高化合价之和为8,元素Z的单质是目前使用量最大的主族
·8·
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
金属元素单质。下列说法中正确的是
A.化合物YX4W溶于水后,得到的溶液呈碱性
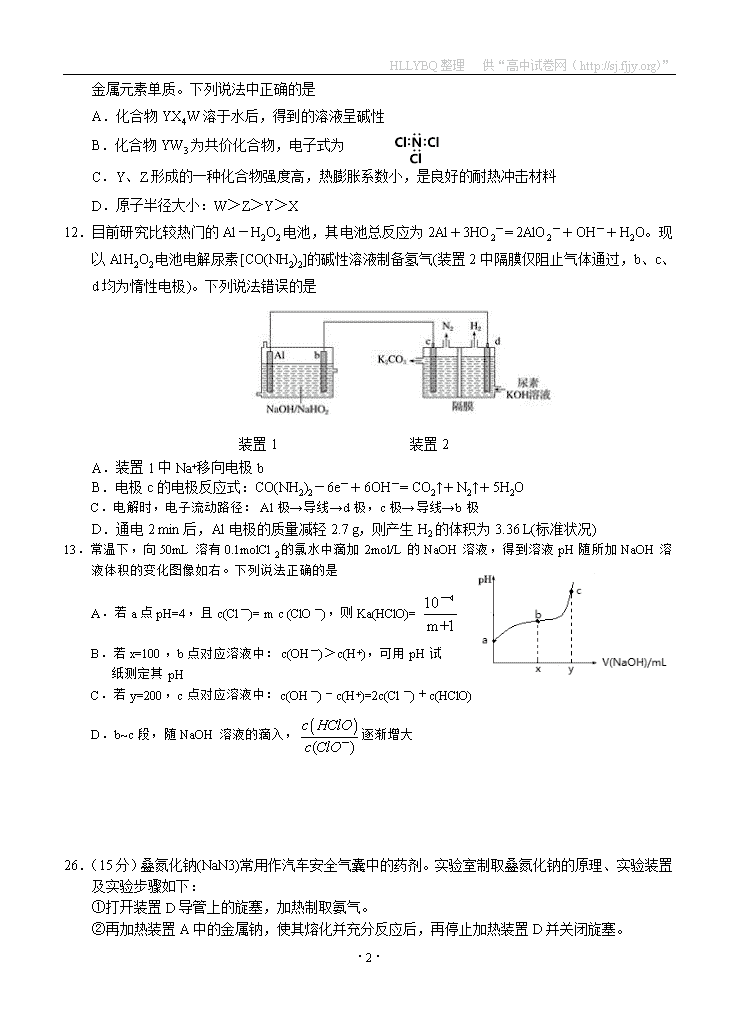
B.化合物YW3为共价化合物,电子式为
C.Y、Z形成的一种化合物强度高,热膨胀系数小,是良好的耐热冲击材料
D.原子半径大小:W>Z>Y>X
12.目前研究比较热门的Al-H2O2电池,其电池总反应为2Al+3HO2-= 2AlO2-+OH-+H2O。现以Al H2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(装置2中隔膜仅阻止气体通过,b、c、d均为惰性电极)。下列说法错误的是
装置1 装置2
A.装置1中Na+移向电极b
B.电极c的电极反应式:CO(NH2)2-6e-+6OH-= CO2↑+N2↑+5H2O
C.电解时,电子流动路径:Al极→导线→d极,c极→导线→b极
D.通电2 min后,Al电极的质量减轻2.7 g,则产生H2的体积为3.36 L(标准状况)
13.常温下,向50mL溶有0.1molCl2的氯水中滴加2mol/L的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图像如右。下列说法正确的是
A.若a点pH=4,且c(Cl-)= m c (ClO-),则Ka(HClO)=
B.若x=100,b点对应溶液中:c(OH-)>c(H+),可用pH试
纸测定其pH
C.若y=200,c点对应溶液中:c(OH-)-c(H+)=2c(Cl-)+c(HClO)
D.b~c段,随NaOH溶液的滴入,逐渐增大
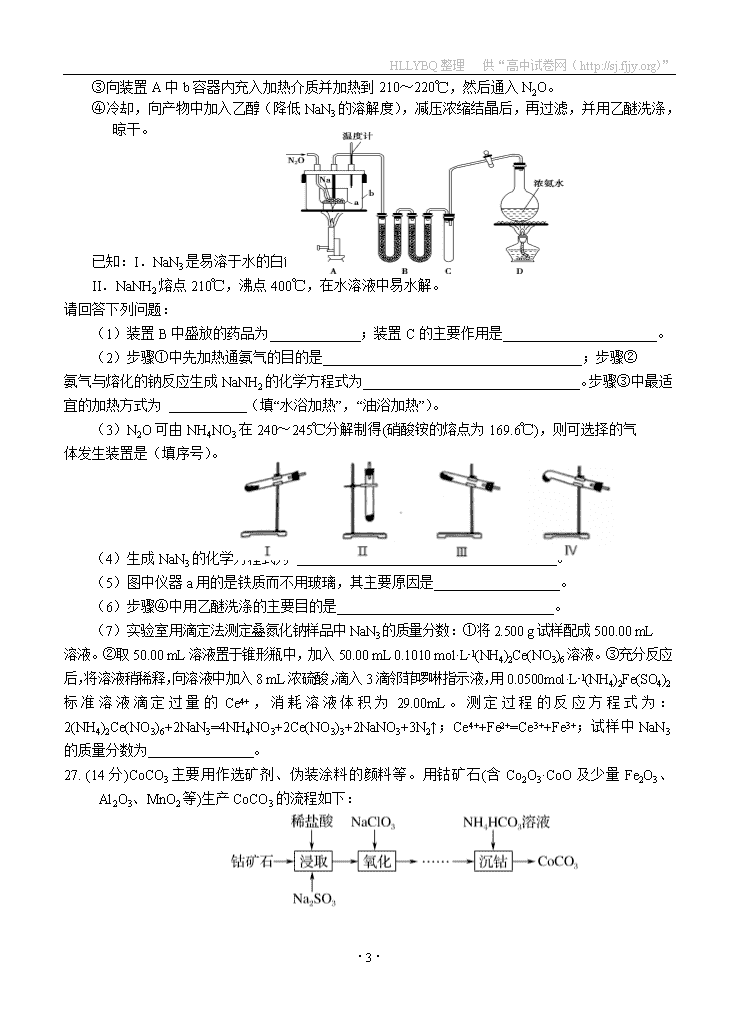
26.(15分)叠氮化钠(NaN3)常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如下:
①打开装置D导管上的旋塞,加热制取氨气。
②再加热装置A中的金属钠,使其熔化并充分反应后,再停止加热装置D并关闭旋塞。
·8·
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
③向装置A中b容器内充入加热介质并加热到210~220℃,然后通入N2O。
④冷却,向产物中加入乙醇(降低NaN3的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。
已知:I.NaN3是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
II.NaNH2熔点210℃,沸点400℃,在水溶液中易水解。
请回答下列问题:
(1)装置B中盛放的药品为_____________;装置C的主要作用是______________________。
(2)步骤①中先加热通氨气的目的是_____________________________________;步骤②
氨气与熔化的钠反应生成NaNH2的化学方程式为_______________________________。步骤③中最适宜的加热方式为 (填“水浴加热”,“油浴加热”)。
(3)N2O可由NH4NO3在240~245℃分解制得(硝酸铵的熔点为169.6℃),则可选择的气
体发生装置是(填序号)。
(4)生成NaN3的化学方程式为 。
(5)图中仪器a用的是铁质而不用玻璃,其主要原因是__________________。
(6)步骤④中用乙醚洗涤的主要目的是_______________________________。
(7)实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:①将2.500 g试样配成500.00 mL
溶液。②取50.00 mL溶液置于锥形瓶中,加入50.00 mL 0.1010 mol·L-1(NH4)2Ce(NO3)6溶液。③充分反应后,将溶液稍稀释,向溶液中加入8 mL浓硫酸,滴入3滴邻菲啰啉指示液,用0.0500mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗溶液体积为29.00mL。测定过程的反应方程式为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑;Ce4++Fe2+=Ce3++Fe3+;试样中NaN3的质量分数为 。
27. (14分)CoCO3主要用作选矿剂、伪装涂料的颜料等。用钴矿石(含Co2O3·CoO及少量Fe2O3、Al2O3、MnO2等)生产CoCO3的流程如下:
·8·
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
下表列出了几种离子生成氢氧化物沉淀的pH(“沉淀完全”是指溶液中离子浓度低于1.0×10-5 mol·L-1)
Al3+
Fe3+
Fe2+
Mn2+
Co2+
开始沉淀的pH
4.0
2.7
7.6
7.7
7.6
沉淀完全的pH
5.2
3.7
9.6
9.8
9.2
(1)写出“浸取”步骤Co2O3·CoO发生反应的离子方程式 。
(2)“浸取”步骤除Co2O3·CoO外,钴矿石中还能被Na2SO3还原的物质有 (填化学式)。
(3)加NaClO3的目的是氧化Fe2+,NaClO3的用量过多会造成的不良后果是 。
(4)“沉钴”步骤向CoCl2溶液加入NH4HCO3溶液需要55~57 ℃条件下进行,温度控制在
55~57 ℃的原因为 。
(5)已知金属萃取剂对金属离子的萃取率与pH的关系
如图所示。请补充完整由“氧化”后的溶液制备CoCO3的实验
方案:向“氧化”后的溶液中加入 ,
得较纯CoCl2溶液,加入NH4HCO3溶液沉钴得CoCO3。(实
验中须使用试剂:Na2CO3溶液、金属萃取剂、盐酸)。
28.(14分)丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯
发生的主要反应及能量变化如下图。
图1
(1)丙烷脱氢制丙烯为强吸热过程。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应) (填“增大”、“减小”或“不变”,下同),转化率α(C3H8) 。
②温度升高,副反应更容易发生的主要原因是 。
(2)下图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分
别为104 Pa和105 Pa)。
·8·
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
①104 Pa时,图中表示丙烯的曲线是 (填“ⅰ”、“ⅱ”、“ⅲ”或“ⅳ”)。
②104 Pa、500 ℃时,主反应用平衡分压代替平衡浓度表示的化学平衡常数Kp= (已知:气体分压=气体总压×体积分数)。
(3)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。
该工艺可采用铬的氧化物为催化剂,其反应机理如右图。
已知:CO和H2的燃烧热分别为
△H =-283.0 kJ·mol-1、△H =-285.8 kJ·mol-1。
①右图中催化剂为 。
②298 K 时,该工艺总反应的热化学方程式为 。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是 。
(二)选考题:共45分。请考生从2道物理题、2道化学题、2道生物题中每科任选一题作答。如果多做,则每学科按所做的第一题计分。
35.【化学——选修3:物质结构与性质】(15分)
氮及其化合物与人类生产、生活息息相关。
(1)在现代化学中,常利用________上的特征谱线来鉴定元素,称为光谱分析。
(2)基态N原子的价电子占据的能量最高的能级是________,价电子在该能级上的排布遵循的原则是_____________。
(3)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。l mol NH4BF4含有______mol配位键。
(4)化肥(NH4)2SO4中会含有N4H4(SO4)2,该物质在水中电离出SO42-和N4H44+,N4H44+遇到碱性溶液会生成一种形似白磷(P4)的N4分子。N4比P4的沸点________,原因为_______________________。
(5)尿素(H2NCONH2)也是一种常用的化肥,其分子中原子的杂化轨道类型有________,σ键和π键数目之比为__________。
(6)Cu3N具有良好的电学和光学性能,其晶胞结构如右图。
Cu+半径为a pm,N3-半径为b pm,Cu+和N3-都是紧密接触的
刚性小球,则N3-的配位数为________,Cu3N 的密度为________
g·cm-3。(阿伏加德罗常数用NA表示)
·8·
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
36.[化学——选修5:有机化学基础](15分)
聚乙烯醇肉桂酸酯(M)可用作光刻工艺中的抗腐蚀涂层,其合成路线如下:
请回答:
(1)B的化学名称为 ;M中含氧官能团的名称为 ;
F→G的反应类型为 。
(2)C→D的化学反应方程式为 。
(3)E的结构简式为 ;H的顺式结构简式为 。
(4)同时满足下列条件的F的同分异构体有 种(不考虑立体异构):①属于芳香族化合物;②能发生水解反应和银镜反应。写出其中一种核磁共振氢谱有4种吸收峰,其峰面积之比为6:2:1:1的物质的结构简式 。
(5)参照上述合成路线和相关信息,以乙烯和乙醛为原料(无机试剂任选)合成有机物
, 设计合成路线 。
揭阳市2019年高中毕业班高考第一次模拟考试
理科综合参考答案
一、二、选择题:第1~18小题只有1个正确选项,每小题6分。第19~21题有多项符合题目要求。全部选对的得6分,选对但不全的得3分,有选错的得0分。
题号
7
答案
D
题号
8
9
10
11
12
13
答案
A
D
C
C
B
C
·8·
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
三、非选择题
26. (15分)
(1)碱石灰(或氢氧化钠固体)(1分);冷凝分离出水(1分)
(2)排尽装置中的空气(1分);2Na+2NH32NaNH2+H2(2分);油浴加热(1分)
(3)I、 IV(2分。答对1个给1分)
(4) NaNH2+N2ONaN3+H2O (2分)
(5)反应过程中可能生成的NaOH能腐蚀玻璃(1分)
(6)NaN3不溶于乙醚,能减少NaN3的溶解损耗;且乙醚易挥发,有利于产品快速干燥(2分)
(7)93.60%(0.9360)(有效数字不作要求)(2分)
27. (14分)
(1)Co2O3·CoO+SO+6H+===3Co2++SO+3H2O(2分)
(2)Fe2O3、MnO2(2分)
(3)与Cl-反应生成Cl2污染环境或将Co2+氧化成Co3+(2分。答对其中一点即可)
(4)温度过高NH4HCO3易分解,温度过低反应速率缓慢(2分)
(5)Na2CO3溶液(1分),调节溶液的pH至5.2~7.6(1分),过滤(1分),向滤液中加入盐酸(1分)调pH至3.5左右(3.0~4.0均可) (1分),加入金属萃取剂萃取2~3次,静置后分液(1分)。 (共6分)
28.(14分)
(1)①增大 (1分) 增大(1分)
②副反应的活化能低于主反应的活化能(2分)
(2)①ⅰ(2分) ②3.3×103Pa(2分)
(3)①CrO3 (2分)
②C3H8(g)+CO2C3H6(g)+CO(g)+H2O(l) △H =+121.5kJ/mol(2分)
③碳与CO2反应生成CO,脱离催化剂表面(2分)
35.(15分)
(1)原子光谱(1分)
(2)2p (1分) 洪特规则(1分)
(3)2 (2分)
(4)低(1分) N4和P4都为非极性分子,N4的相对分子质量低于P4,分子间作用力比P4弱(2分)
(5)sp2 sp3 (2分) 7:1 (2分)
(6)6(1分) (2分)
·8·
HLLYBQ整理 供“高中试卷网(http://sj.fjjy.org)”
36.(15分)
(1)氯乙烯(1分) 酯基(1分) 消去反应(1分)
(2)(2分)
(3)(1分) (2分)
(4)14(2分) 或 (1分)
(5)(4分)
欢迎访问“高中试卷网”——http://sj.fjjy.org
·8·
相关文档
- 生物·安徽师大附中2016-2017学年2021-09-2436页
- 山西省大同市云冈区实验中学2019-22021-09-242页
- 河南省唐河县第一高级中学2018-2012021-09-2413页
- 黑龙江省大庆市肇州中学2019-20202021-09-249页
- 生物卷·2018届西藏拉萨中学高二上2021-09-2417页
- 生物卷·2019届河北省承德二中高二2021-09-2412页
- 甘肃省张掖市第二中学2020届高三92021-09-2412页
- 生物卷·2018届安徽师大附中高二上2021-09-2427页
- 2019-2020年湖北省武汉市钢城四中2021-09-247页
- 山东省烟台市2019-2020学年高二上2021-09-2425页