- 234.50 KB
- 2021-11-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2019年台湾省中考化学试卷
一、选择题(共10小题,每小题3分,满分3分)
1.(3分)已知甲、乙、丙、丁四种粒子为原子或单原子离子,其单粒子的原子序与电子数如表所示。关于此四种粒子的叙述,下列何者正确( )
粒子
原子序
电子数
甲
8
8
乙
9
10
丙
10
10
丁
12
10
A.甲、丙均呈电中性
B.乙、丙是相同的原子
C.乙、丁的帶电量相同
D.甲、丁的质子数均大于电子
2.如图为地球地表附近干燥空气的组成百分率图,此图中,所有能与点燃的线香发生化学反应的气体百分率之总和,约为多少?( )
A.20.9% B.21.8% C.78.1% D.79.0%
3.市售防晒霜依其阻挡紫外线的原理,分为物理性和化学性两种。物理性防晒霜的主要成分为二氧化钛(TiO2)或氧化锌(ZnO);化学性防晒霜的主要成分为柳酸酯(C15H22O3)或肉桂酸酯(C18H26O3),均为酯类。根据上述,判断物理性和化学性防晒霜的主要成分分別属于有机或无机化合物?( )
A.物理性和化学性皆属于有机化合物
B.物理性和化学性皆属于无机化合物
C.物理性属于有机化合物,化学性属于无机化合物
D.物理性属于无机化合物,化学性属于有机化合物
4.「这辆机车所载运的物质为纯氧,危险性较低…」上述为某机车发生交通事故时,消防人员所说的一段话。根据上述内容,机车所载运的化学物质最可能会在图元素周期表中的甲、乙、丙和丁哪一个区域内?( )
A.甲 B.乙 C.丙 D.丁
5.部分市售的防蚊产品以品以「敌避」为主要成分,「敌避」分子式为X12H17NO,熔点为﹣45℃,沸点为290℃,是一种具有驱蚊功效的物质。在常温常压下,「敌避」应属于下列何种物质?( )
A.液体聚合物 B.液体化合物 C.固体聚合物 D.固体化合物
6.液态N2O4与N2H4是火箭常使用的燃料。这二种物质混合并于适当条件下反应,可产生N2、H2O及大量热能,而得以推动火箭顺利升空。上述反应中,关于N2O4的叙述,下列何者正确?( )
A.因进行氧化反应,所以为氧化剂
B.因进行氧化反应,所以为还原剂
C.因进行还原反应,所以为氧化剂
D.因进行还原反应,所以为还原剂
7.取相同莫耳数的丙酮(CH3COCH3)、丙烷(C3H3)分別与氧气反应,未平衡系数的反应式如下:
CH3COCH3+O2→CO2+H2O
C3H8+O2→CO2+H2O
若丙酮和丙烷皆完全燃烧,则上述两种反应的氧气消耗量和水生成量之间关系,应为下列何者?( )
A.氧气消耗量:丙酮<丙烷;水生成量:丙酮<丙烷
B.氧气消耗量:丙酮<丙烷;水生成量:丙酮>丙烷
C.氧气消耗量:丙酮>丙烷:水生成量:丙酮<丙烷
D.氧气消耗量:丙酮>丙烷;水生成量:丙酮>丙烷
8.杂志上的一篇报导如下:「(一)海水因二氧化碳等非金属氧化物的增加而酸化,严重影响珊瑚和其他分泌碳酸钙的海洋生物生存。(二)因海水氢离子的浓度増加,这些海洋生物的碳酸钙外壳可能会遭到分解。」关于此报导画底线处内容的判断与解释,下列何者正确?( )
A.第(一)句合理,因为这些氧化物溶于海水中会使海水pH值增加
B.第(一)句不合理,因为这些氧化物溶于海水中会使海水pH值下降
C.第(二)句合理,因为这些海洋生物的碳酸钙外壳会与氢离子反应
D.第(二)句不合理,因为这些海洋生物的碳酸钙外壳不会与氢离子反应
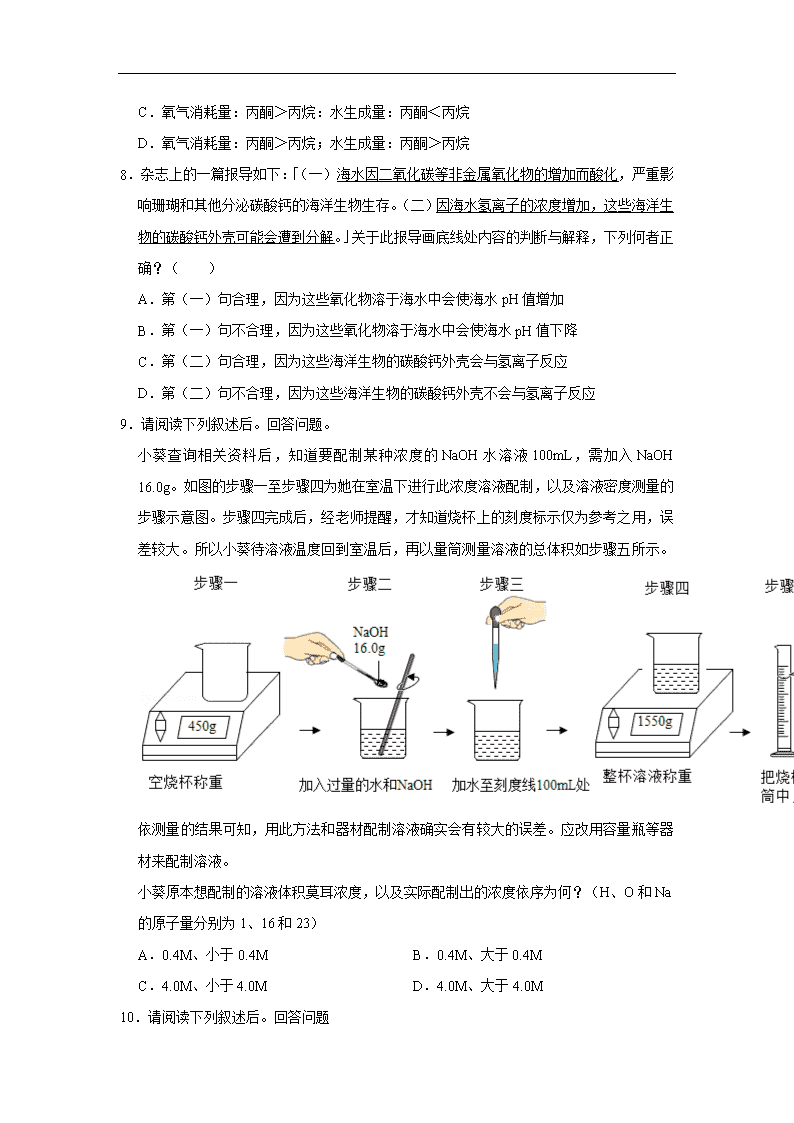
9.请阅读下列叙述后。回答问题。
小葵查询相关资料后,知道要配制某种浓度的NaOH水溶液100mL,需加入NaOH 16.0g。如图的步骤一至步骤四为她在室温下进行此浓度溶液配制,以及溶液密度测量的步骤示意图。步骤四完成后,经老师提醒,才知道烧杯上的刻度标示仅为参考之用,误差较大。所以小葵待溶液温度回到室温后,再以量筒测量溶液的总体积如步骤五所示。
依测量的结果可知,用此方法和器材配制溶液确实会有较大的误差。应改用容量瓶等器材来配制溶液。
小葵原本想配制的溶液体积莫耳浓度,以及实际配制出的浓度依序为何?(H、O和Na的原子量分别为1、16和23)
A.0.4M、小于0.4M B.0.4M、大于0.4M
C.4.0M、小于4.0M D.4.0M、大于4.0M
10.请阅读下列叙述后。回答问题
小葵查询相关资料后,知道要配制某种浓度的NaOH水溶液100mL,需加入NaOH 16.0g。如图的步骤一至步骤四为她在室温下进行此浓度溶液配制,以及溶液密度测量的步骤示意图。步骤四完成后,经老师提醒,才知道烧杯上的刻度标示仅为参考之用,误差较大。所以小葵待溶液温度回到室温后,再以量筒测量溶液的总体积如步骤五所示。
依测量的结果可知,用此方法和器材配制溶液确实会有较大的误差。应改用容量瓶等器材来配制溶液。
小葵实际配制出的溶液密度最接近下列何者?( )
A.0.86g/cm3 B.1.10g/cm3 C.1.16g/cm3 D.1.22g/cm3
2019年台湾省中考化学试卷
参考答案与试题解析
一、选择题(共10小题,每小题3分,满分3分)
1.(3分)已知甲、乙、丙、丁四种粒子为原子或单原子离子,其单粒子的原子序与电子数如表所示。关于此四种粒子的叙述,下列何者正确( )
粒子
原子序
电子数
甲
8
8
乙
9
10
丙
10
10
丁
12
10
A.甲、丙均呈电中性
B.乙、丙是相同的原子
C.乙、丁的帶电量相同
D.甲、丁的质子数均大于电子
【分析】原子序数=电子数,原子不带电,原子序数>电子数,原子带正电,原子序数<电子数,原子带负电。
【解答】解:A、甲和丙的原子序数等于核外电子数,则原子均呈电中性,故正确;
B、乙和丙的原子序数不同,属于不同原子,故错误;
C、乙中原子序数=9<电子数=10,带一个单位的负电荷,丁中原子序数12>电子数=10,带两个单位的负电荷,可知乙、丁带电量不同,故错误;
D、甲中质子数=电子数,丁中质子数<电子数,故错误;
故选:A。
【点评】原子由原子核和核外电子构成,其中原子核由质子和中子构成的,质子带正电荷,中子不带电,原子的质量主要集中在原子核上。
2.如图为地球地表附近干燥空气的组成百分率图,此图中,所有能与点燃的线香发生化学反应的气体百分率之总和,约为多少?( )
A.20.9% B.21.8% C.78.1% D.79.0%
【分析】根据空气中各成分及体积分数为:氮气:78%、氧气:21%、稀有气体:0.94%、二氧化碳0.03%、水蒸气和杂质:0.03%.进行回答。
【解答】解:由图示可知图中20.9%表示的是氧气,氧气具有助燃性,所以能与点燃的线香发生化学反应的气体百分率之总和是20.9%。
故选:A。
【点评】解答本题关键是熟悉空气的组成。
3.市售防晒霜依其阻挡紫外线的原理,分为物理性和化学性两种。物理性防晒霜的主要成分为二氧化钛(TiO2)或氧化锌(ZnO);化学性防晒霜的主要成分为柳酸酯(C15H22O3)或肉桂酸酯(C18H26O3),均为酯类。根据上述,判断物理性和化学性防晒霜的主要成分分別属于有机或无机化合物?( )
A.物理性和化学性皆属于有机化合物
B.物理性和化学性皆属于无机化合物
C.物理性属于有机化合物,化学性属于无机化合物
D.物理性属于无机化合物,化学性属于有机化合物
【分析】有机物是指含有碳元素的化合物,不包括一氧化碳、二氧化碳、碳酸盐等。
【解答】解:二氧化钛(TiO2)或氧化锌(ZnO)中都没有碳元素,属于无机物;柳酸酯(C15H22O3)和肉桂酸酯(C18H26O3)都含有碳元素,属于有机物。
故选:D。
【点评】解答本题关键是熟悉有机物的判断方法。
4.「这辆机车所载运的物质为纯氧,危险性较低…」上述为某机车发生交通事故时,消防人员所说的一段话。根据上述内容,机车所载运的化学物质最可能会在图元素周期表中的甲、乙、丙和丁哪一个区域内?( )
A.甲 B.乙 C.丙 D.丁
【分析】氧气具有助燃性,不具有可燃性。
【解答】解:由题目内容可知,氧元素位于乙区域;
故选:B。
【点评】本题主要考查氧气的性质,不能燃烧,具有助燃性。
5.部分市售的防蚊产品以品以「敌避」为主要成分,「敌避」分子式为X12H17NO,熔点为﹣45℃,沸点为290℃,是一种具有驱蚊功效的物质。在常温常压下,「敌避」应属于下列何种物质?( )
A.液体聚合物 B.液体化合物 C.固体聚合物 D.固体化合物
【分析】物质分为混合物和纯净物,混合物是由两种或两种以上的物质组成;纯净物是由一种物质组成。纯净物又分为单质和化合物。由同种元素组成的纯净物叫单质;由两种或两种以上的元素组成的纯净物叫化合物。敌避的分子式为X12H17NO,熔点为﹣45℃,沸点为290℃,是一种具有驱蚊功效的物质;在常温常压下,敌避属于液体化合物。
【解答】解:敌避的分子式为X12H17NO,熔点为﹣45℃,沸点为290℃,是一种具有驱蚊功效的物质;在常温常压下,敌避属于液体化合物;
故选:B。
【点评】本考点考查了物质的分类,要加强记忆混合物、纯净物、单质、化合物等基本概念,并能够区分应用。本考点的基础性比较强,主要出现在选择题和填空题中。
6.液态N2O4与N2H4是火箭常使用的燃料。这二种物质混合并于适当条件下反应,可产生N2、H2O及大量热能,而得以推动火箭顺利升空。上述反应中,关于N2O4的叙述,下列何者正确?( )
A.因进行氧化反应,所以为氧化剂
B.因进行氧化反应,所以为还原剂
C.因进行还原反应,所以为氧化剂
D.因进行还原反应,所以为还原剂
【分析】根据氧化反应、还原反应、氧化剂、还原剂的定义进行分析解答。
【解答】解:液态N2O4与N2H4反应的化学方程式为: 2N2H4+N2O2N2↑+4H2O,N2H4中氮元素的化合价为﹣2价,生成N2,化合价升高,发生氧化反应,是还原剂;N2O4中氮元素的化合价为+4价,生成N2,化合价降低,发生还原反应,是还氧化剂;
故选:C。
【点评】本题考查了氧化、还原反应,氧化剂、还原剂等知识,知道化合价升高发生氧化反应,是还原剂;化合价降低发生还原反应,是氧化剂,是解决本题的关键。
7.取相同莫耳数的丙酮(CH3COCH3)、丙烷(C3H3)分別与氧气反应,未平衡系数的反应式如下:
CH3COCH3+O2→CO2+H2O
C3H8+O2→CO2+H2O
若丙酮和丙烷皆完全燃烧,则上述两种反应的氧气消耗量和水生成量之间关系,应为下列何者?( )
A.氧气消耗量:丙酮<丙烷;水生成量:丙酮<丙烷
B.氧气消耗量:丙酮<丙烷;水生成量:丙酮>丙烷
C.氧气消耗量:丙酮>丙烷:水生成量:丙酮<丙烷
D.氧气消耗量:丙酮>丙烷;水生成量:丙酮>丙烷
【分析】先配平化学方程式,再根据化学方程式进行计算。
【解答】解:设1莫耳丙酮消耗氧气的质量为x,生成水的质量为y;1莫耳丙烷消耗氧气的质量为m,生成水的质量为n。
CH3COCH3+3O2→3CO2+3H2O
1莫耳 96 54
1莫耳 x y
x=96g
y=54g
C3H8+5O2→3CO2+4H2O
1莫耳 160 72
1莫耳 m n
m=160g
n=72g
所以,氧气消耗量:丙酮<丙烷;水生成量:丙酮<丙烷
故选:A。
【点评】本题是一道根据化学方程式的简单计算,利用物质之间的关系进行相应的计算。
8.杂志上的一篇报导如下:「(一)海水因二氧化碳等非金属氧化物的增加而酸化,严重影响珊瑚和其他分泌碳酸钙的海洋生物生存。(二)因海水氢离子的浓度増加,这些海洋生物的碳酸钙外壳可能会遭到分解。」关于此报导画底线处内容的判断与解释,下列何者正确?( )
A.第(一)句合理,因为这些氧化物溶于海水中会使海水pH值增加
B.第(一)句不合理,因为这些氧化物溶于海水中会使海水pH值下降
C.第(二)句合理,因为这些海洋生物的碳酸钙外壳会与氢离子反应
D.第(二)句不合理,因为这些海洋生物的碳酸钙外壳不会与氢离子反应
【分析】酸性越强,pH越小;
酸中的氢离子和碳酸钙发生反应生成氯化钙、水和二氧化碳;据此分析。
【解答】解:海水中二氧化碳等非金属氧化物的增加,可使海水中酸性增强,从而使海水酸化,pH增大,第(一)句合理,因为这些氧化物溶于水使海水pH降低,故A、B均错误;
海水中氢离子和碳酸钙可发生反应,可使海洋生物中碳酸钙外壳分解,第(二)句合理,故C正确,D错误;
故选:C。
【点评】本题主要考查酸的性质,酸性越强,pH越小。
9.请阅读下列叙述后。回答问题。
小葵查询相关资料后,知道要配制某种浓度的NaOH水溶液100mL,需加入NaOH 16.0g。如图的步骤一至步骤四为她在室温下进行此浓度溶液配制,以及溶液密度测量的步骤示意图。步骤四完成后,经老师提醒,才知道烧杯上的刻度标示仅为参考之用,误差较大。所以小葵待溶液温度回到室温后,再以量筒测量溶液的总体积如步骤五所示。
依测量的结果可知,用此方法和器材配制溶液确实会有较大的误差。应改用容量瓶等器材来配制溶液。
小葵原本想配制的溶液体积莫耳浓度,以及实际配制出的浓度依序为何?(H、O和Na的原子量分别为1、16和23)
A.0.4M、小于0.4M B.0.4M、大于0.4M
C.4.0M、小于4.0M D.4.0M、大于4.0M
【分析】物质的量=;
物质的量浓度=。
【解答】解:16.0g氢氧化钠物质的量:=0.4mol,
小葵原本想配制的溶液体积莫耳浓度:=4mol/L,
实际溶液体积是0.095L,
实际配制出的浓度:=4.2mol/L,
因此小葵原本想配制的溶液体积莫耳浓度,以及实际配制出的浓度依序为4.0M、大于4.0M。
故选:D。
【点评】本题主要考查计算方面的问题,计算时要注意规范性和准确性。
10.请阅读下列叙述后。回答问题
小葵查询相关资料后,知道要配制某种浓度的NaOH水溶液100mL,需加入NaOH
16.0g。如图的步骤一至步骤四为她在室温下进行此浓度溶液配制,以及溶液密度测量的步骤示意图。步骤四完成后,经老师提醒,才知道烧杯上的刻度标示仅为参考之用,误差较大。所以小葵待溶液温度回到室温后,再以量筒测量溶液的总体积如步骤五所示。
依测量的结果可知,用此方法和器材配制溶液确实会有较大的误差。应改用容量瓶等器材来配制溶液。
小葵实际配制出的溶液密度最接近下列何者?( )
A.0.86g/cm3 B.1.10g/cm3 C.1.16g/cm3 D.1.22g/cm3
【分析】溶液密度=。
【解答】解:溶液质量:155.0g﹣45.0g=110g,
溶液体积:95mL=95cm3,
小葵实际配制出的溶液密度:=1.16g/cm3,
故选:C。
【点评】本题主要考查计算方面的知识,计算时要注意规范性和准确性。
声明:试题解析著作权属菁优网所有,未经书面同意,不得复制发布
日期:2019/6/25 17:46:13;用户:初中校园号;邮箱:wjwl@xyh.com;学号:24424282