- 1.62 MB
- 2021-11-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
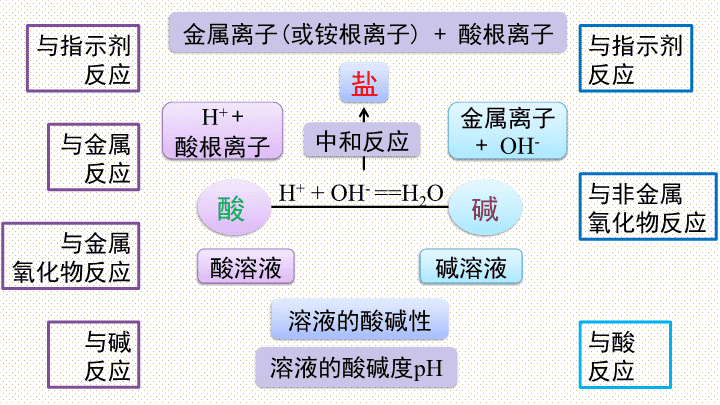
第十单元 酸和碱
小结与复习
与酸
反应
与碱
反应
与金属
氧化物反应
与金属反应
与指示剂反应
与指示剂反应
与非金属
氧化物反应
H
+
+
酸根离子
金属离子+
OH
-
H
+
+ OH
-
==H
2
O
溶液的酸碱性
酸溶液
碱溶液
溶液的酸碱度
pH
酸
碱
中和反应
盐
金属离子
(
或铵根离子
)
+
酸根离子
口诀:紫石蕊,遇酸红,遇碱蓝;无酚酞,遇酸无,遇碱红
注意
考点一 酸碱指示剂
酸碱指示剂
酸性溶液
碱性溶液
紫色石蕊溶液
变为
____
色
变为
____
色
无色酚酞溶液
______
色
变为
____
色
无
蓝
红
红
指示剂遇到酸性溶液或碱性溶液时,变色的是指示剂,而不是酸性溶液或碱性溶液。
碱溶液
碱性溶液
酸溶液
酸性溶液
考点二 常见酸的性质
(1)
浓盐酸具有
_____
__,在空气中能形成
______
,有腐蚀性。
(2)
浓硫酸易溶于水,具有
______
性、
_____
性(脱水性)。
1
.浓盐酸、浓硫酸的性质
白雾
吸水
腐蚀
挥发性
注
意
①
稀释浓硫酸:
酸入水、沿器壁、缓缓倒、不断搅。
②由于浓硫酸具有吸水性,故在实验室常用作干燥剂。
④如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量的水冲洗,然后再涂上
3%~5%
的碳酸氢钠溶液。
③敞口放置,浓盐酸因挥发性而使其质量减少;浓硫酸因吸水性而使其质量增加,所以它们都要
密封保存
。
【练习1】(2018湖南郴州中考)分别将一小瓶浓盐酸、浓硫酸露置在空气中一段时间后,发生的共同变化是( )
A.
溶液的质量减小
B.
溶液的浓度减小
C.
溶质的质量减小
D.
溶剂的质量增大
B
2.稀盐酸、稀硫酸的化学性质
由于盐酸、稀硫酸在水溶液中都能解离出______,所以具有相似的化学性质。
H
+
(1)
酸能与指示剂反应
酸能使紫色石蕊溶液变__色,使无色酚酞溶液____。
红
不变色
(2)酸能与多种活泼金属反应,生成盐和氢气
(氢前可换氢)
与稀盐酸反应
与稀硫酸反应
镁
锌
铁
Mg
+
2HCl
=
MgCl
2
+
H
2
↑
Zn
+
2HCl
=
ZnCl
2
+
H
2
↑
Mg
+
H
2
SO
4
=
MgSO
4
+
H
2
↑
Zn
+
H
2
SO
4
=
ZnSO
4
+
H
2
↑
Fe
+
2HCl
=
FeCl
2
+
H
2
↑
Fe
+
H
2
SO
4
=
FeSO
4
+
H
2
↑
(3)
酸能与某些金属氧化物反应,生成盐和水
现象
化学方程式
铁锈+
盐酸
铁锈+
稀硫酸
氧化铜
+
盐酸
氧化铜
+
稀硫酸
Fe
2
O
3
+
6HCl
=
2FeCl
3
+
3H
2
O
Fe
2
O
3
+
3H
2
SO
4
=
Fe
2
(SO
4
)
3
+
3H
2
O
CuO
+
2HCl
=
CuCl
2
+
H
2
O
CuO
+
H
2
SO
4
=
CuSO
4
+
H
2
O
红棕色
固体逐渐消失,溶液由无色逐渐变成
黄色
。
黑色固体逐渐消失,溶液由无色逐渐变成
蓝色
。
(4)酸和碱发生中和反应,生成盐和水
Na
OH
+
H
Cl =
NaCl +
H
2
O
Ca(
OH
)
2
+ 2
H
Cl =
CaCl
2
+ 2
H
2
O
2
Na
OH
+
H
2
SO
4
=
Na
2
SO
4
+ 2
H
2
O
小
结
稀盐酸、稀硫酸
的化学性质
1
跟指示剂的反应
2
跟金属的反应
3
跟金属氧化物的反应
4
跟碱的反应
酸能使石蕊溶液变红色,使酚酞溶液不变色。
金属
+
酸
==
盐
+
氢气
↑
Zn
+
H
2
SO
4
=
ZnSO
4
+
H
2
↑
Fe
2
O
3
+6HCl= 2FeCl
3
+3H
2
O
金属氧化物
+
酸
==
盐
+
水
NaOH+HCl= NaCl+H
2
O
碱
+
酸
==
盐
+
水
【练习
2
】(2018海南中考)向氧化铜和铁粉的混合物中加入一定量稀硫酸,充分反应后过滤,向滤渣 中再滴入稀硫酸,有气泡产生,则下列判断正确的是( )
A.
滤渣中可能含
Cu
B.
滤渣中只含
Fe
C.
滤液中不含
CuS
O
4
D.
滤液中不一定含
FeS
O
4
C
考点三
常见碱的性质
氢氧化钠:白色固体,
______
溶于水并放出大量的热;易吸收水分而
____
,有强烈的腐蚀性。俗称火碱、烧碱、苛性钠。
氢氧化钙:白色粉末状固体,
______
溶于水,有腐蚀性。
极易
潮解
微
注意
①
氢氧化钠固体不仅吸水潮解,而且还能与空气中的二氧化碳反应,使氢氧化钠转变为碳酸钠而变质,所以氢氧化钠必须密封保存。氢氧化钙也要密封保存。
1
.氢氧化钠、氢氧化钙的物理性质
②氢氧化钙可用生石灰与水反应制得,此反应能放出大量的热,反应的化学方程式是
CaO
+
H
2
O===
__________
。
Ca(OH)
2
③如果不慎将碱液沾到皮肤上,要用大量水冲洗,再涂上
硼酸
溶液。
④氧化钙、氢氧化钙、碳酸钙的俗称及相互转化:
碳酸钙
(
CaCO
3
)
是大理石或石灰石等主要成分。
氧化钙
(
CaO
)
俗称:生石灰。
氢氧化钙
[
Ca(OH)
2
]
俗称:熟石灰、消石灰。
2
.氢氧化钠、氢氧化钙的化学性质
由于氢氧化钠、氢氧化钙在水溶液中都能解离出
______
,所以具有相似的化学性质。
OH
-
(1)
碱溶液能与指示剂反应
碱溶液能使紫色石蕊溶液变__
_
,使无色酚酞溶液变___。
蓝色
红色
(2)
碱溶液能与某些非金属氧化物反应,生成盐和水。
化学方程式
石灰水
+
CO
2
NaOH
溶液
+
CO
2
NaOH
溶液
+
SO
3
Ca(OH)
2
+ CO
2
= CaCO
3
+ 2H
2
O
2NaOH + CO
2
= Na
2
CO
3
+ H
2
O
2NaOH + SO
3
= Na
2
SO
4
+ H
2
O
(
3
)
碱和酸发生中和反应,生成盐和水。
小
结
氢氧化钠、氢氧化钙的化学性质
1
跟指示剂的反应
2
跟非金属氧化物的反应
3
跟酸的反应
碱溶液能使石蕊溶液变蓝色,使酚酞溶液变
红
色。
碱溶液
+
非金属氧化物
==
盐
+
水
2NaOH+CO
2
=Na
2
CO
3
+ H
2
O
碱
+
酸
==
盐
+
水
NaOH+HCl= NaCl+H
2
O
【练习
3
】(2018重庆中考)氢氧化钠溶液和氨水都能使酚酞溶液变红,其原因是二者的溶液中均含有 一种相同的粒子是( )
A.H
+
B.OH
-
C.H
2
O
D.H
【练习
4
】(2018湖北恩施州中考)下列关于氢氧化钠的描述中错误的是( )
A.
可用于改良酸性土壤
B.
易溶于水,溶解时放出大量的热
C.
能去除油污,可作炉具清洁剂
D.
对皮肤有强烈的腐蚀作用
B
A
考点四
常见酸和碱的用途
用 途
盐酸
化工产品。可用于除锈、制造药物等;
人体胃液中含有盐酸,可帮助消化
硫酸
化工原料。用于生产化肥、农药、火药;除锈;精炼石油等,
浓硫酸有吸水性,常用做干燥剂
氢氧化钠
重要化工原料,用于制造肥皂,以及石油、造纸、纺织、印染等工业
氢氧化钙
常用作建筑材料,农业上可用于配制农药波尔多液。
熟石灰用于改良酸性土壤
考点五
酸碱中和反应
酸和碱作用生成
______
和
______
的反应,叫作中和反应。反应的实质是酸中解离出的
H
+
与碱中解离出的
OH
-
反应生成水分子
H
+
+
OH
-
===H
2
O
盐
水
注
意
①
不少中和反应没有明显的实验现象
(
如
NaOH
溶液与稀盐酸的反应
)
,常需借助指示剂来判断反应的发生。如在碱溶液中先加入无色酚酞溶液,使溶液显红色,然后边滴加酸边振荡,当溶液由红色
刚好
变为无色时,酸碱恰好完全反应。
②发生中和反应时,会放出热量。
③中和反应属于将要学到的基本反应类型中的复分解反应。
1
.中和反应
(1)
调节土壤的酸碱性
根据土壤情况,可以利用中和反应,在土壤中加入酸性或碱性物质,调节土壤的酸碱性,以利于农作物生长。例如,用
_________
改良酸性土壤。
熟石灰
2
.中和反应的应用
(2)
处理工业废水
生产过程中的污水,需进行一系列的处理。如硫酸厂的污水中含有硫酸等杂质,可以用熟石灰进行中和处理。
(3)
用于医疗
服用某些含有碱性物质
[
如
Mg(OH)
2
]
的药物以治疗胃酸
过多
;人们被蚊虫叮咬后肿起大包且痛痒,可以涂一些氨水、牙膏等碱性物质中和蚊虫分泌的蚁酸。
【练习
5
】(2018山东临沂中考)向
NaOH
溶液中滴入
HC1
溶液至恰好完全反应。
(
1
)右图表示该反应前后溶液中存在的主要离子,在右面横线上写出每种图形表示的离子(填离子符号)。
(2)反应的化学方程式是
_________________________
(3)下列物质中只有一种能与
KOH
溶液发生上述类似反应,应是
_____
(填序号)。
①
HN
O
3
②CuS
O
4
③CaCl
2
①
Na
+
OH
-
NaOH
+
HC1
==
NaC1
+ H
2
O
【练习
6
】
(
2018湖南益阳中考
)
某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,测得烧杯中溶液
pH
的变化如图所示。下列说法正确的是( )
A.a
点所示溶液呈酸性
B.
向
b
点所示溶液中滴加石蕊
溶液,溶液呈紫色
C.
该实验是将
NaOH
溶液逐滴
滴入稀硫酸中
D.c
点所示溶液中,含有的溶质是
Na
2
S
O
4
和
NaOH
B
考点六 溶液酸碱度的测定及应用
1
.溶液的酸碱度可用
pH
表示
(1)
pH
<
7
,溶液显
____
性,
pH
越
____
,酸性越强;
(2)
pH=7
,溶液显
____
性;
(3)
pH>7
,溶液显
____
性,
pH
越
____
,碱性越强。
酸
小
中
碱
大
2
.
pH
与溶液酸碱性的关系
3
.
pH
的测定方法:
在
_________________
上放一小片
pH
试纸,用干燥洁净的
_________
蘸取待测液,滴到
pH
试纸上,把试纸显示的颜色与
____________
比较,读出
pH(
正整数
)
。
白瓷板
(
或玻璃片
)
玻璃棒
标准比色卡
注
意
①
用
pH
试纸测溶液的
pH
时,
pH
试纸不能用水润湿,否则会起到稀释待测溶液的作用,使结果不准确。
②不能将
pH
试纸直接放入待测溶液中,会污染试剂。
4.溶液酸碱度的重要意义
(1)
化工生产中许多反应必须控制在一定
pH
范围内。
(2)
农作物适宜在
pH
为
____
或接近
____
的土壤中生长。
(3)
测定雨水的
pH
(
酸雨的
pH
小于
_____)
,可以了解空气的污染情况。
(4)
测定人体内或排出的液体的
pH
,可以了解人体的健康状况。
7
7
5.6
【练习
7
】
(
2018四川广安中考
)
一些食物的近似pH如下:
下列说法正确的是( )
A.
鸡蛋清和牛奶显碱性
B.
要补充维生素可以多吃鸡蛋清
C.
苹果汁的酸性比葡萄汁弱
D.
胃酸过多的人应少饮葡萄汁和苹果汁
D
易错点归纳
1
.误认为酸性溶液就是酸溶液,碱性溶液就是碱溶液。另外酸性溶液和碱性溶液都能导电。
2
.滴入酚酞溶液显无色,误认为就是中性溶液。
3
.把酸碱指示剂在酸碱溶液中的变色,误认为是酸碱溶液的变色。
4
.中和反应一定生成盐和水,但有盐和水生成的反应不一定是中和反应。
5
.测溶液的酸碱度时,
pH
试纸不能用水润湿、不能直接插入待测液中,测得的
pH
只能为正整数,不能为小数。
化学方程式网络构建
1
.常见酸
(HCl
、
H
2
SO
4
)
的反应
①______________________________
②______________________________
③______________________________
④______________________________
⑤______________________________
⑥______________________________
⑦
______________________________
请写出
稀硫酸
与各物质
反应的
化学方程式
与盐酸的的反应
2.常见碱[
NaOH、Ca(OH)
2
]的反应
①______________________________
______________________________
②______________________________
______________________________
③______________________________
______________________________
2NaOH + CO
2
=== Na
2
CO
3
+ H
2
O
Ca(OH)
2
+ CO
2
=== CaCO
3
↓
+ H
2
O
HCl + NaOH === NaCl + H
2
O
2HCl + Ca(OH)
2
=== CaCl
2
+ 2H
2
O
2NaOH + H
2
SO
4
=== Na
2
SO
4
+ 2H
2
O
Ca(OH)
2
+ H
2
SO
4
=== CaSO
4
+ 2H
2
O