- 378.00 KB
- 2021-11-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2019年江苏省连云港市中考化学试卷
一.选择题(本题包括12小题,每小题2分,共24分.每小题只有一个选项符合题意
1.(2分)践行“绿水青山就是金山银山”理念,建设美丽连云港。下列做法符合该理念的是( )
A.过度施用农药 B.回收废弃塑料
C.就地焚烧秸秆 D.任意排放污水
2.(2分)下列过程中包含化学变化的是( )
A.花香四溢 B.海水晒盐 C.积雪融化 D.粮食酿酒
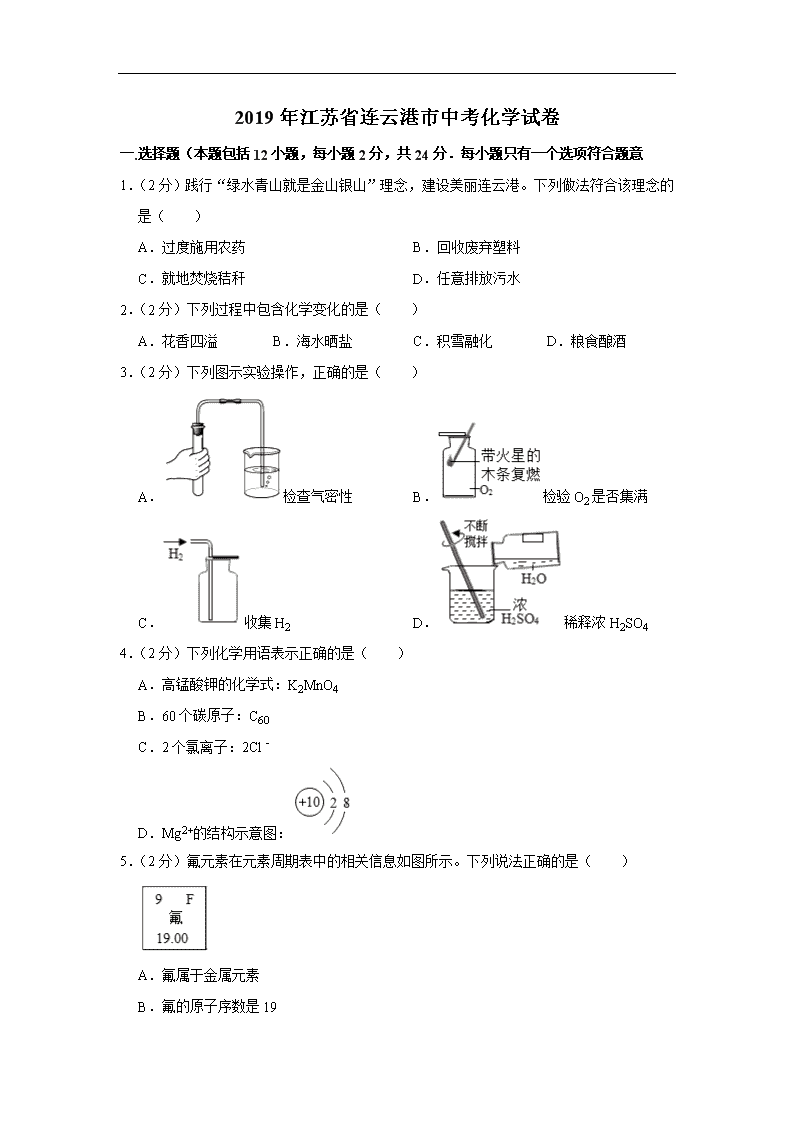
3.(2分)下列图示实验操作,正确的是( )
A.检查气密性 B.检验O2是否集满
C.收集H2 D.稀释浓H2SO4
4.(2分)下列化学用语表示正确的是( )
A.高锰酸钾的化学式:K2MnO4
B.60个碳原子:C60
C.2个氯离子:2Cl﹣
D.Mg2+的结构示意图:
5.(2分)氟元素在元素周期表中的相关信息如图所示。下列说法正确的是( )
A.氟属于金属元素
B.氟的原子序数是19
C.氟原子中质子数为9
D.氟原子中核外电子数是10
6.(2分)下列有关物质的性质与用途具有对应关系的是( )
A.石墨具有导电性,可用于制铅笔芯
B.N2的化学性质不活泼,可用作保护气
C.NaCl溶液有咸味,可用于配制生理盐水
D.Ca(OH)2微溶于水,可用于改良酸性土壤
7.(2分)尿素[CO(NH2)2]是常用的化学肥料。下列关于尿素的说法正确的是( )
A.属于复合肥
B.由3种元素组成
C.氢、氮元素的质量比为1:14
D.氮元素的质量分数最大
8.(2分)下列说法正确的是( )
A.硬水经蒸馏处理后可变为软水
B.长期放置后不会分层的液体一定是溶液
C.图中红磷不燃烧,说明红磷不是可燃物
D.在化学反应中只有燃烧反应才能放出热量
9.(2分)在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.H2O2O2SO2
B.CuAgAgCl
C.酒精CO2CO
D.钢铁Fe2O3•xH2OFeSO4
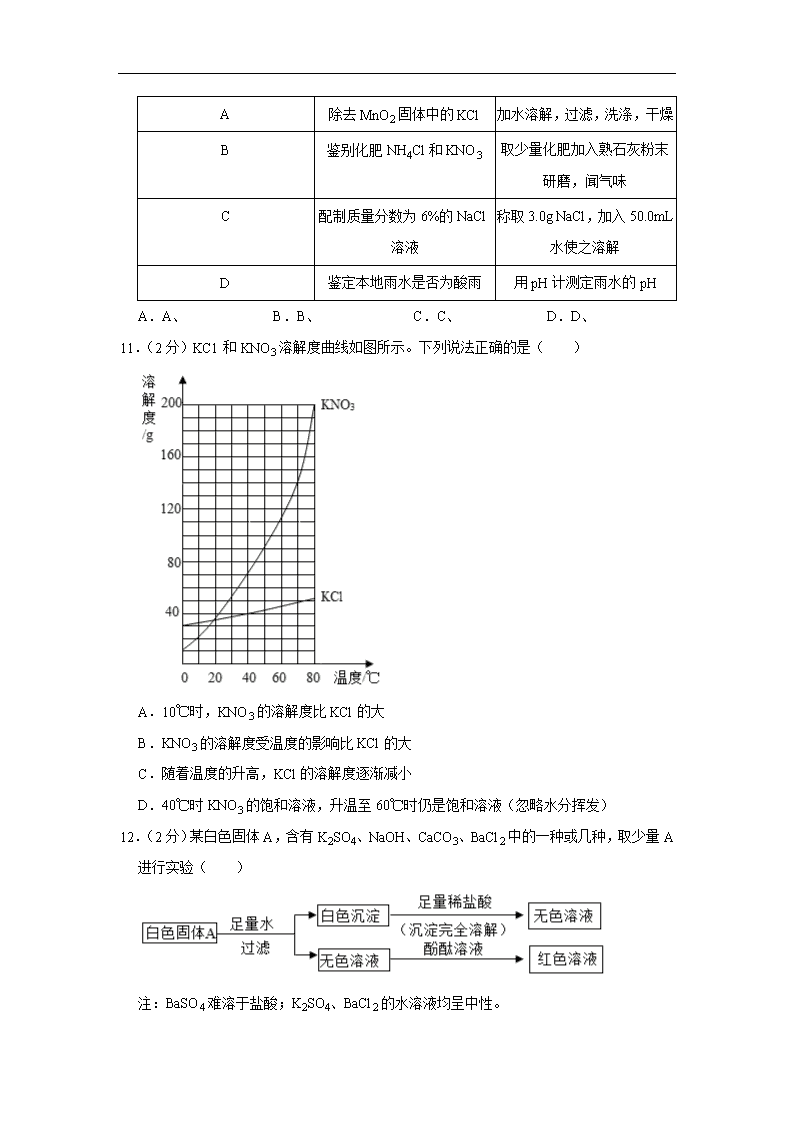
10.(2分)下列实验方法不能达到实验目的是( )
选项
实验的目的
实验方法
A
除去MnO2固体中的KCl
加水溶解,过滤,洗涤,干燥
B
鉴别化肥NH4Cl和KNO3
取少量化肥加入熟石灰粉末研磨,闻气味
C
配制质量分数为6%的NaCl溶液
称取3.0g NaCl,加入50.0mL水使之溶解
D
鉴定本地雨水是否为酸雨
用pH计测定雨水的pH
A.A、 B.B、 C.C、 D.D、
11.(2分)KC1和KNO3溶解度曲线如图所示。下列说法正确的是( )
A.10℃时,KNO3的溶解度比KCl的大
B.KNO3的溶解度受温度的影响比KCl的大
C.随着温度的升高,KCl的溶解度逐渐减小
D.40℃时KNO3的饱和溶液,升温至60℃时仍是饱和溶液(忽略水分挥发)
12.(2分)某白色固体A,含有K2SO4、NaOH、CaCO3、BaCl2中的一种或几种,取少量A进行实验( )
注:BaSO4难溶于盐酸;K2SO4、BaCl2的水溶液均呈中性。
据此实验可知,固体A中的物质最多有( )
A.1种 B.2种 C.3种 D.4种
六、非选择题(本题包括4小题,共36分)
13.(6分)化学在促进社会发展,提高人类生活质量方面发挥着不可替代的作用。
(1)中国有过年吃饺子的习俗。制作饺子的原料有小麦粉、肉馅、蔬菜、植物油、调味剂等。
①小麦粉中富含的基本营养素是 。
②肉馅中的蛋白质是由多种 (填字母)构成的极为复杂的化合物。
a.维生素 b.无机盐 c.氨基酸
③铁强化酱油是常用的调味剂,长期食用可以预防 (填字母)。
a.骨质疏松 b.贫血 c.甲状腺肿大
(2)材料在生产、生活中应用广泛。
①下列物品中,由有机合成材料制成的是 (填字母)。
②C919飞机机身蒙皮使用了铝锂合金材料。下列不属于铝锂合金性质的是 (填字母)。
a.密度大
b.硬度高
c.抗腐蚀
(3)中国嫦娥四号月球探测器首次证实构成月幔的主要物质之一是Fe2SiO4.已知Fe2SiO4中硅元素的化合价为+4,则其中铁元素的化合价为 。
14.(10分)化学的基本特征是研究和创造物质。试从科学家认识物质的视角认识CO2。
(1)分类角度
CO2属于 (填字母)
a.单质 b.氧化物 c.有机物
(2)微观角度
我国研制的一种新型催化剂可将CO2和H2转化为甲醇(CH3OH)和X.若用“O”表示氢原子,“”表示氧原子,“”表示碳原子,该反应的微观示意图如图:
画出X分子的微观示意图: (用0.5mm黑色墨水签字笔作答)。
(3)性质角度
三百多年前,人们发现一些洞穴内有一种能使燃烧的木柴熄灭的气体,后来该气体被证实是CO2.据此推测CO2具有的化学性质是 。
(4)变化角度
如图是某同学整理的物质转化图;实验室中常用CO2→CaCO3检验CO2气体,写出其化学反应方程式
(5)应用角度
I.可用如图所示方法自制汽水来消暑解热
制汽水时,NaHHCO3与柠檬酸反应生成柠檬酸钠、二氧化碳和水。
①据此推测,通常条件下不能与柠檬酸反应的物质 (填字母)。
a.镁带 b.氯化钠 c.烧碱
②打开汽水瓶盖时汽水会自动喷出来。说明气体在水中的溶解度与 有关。
Ⅱ.Al﹣CO2电池是一种新型电池。
③电池的工作原理:在O2的催化下,Al与CO2发生化合反应生成Al2(C2O4)3.写出此反应的化学方程式 。
(6)环保角度
全球参与控制CO2的排放量是防止温室效应进一步增强的根本对策。下列限制CO2排放量的做法不合理的是 (填字母)。
a.制定旨在限制CO2排放的国际规定
b.减少化石能源的使用,开发太阳能等新能源
c.工厂通过加高烟囱直接排放含CO2的废气
15.(8分)以镁矿石(主要成分MgCO3、SiO2)为原料生产MgO的工艺流程如图
注:SiO2难溶于水和常见的酸;“沉镁”过程中有Mg(OH)2生成。
(1)滤渣X的主要成分为 (填化学式)。
(2)实验室中用图一所示装置进行过滤。
①该装置中仪器A的名称为 。
②若过滤时滤液出现浑浊,可能的原因是 (填字母)。
a.滤纸已破损 b.漏斗中液面低于滤纸边缘 c.滤纸未紧贴漏斗内壁
(3)“沉镁”时MgSO4与NH3•H2O发生反应。结合图二,写出该反应的化学方程式 。
(4)已知在不同温度下,充分加热等质量的Mg(OH)2,加热温度与固体残留率的关系如题图三所示。“加热”时温度至少要达到350℃,原因是 。
16.(12分)NaOH是重要的化工原料,研究其制备、检验、贮存及应用具有重要意义。
(1)工业上常用电解饱和食盐水的方法制取NaOH,反应的化学方程式为2NaCl+2H2O2NaOH+Cl2↑+X↑.X的化学式为 。
(2)为了探究NaOH样品中是否存在NaCl、Na2CO3杂质,设计如下实验方法
注:AgCl是白色固体,难溶于水和稀HNO3
①乙中有无色无味气体产生,证明样品中含有Na2CO3.产生气体的化学方程式为 。
②试剂X为 溶液;可证明NaCl存在的现象是 。
(3)某兴趣小组试图通过测定生成的CO2质量,确定因久置而变质的NaOH固体中Na2CO3的质量分数,设计了图所示装置并进行如下实验:
步骤一:取一定质量的样品,加入气密性良好的锥形瓶中,然后在分液漏斗中加入足量的稀硫酸,称出装置总质量为m1。
步骤二:打开分液漏斗旋塞,逐滴加入稀硫酸,待气泡不再产生时,关闭旋塞,称出装置总质量为m2。
①球形干燥管中不用NaOH固体而用CaCl2固体的原因是 。
②小明同学认为(m1﹣m2)即为生成的CO2质量,小红同学认为小明的想法不合理,理由是 。
(4)某工厂化验室用20%NaOH溶液洗涤一定量石油产品中残余H2SO4,共消耗NaOH溶液20g,洗涤后的溶液呈中性。这一定量石油产品中所含H2SO4的质量为 (写出计算过程,否则不得分)。
2019年江苏省连云港市中考化学试卷
参考答案与试题解析
一.选择题(本题包括12小题,每小题2分,共24分.每小题只有一个选项符合题意
1.(2分)践行“绿水青山就是金山银山”理念,建设美丽连云港。下列做法符合该理念的是( )
A.过度施用农药 B.回收废弃塑料
C.就地焚烧秸秆 D.任意排放污水
【分析】践行“绿水青山就是金山银山”理念,就是要减少污染,保护环境,进行分析判断。
【解答】解:A、过度施用农药,会污染土壤、水体等,做法不符合该理念,故选项错误。
B、回收废弃塑料,能减少白色污染,做法不符合该理念,故选项正确。
C、就地焚烧秸秆,会产生大量的空气污染物,会严重污染空气,做法不符合该理念,故选项错误。
D、任意排放污水,会造成水体污染,做法不符合该理念,故选项错误。
故选:B。
【点评】本题难度不大,了解减少白色污染的措施、空气与水体的污染与防治是正确解答本题的关键。
2.(2分)下列过程中包含化学变化的是( )
A.花香四溢 B.海水晒盐 C.积雪融化 D.粮食酿酒
【分析】有新物质生成的变化属于化学变化,没有新物质生成的变化属于物理变化,判断化学变化的唯一标准是有新物质生成。
【解答】解:A、花香四溢过程中没有生成新物质,是物理变化;
B、海水晒盐过程中没有生成新物质,是物理变化;
C、积雪融化过程中没有生成新物质,是物理变化;
D、粮食酿酒过程中生成酒精等物质,是化学变化。
故选:D。
【点评】判断变化是否属于化学变化的唯一标准是:是否有新物质生成,如果有新物质生成,就是化学变化,如果没有新物质生成,就不是化学变化。
3.(2分)下列图示实验操作,正确的是( )
A.检查气密性 B.检验O2是否集满
C.收集H2 D.稀释浓H2SO4
【分析】A、根据检查装置气密性的方法进行分析判断。
B、根据氧气的验满方法进行分析判断。
C、根据氢气的密度比空气的小,进行分析判断。
D、根据浓硫酸的稀释方法(酸入水,沿器壁,慢慢倒,不断搅)进行分析判断。
【解答】解:A、检查装置气密性的方法:把导管的一端浸没在水里,双手紧贴容器外壁,若导管口有气泡冒出,装置不漏气;图中所示操作正确。
B、检验氧气是否收集满时,应将带火星的木条放在集气瓶口,不能伸入瓶中,图中所示操作错误。
C、氢气的密度比空气的小,应选用向下排空气法收集,图中所示操作错误。
D、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时的扩散;一定不能把水注入浓硫酸中;图中所示操作错误。
故选:A。
【点评】本题难度不大,熟悉各种仪器的用途及使用注意事项、常见化学实验基本操作的注意事项是解答此类试题的关键。
4.(2分)下列化学用语表示正确的是( )
A.高锰酸钾的化学式:K2MnO4
B.60个碳原子:C60
C.2个氯离子:2Cl﹣
D.Mg2+的结构示意图:
【分析】高锰酸钾中,钾元素的化合价是+1,高锰酸根的化合价是﹣1,根据化合物中元素化合价代数和为零可知,高锰酸钾中钾原子和高锰酸根的个数比是1:1;
元素符号可以表示一种元素,还可以表示该元素的1个原子,有时还可以表示一种物质,例如金属元素的元素符号可以表示该金属,稀有气体的元素符号可以表示稀有气体;
每个氯离子带1个单位负电荷;
镁原子核内质子数是12。
【解答】解:A、高锰酸钾化学式是KMnO4,该选项书写不正确;
B、60个碳原子可以表示为60C,该选项书写不正确;
C、2个氯离子可以表示为2Cl﹣,该选项书写正确;
D、Mg2+的结构示意图中,核内质子数是12,该选项书写不正确。
故选:C。
【点评】本题主要考查学生对化学用语的书写和理解能力,题目重点考查了学生对化学符号的书写,考查全面,注重基础,题目难度较小。
5.(2分)氟元素在元素周期表中的相关信息如图所示。下列说法正确的是( )
A.氟属于金属元素
B.氟的原子序数是19
C.氟原子中质子数为9
D.氟原子中核外电子数是10
【分析】元素周期表中,方格中左上角是原子序数,右上角是元素符号,中间是元素名称,下面是相对原子质量;
原子中,核电荷数=核内质子数=核外电子数=原子序数;
除汞外,金属元素的名称都带金字旁,非金属元素的名称不带金字旁。
【解答】解:A、氟元素是非金属元素,该选项说法不正确;
B、氟原子原子序数是19,该选项说法不正确;
C、氟原子中质子数为9,该选项说法正确;
D、氟原子中核外电子数是10,该选项说法不正确。
故选:C。
【点评】元素周期表反映了元素之间的内在联系,要注意理解和应用。
6.(2分)下列有关物质的性质与用途具有对应关系的是( )
A.石墨具有导电性,可用于制铅笔芯
B.N2的化学性质不活泼,可用作保护气
C.NaCl溶液有咸味,可用于配制生理盐水
D.Ca(OH)2微溶于水,可用于改良酸性土壤
【分析】A、根据石墨质软,进行分析判断。
B、根据氮气的化学性质不活泼,进行分析判断。
C、根据生理盐水是0.9%的氯化钠溶液,进行分析判断。
D、根据改良酸性土壤的物质应具有碱性,进行分析判断。
【解答】解:A、石墨质软,可用于制铅笔芯,故选项说法错误。
B、氮气的化学性质不活泼,可用作保护气,故选项说法正确。
C、生理盐水是0.9%的氯化钠溶液,氯化钠可用于配制生理盐水,故选项说法错误。
D、Ca(OH)2具有碱性,可用于改良酸性土壤,故选项说法错误。
故选:B。
【点评】本题难度不大,物质的性质决定物质的用途,掌握常见化学物质的性质和用途是正确解答此类题的关键。
7.(2分)尿素[CO(NH2)2]是常用的化学肥料。下列关于尿素的说法正确的是( )
A.属于复合肥
B.由3种元素组成
C.氢、氮元素的质量比为1:14
D.氮元素的质量分数最大
【分析】A、根据尿素中含有氮元素,进行分析判断。
B、根据尿素化学式的含义,进行分析判断。
C、根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析判断。
D、根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析判断。
【解答】解:A、尿素中含有氮元素,属于氮肥,故选项说法错误。
B、尿素是由碳、氧、氮、氢四种元素组成的,故选项说法错误。
C、氢、氮元素的质量比为(1×4):(14×2)=1:7,故选项说法错误。
D、尿素中C、O、N、H元素的质量比为12:16:(14×2):(1×
4)=3:4:7:1,则氮元素的质量分数最大,故选项说法正确。
故选:D。
【点评】本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力。
8.(2分)下列说法正确的是( )
A.硬水经蒸馏处理后可变为软水
B.长期放置后不会分层的液体一定是溶液
C.图中红磷不燃烧,说明红磷不是可燃物
D.在化学反应中只有燃烧反应才能放出热量
【分析】A、硬水经蒸馏处理后变为蒸馏水,属于软水;B、长期放置后不会分层的液体不一定是溶液,例如蒸馏水;C、红磷不燃烧是因为温度没有达到着火点;D、金属与酸反应放热,酸碱中和反应放热。
【解答】解:A、硬水经蒸馏处理后变为蒸馏水,属于软水,故A正确;
B、长期放置后不会分层的液体不一定是溶液,例如蒸馏水,故B错;
C、红磷不燃烧是因为温度没有达到着火点,故C错;
D、金属与酸反应放热,酸碱中和反应放热,故D错。
故选:A。
【点评】解答本题关键是熟悉溶液的特点,燃烧的条件,化学反应能量的变化。
9.(2分)在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.H2O2O2SO2
B.CuAgAgCl
C.酒精CO2CO
D.钢铁Fe2O3•xH2OFeSO4
【分析】
一步反应实现即原物质只发生一个反应即可转化为目标物质,根据所涉及物质的性质,分析能否只通过一个反应而实现即可。
【解答】解:A、过氧化氢在二氧化锰的催化作用下生成水和氧气,硫在氧气中燃烧生成二氧化硫,故选项正确。
B、铜与硝酸银溶液反应生成硝酸铜溶液和银,银不能与稀盐酸反应,故选项错误。
C、酒精燃烧生成二氧化碳和水,二氧化碳与碳在常温下不反应,故选项错误。
D、铁与氧气、水反应生成铁锈,氧化铁与稀硫酸反应生成硫酸铁和水,故选项错误。
故选:A。
【点评】本题有一定难度,熟练掌握所涉及物质的性质、抓住关键词“能否一步实现”是解决此类问题的关键。
10.(2分)下列实验方法不能达到实验目的是( )
选项
实验的目的
实验方法
A
除去MnO2固体中的KCl
加水溶解,过滤,洗涤,干燥
B
鉴别化肥NH4Cl和KNO3
取少量化肥加入熟石灰粉末研磨,闻气味
C
配制质量分数为6%的NaCl溶液
称取3.0g NaCl,加入50.0mL水使之溶解
D
鉴定本地雨水是否为酸雨
用pH计测定雨水的pH
A.A、 B.B、 C.C、 D.D、
【分析】A、除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
B、根据两种物质与同种试剂反应产生的不同现象来鉴别它们,若两种物质与同种物质反应的现象相同,则无法鉴别它们。
C、根据溶质质量分数的计算方法,进行分析判断。
D、根据酸雨是pH小于5.6的雨水,进行分析判断。
【解答】解:A、KCl易溶于水,MnO2难溶于水,可采取加水溶解、过滤、洗涤、干燥的方法进行分离除杂,故选项实验方法能达到实验目的。
B、NH4Cl与熟石灰粉末研磨会产生有刺激性气味的气体,KNO3不能,可以鉴别,故选项实验方法能达到实验目的。
C、称取3.0g NaCl,加入50.0mL水使之溶解,得到的溶液的溶质质量分数为×100%<6%,故选项实验方法不能达到实验目的。
D、酸雨是pH小于5.6的雨水,用pH计测定雨水的pH,可以鉴定本地雨水是否为酸雨,故选项实验方法能达到实验目的。
故选:C。
【点评】本题难度不是很大,化学实验方案的设计是考查学生能力的主要类型,同时也是实验教与学难点,在具体解题时要对其原理透彻理解,可根据物质的物理性质和化学性质结合实验目的进行分析判断。
11.(2分)KC1和KNO3溶解度曲线如图所示。下列说法正确的是( )
A.10℃时,KNO3的溶解度比KCl的大
B.KNO3的溶解度受温度的影响比KCl的大
C.随着温度的升高,KCl的溶解度逐渐减小
D.40℃时KNO3的饱和溶液,升温至60℃时仍是饱和溶液(忽略水分挥发)
【分析】根据题目信息和溶解度曲线可知:KC1和KNO3两种固体物质的溶解度,都是随温度升高而增大,而硝酸钾的溶解度随温度的升高变化比氯化钾大;A、10℃时,KNO3的溶解度比KCl的大错误;B、KNO3的溶解度受温度的影响比KCl的大正确;C、随着温度的升高,KCl的溶解度逐渐减小错误;D、40℃时KNO3的饱和溶液,升温至60℃时仍是饱和溶液错误;
【解答】解:A、10℃时,KCl的溶解度大于硝酸钾,KNO3
的溶解度比KCl的大错误,故选项错误;
B、硝酸钾的溶解度随温度的升高变化比氯化钾大正确,故选项正确;
C、随着温度的升高,KCl的溶解度逐渐减小错误,因为KC1和KNO3两种固体物质的溶解度,都是随温度升高而增大的;故选项错误;
D、40℃时KNO3的饱和溶液,升温至60℃时变成不饱和溶液,仍是饱和溶液错误,故选项错误;
故选:B。
【点评】本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关饱和溶液和不饱和溶液的相互转化等,本考点主要出现在选择题和填空题中。
12.(2分)某白色固体A,含有K2SO4、NaOH、CaCO3、BaCl2中的一种或几种,取少量A进行实验( )
注:BaSO4难溶于盐酸;K2SO4、BaCl2的水溶液均呈中性。
据此实验可知,固体A中的物质最多有( )
A.1种 B.2种 C.3种 D.4种
【分析】根据碳酸钙难溶于水,和盐酸反应会生成二氧化碳,氢氧化钠显碱性,能使酚酞变红色,硫酸钾和氯化钡反应生成不溶于酸的硫酸钡沉淀等知识进行分析。
【解答】解:碳酸钙难溶于水,和盐酸反应会生成二氧化碳,氢氧化钠显碱性,能使酚酞变红色,硫酸钾和氯化钡反应生成不溶于酸的硫酸钡沉淀,
白色固体溶于水生成的白色沉淀中加入足量的盐酸,沉淀完全溶解,所以一定含有碳酸钙,无色溶液中加入酚酞变红色,一定含有氢氧化钠,氯化钡和硫酸钾只能含有其中的一种,所以固体A中的物质最多有三种物质,故选:C。
【点评】在解此类题时,首先分析题中所给物质的性质和两两之间的反应,然后依据题中的现象判断各物质的存在性,最后进行验证即可。
六、非选择题(本题包括4小题,共36分)
13.(6分)化学在促进社会发展,提高人类生活质量方面发挥着不可替代的作用。
(1)中国有过年吃饺子的习俗。制作饺子的原料有小麦粉、肉馅、蔬菜、植物油、调味剂等。
①小麦粉中富含的基本营养素是 糖类 。
②肉馅中的蛋白质是由多种 c (填字母)构成的极为复杂的化合物。
a.维生素 b.无机盐 c.氨基酸
③铁强化酱油是常用的调味剂,长期食用可以预防 b (填字母)。
a.骨质疏松 b.贫血 c.甲状腺肿大
(2)材料在生产、生活中应用广泛。
①下列物品中,由有机合成材料制成的是 a (填字母)。
②C919飞机机身蒙皮使用了铝锂合金材料。下列不属于铝锂合金性质的是 a (填字母)。
a.密度大
b.硬度高
c.抗腐蚀
(3)中国嫦娥四号月球探测器首次证实构成月幔的主要物质之一是Fe2SiO4.已知Fe2SiO4中硅元素的化合价为+4,则其中铁元素的化合价为 +2 。
【分析】(1)①根据小麦主要提供的营养元素为糖类分析;
②根据蛋白质是由多种氨基酸构成的分析;
③根据人体缺乏铁元素时易患贫血症分析;
(2)①根据有机合成材料包括:塑料、合成纤维、合成橡胶分析;
②根据合金的硬度大、熔点低、抗腐蚀性好分析;
(3)根据化合物中元素的 化合价之和为零结合化学式分析。
【解答】解:(1)①小麦主要提供的营养元素为糖类,故填:糖类;
②蛋白质是由多种氨基酸构成的,故选:c;
③在酱油中加入铁强化剂,可以为人体补充铁元素,从而防止贫血病,故选:b;
(2)①塑料油桶属于有机合成材料;纯棉帽子属于天然材料;碳纳米管属于无机材料;故选a;
②合金的优点为硬度大、熔点低、抗腐蚀性好,铝锂合金的密度小、硬度大、抗腐蚀,故选:a;
(3)Fe2SiO4中硅元素的化合价为+4,则设其中铁元素的化合价为x,根据化合物中元素的 化合价之和为零,得到2x+(+4)+(﹣2×4)=0,解得x=+2,故铁元素的化合价为+2,故填:+2。
【点评】本题考查的知识点贴近生活,是中考的热点之一,难度不大,明确相关的基础知识是解题的关键。
14.(10分)化学的基本特征是研究和创造物质。试从科学家认识物质的视角认识CO2。
(1)分类角度
CO2属于 b (填字母)
a.单质 b.氧化物 c.有机物
(2)微观角度
我国研制的一种新型催化剂可将CO2和H2转化为甲醇(CH3OH)和X.若用“O”表示氢原子,“”表示氧原子,“”表示碳原子,该反应的微观示意图如图:
画出X分子的微观示意图: (用0.5mm黑色墨水签字笔作答)。
(3)性质角度
三百多年前,人们发现一些洞穴内有一种能使燃烧的木柴熄灭的气体,后来该气体被证实是CO2.据此推测CO2具有的化学性质是 不燃烧不支持燃烧 。
(4)变化角度
如图是某同学整理的物质转化图;实验室中常用CO2→CaCO3检验CO2
气体,写出其化学反应方程式 Ca(OH)2+CO2=CaCO3↓+H2O
(5)应用角度
I.可用如图所示方法自制汽水来消暑解热
制汽水时,NaHHCO3与柠檬酸反应生成柠檬酸钠、二氧化碳和水。
①据此推测,通常条件下不能与柠檬酸反应的物质 b (填字母)。
a.镁带 b.氯化钠 c.烧碱
②打开汽水瓶盖时汽水会自动喷出来。说明气体在水中的溶解度与 压强 有关。
Ⅱ.Al﹣CO2电池是一种新型电池。
③电池的工作原理:在O2的催化下,Al与CO2发生化合反应生成Al2(C2O4)3.写出此反应的化学方程式 2Al+6CO2Al2(C2O4)3 。
(6)环保角度
全球参与控制CO2的排放量是防止温室效应进一步增强的根本对策。下列限制CO2排放量的做法不合理的是 c (填字母)。
a.制定旨在限制CO2排放的国际规定
b.减少化石能源的使用,开发太阳能等新能源
c.工厂通过加高烟囱直接排放含CO2的废气
【分析】(1)根据物质的组成分析;
(2)根据质量守恒定定律分析判断;
(3)根据实验的现象分析二氧化碳的性质;
(4)根据二氧化碳与氢氧化钙的反应写出反应的化学方程式;
(5)①根据酸的性质分析判断;
②根据实验的现象分析影响气体压强的因素;
③分析题干反应,写出反应的化学方程式;
(6)根据“低碳”的措施分析判断。
【解答】解:(1)CO2是由碳、氧两种元素组成的化合物,属于氧化物,
(2)由质量和守恒定律反应前后原子的种类及数目不变可知,X分子应是水分子,微观示意图为:。
(3)三百多年前,人们发现一些洞穴内有一种能使燃烧的木柴熄灭的气体,后来该气体被证实是CO2.据此推测CO2具有的化学性质是不燃烧不支持燃烧。
(4)实验室中常用CO2→CaCO3检验CO2气体,是二氧化碳与氢氧化钙反应,化学反应方程式是:Ca(OH)2+CO2=CaCO3↓+H2O。
(5)①柠檬酸是一种酸,由酸的性质和复分解反应的条件可知,柠檬酸能与镁和烧碱反应,不能与氯化钠反应;
②打开汽水瓶盖时汽水会自动喷出来。说明气体在水中的溶解度与压强有关。
③电池的工作原理:在O2的催化下,Al与CO2发生化合反应生成Al2(C2O4)3.此反应的化学方程式:2Al+6CO2Al2(C2O4)3。
(6)a、制定旨在限制CO2排放的国际规定,符合题意;
b、减少化石能源的使用,开发太阳能等新能源,符合题意
c.工厂通过加高烟囱直接排放含CO2的废气,不能减少二氧化碳的排放,不符合题意。
故答为:(1)b;(2);(3)不燃烧不支持燃烧;(4)Ca(OH)2+CO2=CaCO3↓+H2O;(5)①b;②压强;③2Al+6CO2Al2(C2O4)3.(6)c。
【点评】本题较为全面地考查了二氧化碳的知识,难度不大,了解二氧化碳的组成、性质、用途和低碳的措施等知识即可分析解答。
15.(8分)以镁矿石(主要成分MgCO3、SiO2)为原料生产MgO的工艺流程如图
注:SiO2难溶于水和常见的酸;“沉镁”过程中有Mg(OH)2生成。
(1)滤渣X的主要成分为 SiO2 (填化学式)。
(2)实验室中用图一所示装置进行过滤。
①该装置中仪器A的名称为 烧杯 。
②若过滤时滤液出现浑浊,可能的原因是 a (填字母)。
a.滤纸已破损 b.漏斗中液面低于滤纸边缘 c.滤纸未紧贴漏斗内壁
(3)“沉镁”时MgSO4与NH3•H2O发生反应。结合图二,写出该反应的化学方程式 MgSO4+2NH3•H2O=Mg(OH)2↓+(NH4)2SO4 。
(4)已知在不同温度下,充分加热等质量的Mg(OH)2,加热温度与固体残留率的关系如题图三所示。“加热”时温度至少要达到350℃,原因是 低于350℃是氢氧化镁不能完全分解,导致氧化镁不纯 。
【分析】根据给出的转化关系对应的过程分析每个对应的问题,或者直接分析每个问题,从给出的信息中找对应的信息。
【解答】解:
(1)SiO2难溶于水和常见的酸,所以滤渣X的主要成分的化学式为 SiO2。
(2)①该装置中仪器A的名称为烧杯。
②若过滤时滤液出现浑浊,给出的选择中只有滤纸破损才可能。故选:a。
(3)“沉镁”时MgSO4与NH3•H2O发生反应。结合图二,可知生成氢氧化镁和硫酸铵,对应的化学方程式为MgSO4+2NH3•H2O=Mg(OH)2↓+(NH4)2SO4。
(4)“加热”时温度至少要达到350℃,原因是 低于350℃
是氢氧化镁不能完全分解,导致氧化镁不纯。
故答案为:
(1)SiO2。
(2)
①烧杯。
②a。
(3)MgSO4+2NH3•H2O=Mg(OH)2↓+(NH4)2SO4。
(4)低于350℃是氢氧化镁不能完全分解,导致氧化镁不纯。
【点评】读图,从中获得解答题目所需的信息,所以在解答题目时先看解答的问题是什么,然后带着问题去读给出的图进而去寻找解答有用的信息,这样提高了信息捕捉的有效性。解答的问题实际上与复杂的转化图相比,其实很简单很基础,或者可以说转化图提供的是情境,考查基本知识。
16.(12分)NaOH是重要的化工原料,研究其制备、检验、贮存及应用具有重要意义。
(1)工业上常用电解饱和食盐水的方法制取NaOH,反应的化学方程式为2NaCl+2H2O2NaOH+Cl2↑+X↑.X的化学式为 H2 。
(2)为了探究NaOH样品中是否存在NaCl、Na2CO3杂质,设计如下实验方法
注:AgCl是白色固体,难溶于水和稀HNO3
①乙中有无色无味气体产生,证明样品中含有Na2CO3.产生气体的化学方程式为 2HNO3+Na2CO3=2NaNO3+CO2↑+H2O 。
②试剂X为 硝酸银 溶液;可证明NaCl存在的现象是 丙中产生了白色沉淀 。
(3)某兴趣小组试图通过测定生成的CO2质量,确定因久置而变质的NaOH固体中Na2CO3的质量分数,设计了图所示装置并进行如下实验:
步骤一:取一定质量的样品,加入气密性良好的锥形瓶中,然后在分液漏斗中加入足量的稀硫酸,称出装置总质量为m1。
步骤二:打开分液漏斗旋塞,逐滴加入稀硫酸,待气泡不再产生时,关闭旋塞,称出装置总质量为m2。
①球形干燥管中不用NaOH固体而用CaCl2固体的原因是 CaCl2不吸收二氧化碳NaOH吸收二氧化碳 。
②小明同学认为(m1﹣m2)即为生成的CO2质量,小红同学认为小明的想法不合理,理由是 生成的二氧化碳没有全部排出锥形瓶,导致(m1﹣m2)比实际生成的CO2质量偏小 。
(4)某工厂化验室用20%NaOH溶液洗涤一定量石油产品中残余H2SO4,共消耗NaOH溶液20g,洗涤后的溶液呈中性。这一定量石油产品中所含H2SO4的质量为 4.9g (写出计算过程,否则不得分)。
【分析】(1)根据质量守恒定律分析X的化学式;
(2)①根据碳酸钠与稀硝酸的反应写出反应的化学方程式;
②根据检验氯离子常用的试剂和现象分析回答;
(3)①根据NaOH、CaCl2的性质分析回答。
②根据锥形瓶内有残留的二氧化碳气体分析;
(4)根据氢氧化钠与稀硫酸的反应及氢氧化钠的质量计算硫酸的质量。
【解答】解:(1)由质量守恒定律反应前后原子的种类及数目不变可知,在反应的化学方程式为2NaCl+2H2O2NaOH+Cl2↑+X↑中。X的化学式为H2。
(2)①在乙中碳酸钠能与稀硝酸该反应生成了硝酸钠、水和二氧化碳,反应化学方程式为:2HNO3+Na2CO3=2NaNO3+CO2↑+H2O。
②为了检验氯离子,试剂X为硝酸银溶液;可证明NaCl存在的现象是丙中产生了白色沉淀。
(3)①球形干燥管中不用NaOH固体而用CaCl2固体的原因是:CaCl2
不吸收二氧化碳NaOH吸收二氧化碳。
②由于锥形瓶内有残留的二氧化碳气体,所以小明同学认为(m1﹣m2)即为生成的CO2质量,小红同学认为小明的想法不合理,理由是:生成的二氧化碳没有全部排出锥形瓶,导致(m1﹣m2)比实际生成的CO2质量偏小。
(4)设一定量石油产品中所含H2SO4的质量为x
2NaOH+H2SO4=Na2SO4+2H2O
80 98
20g×20% x
解得:x=4.9g。
故答为:(1)H2;(2)①2HNO3+Na2CO3=2NaNO3+CO2↑+H2O,②硝酸银,丙中产生了白色沉淀;(3)①CaCl2不吸收二氧化碳NaOH吸收二氧化碳;②生成的二氧化碳没有全部排出锥形瓶,导致(m1﹣m2)比实际生成的CO2质量偏小。(4)4.9。
【点评】本题考查了质量守恒定律、离子的检验气体的制取和方程式的计算,涉及的知识点较多,但难度不大,根据肴的知识分析解答即可。
声明:试题解析著作权属菁优网所有,未经书面同意,不得复制发布
日期:2019/6/25 17:47:24;用户:初中校园号;邮箱:wjwl@xyh.com;学号:24424282
相关文档
- 【2020年中考化学,含答案,word版,可再2021-11-0611页
- 2020年浙江省绍兴市中考化学试卷【2021-11-065页
- 2020年海南省中考化学试卷【含答案2021-11-065页
- 【2020年中考化学,含答案,word版,可再2021-11-0614页
- 【2020年中考化学,含答案,word版,可再2021-11-066页
- 山东省泰安市2012年中考化学试卷(含2021-11-0621页
- 2019年全国各地中考化学试题-山东2021-11-066页
- 2020年北京市中考化学试卷【含答案2021-11-067页
- 2020年山东省菏泽市中考化学试卷【2021-11-065页
- 2018年安徽省中考化学试卷(解析版)2021-11-068页