- 1.37 MB
- 2021-11-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
辽宁省锦州市2013年中考化学模拟试卷4
可能用到的相对原子质量:H—1 C—12 Cl-35.5 Zn-65 S-32 O-16
一、 选择题(本大题包括12道小题,共16分。其中1~8小题每小题1分,9~12小题每小题2分。每小题只有一个选项符合题意,请将符合题意选项前的字母填在下表内)
1.下列说法你认为错误的是( )
A.化学变化和化学反应是同一个概念
B.物质发生化学变化时一定同时发生物理变化
C.化学变化的特征就是一定会有沉淀生成
D.物质的性质决定了的变化,物质的变化反映了物质的性质
2.氢氧化镁可治疗胃酸过多:Mg(OH)2+2HCl═MgCl2+2H2O,该反应属于( )
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
3.下列事实与相应的解释不一致的是( )
A.50mL酒精与50mL水混合在一起,总体积小于100mL,因为分子有质量 B.浓盐酸敞口放置一段时间后质量变小,因为分子在不断的运动
C.气体易于压缩,因为构成气体的微粒间空隙较大
D.空气是混合物,因为它是由氮气、氧气、二氧化碳等多种物质组成
4.“海宝”是2010年上海世博会的吉祥物。某“海宝”玩具的外用材料为纯羊毛,内充物为聚酯纤维。区别这两种物质的最好方法是 ( )
A.燃烧法
B.摸手感
C.闻气味
D.是否溶于水
5.下列图标中,在商场、医院、车站等公共场所最常见的是( )
A. B.C. D.
6.正确和规范的化学实验操作是科学探究成败的关键因素之一.下列实验操作中正确的是( )
A.稀释浓硫酸 B.读出液体的体积 C.点燃酒精灯 D.过滤
7.钛铁矿主要成分的化学式为FeTiOx,其中铁元素和钛元素的化合价均显+3价.则x为( )
A.2 B.3
C.4 D.6
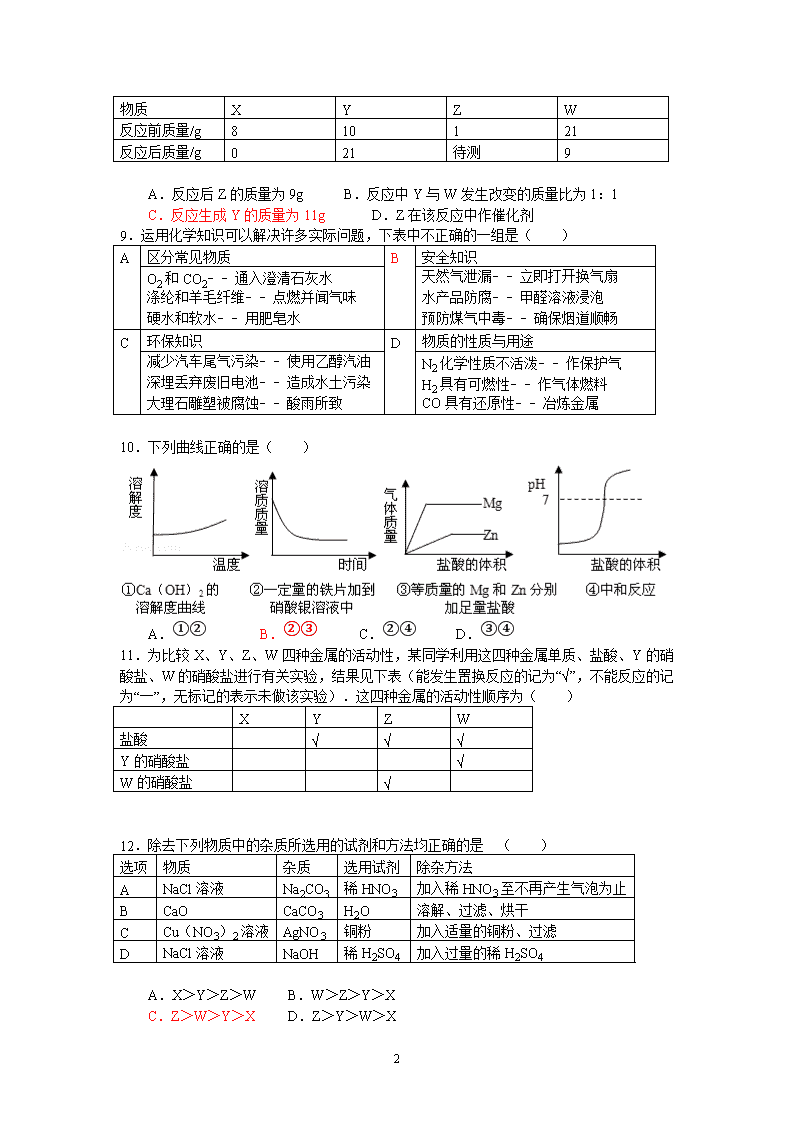
8.在一密闭容器中有X、Y、Z、W四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表所示.下列说法中正确的是
( )
7
物质
X
Y
Z
W
反应前质量/g
8
10
1
21
反应后质量/g
0
21
待测
9
A.反应后Z的质量为9g B.反应中Y与W发生改变的质量比为1:1
C.反应生成Y的质量为11g D.Z在该反应中作催化剂
9.运用化学知识可以解决许多实际问题,下表中不正确的一组是( )
A
区分常见物质
B
安全知识
O2和CO2﹣﹣通入澄清石灰水
涤纶和羊毛纤维﹣﹣点燃并闻气味
硬水和软水﹣﹣用肥皂水
天然气泄漏﹣﹣立即打开换气扇
水产品防腐﹣﹣甲醛溶液浸泡
预防煤气中毒﹣﹣确保烟道顺畅
C
环保知识
D
物质的性质与用途
减少汽车尾气污染﹣﹣使用乙醇汽油
深埋丢弃废旧电池﹣﹣造成水土污染
大理石雕塑被腐蚀﹣﹣酸雨所致
N2化学性质不活泼﹣﹣作保护气
H2具有可燃性﹣﹣作气体燃料
CO具有还原性﹣﹣冶炼金属
10.下列曲线正确的是( )
A.①② B.②③ C.②④ D.③④
11.为比较X、Y、Z、W四种金属的活动性,某同学利用这四种金属单质、盐酸、Y的硝酸盐、W的硝酸盐进行有关实验,结果见下表(能发生置换反应的记为“√”,不能反应的记为“一”,无标记的表示未做该实验).这四种金属的活动性顺序为( )
X
Y
Z
W
盐酸
√
√
√
Y的硝酸盐
√
W的硝酸盐
√
12.除去下列物质中的杂质所选用的试剂和方法均正确的是 ( )
选项
物质
杂质
选用试剂
除杂方法
A
NaCl溶液
Na2CO3
稀HNO3
加入稀HNO3至不再产生气泡为止
B
CaO
CaCO3
H2O
溶解、过滤、烘干
C
Cu(NO3)2溶液
AgNO3
铜粉
加入适量的铜粉、过滤
D
NaCl溶液
NaOH
稀H2SO4
加入过量的稀H2SO4
A.X>Y>Z>W B.W>Z>Y>X
C.Z>W>Y>X D.Z>Y>W>X
7
二、 填空题(本大题包括5道小题,每空1分,共18分)
13.( 3 分)用化学用语填空:
2
8
1
+11
(1) ①2个氧分子 ;②3个氢离子
(2)某粒子的结构示意图为 它的电子数为
(1)①2O2 ②3H+ (2)11
14.(4分)氢气、氧气、二氧化碳和一氧化碳是初中化学中的常见物质,下图是它们的一些具体应用。
A.碳酸饮料 B.高炉炼铁 C.干冰 D.燃料燃烧
这些物质中:
(1)可作制冷剂,用于人工降雨的物质是(填物质名称或化学式,下同) 。
(2)可以用于制作碳酸饮料的物质是 ,其中发生的化学方程式为 。
(3)高炉炼铁中一氧化碳还原氧化铁的化学方程式为 。
(4)可用作燃料的物质是 。
(1)干冰(或CO2)
高温
(2)CO2 CO2 + H2O == H2CO3
(3)3CO + Fe2O3 ==== 2Fe + 3CO2 (高温、加热都给分)
(4)CO、H2 (缺一不给分)
15.(4分)人们可以对物质从不同的角度进行分类。请根据示例将酒精、醋酸、水、食盐四种物质进行分类,并写出分类依据。
不同类的物质
分 类 依 据
示 例
食 盐
常温下食盐是固体,其余是液体
分类一
分类二
【解析】此题考查对物质从不同的角度进行分类,关键是抓住物质的特性。
【答案】
不同类的物质
分类依据
分类一
水
水是氧化物,其余不是氧化物
7
分类二
醋酸
醋酸是酸,其余的不是酸
16.(6分)请根据要求填空:
(1)一氧化碳和二氧化碳只有一字之差。
①二者就像孪生兄弟,这是因为 (填字母),
A.它们都有毒 B.它们由同种分子构成
C.它们都能溶于水 D.它们由同种元素组成
②二者化学性质相差甚远,请举一例说明: 。
③在密闭容器中,将少量乙醇置于一定量氧气中燃烧,生成二氧化碳、水蒸气和一种未知物质W。现测得反应前后各物质的质量如下:
物质
乙醇
氧气
二氧化碳
水蒸气
W
反应前质量/g
48
80
0
0
0
反应后质量/g
2
0
44
54
x
根据质量守恒定律,得出表中x的值为 ;
(2)下面是钠元素和氯元素在元素周期表中的信息和3种粒子的结构示意图。请回答下列问题:
11 Na
钠
22.99
17 Cl
氯
35.45
钠原子的相对原子质量是 ;钠元素与氯元素最本质的区别是 。
Na+的结构示意图是 (填字母)。
(1)①D ②一氧化碳有毒 二氧化碳无毒(合理给分) ③28
(2)22.99 质子数不同 A
三、 简答题(本大题包括4道小题,共18分)
17.(4分)用化学方程式解释下列问题:
(1)铝具有良好的抗腐蚀的性能,其原理是___________________________________;
(2)氢氧化钠露置在空气中会变质,其原理是_________________________________;
(3)食品包装袋内常用生石灰作干燥剂,其原理是_____________________________;
(4)在焊接金属时,常用稀盐酸除去铁制品表面的铁锈,其原理是_____________________________。
(1)4Al+3O2=2Al2O3(2)2NaOH+CO2=Na2CO3+H2O (3)CaO+ H2O =Ca(OH)2 (4)Fe2O3+6HCl==2FeCl3+3H2O
18.(4分)右图是A、B两种物质的溶解度曲线,
请回答:
(1)t3℃时,把46g固体A放入100g水中,充分溶解后可得到A的 溶液(填“饱和”或“不饱和”)。
(2)t1℃时,A、B两种物质溶解度的大小关系为A B(填“>”、“<”或“=”,下同)。
(3)在其他条件不变的情况下,若把tl℃时A、B
的饱和溶液分别升温至t2℃,此时两种溶液中溶质的质量分数的大小关系为A B:若把t3℃时A、B的饱和溶液分别降温至t2℃
7
,此时两种溶液中溶质的质量分数的大小关系为A B。
(1)不饱和,(2)﹤,(3)﹤,=:
碳酸钠粉末
盐酸
19.(4分)已知:Na2CO3+2HCl = 2NaCl+H2O+CO2↑,
某同学按右图装置对质量守恒定律进行实验探
究,开始天平平衡,将试管中盐酸倒入烧杯中
反应后观察天平不平衡,你认为该反应是否遵
守质量守恒定律(填“遵守”或“不遵守”)
。托盘不平衡的原因是
。
如何改进实验,使实验数据能真实反映质量守恒定律
。
遵守 实验在敞口的容器中进行,生成的二氧化碳气体逸出,没有收集称量,所以,反应前后质量不相等 将烧杯改用锥形瓶,并在瓶口系一个气球。(其它答案合理也可)
20.(6分)A-G是初中常见的物质。其中E为黑色固体。下图为这些物质的转化关系图,其中部分生成物和反应条件已省略。
A
高温
B
C
H2O
D
E
Na2CO3
F
G
H2SO4
CO
蓝色沉淀
(1)写出下列物质的化学式:E ,G 。
(2)化学反应常伴有能量变化。B与水反应时会 (“吸收”或“放出”)热量。
(3)实验室不用A与稀硫酸反应来制取C,原因是
。
(4)写出D→F的化学方程式 。
(5)可用Cu、O2和H2SO4作原料制得CuSO4,反应的过程是:
(用文字表述)。
(1)CuO CuSO4 (2)放出
(3)生成的CaSO4微溶于水,包在CaCO3表面,阻止反应继续进行
(4)Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
(5)先用Cu与O2反应生成CuO,再用CuO与稀H2SO4反应即得CuSO4。
四、 实验题(本大题包括4道小题,共20分)
21.(5分)回答下列问题:
(1)实验室配制100g 10%的氯化钠溶液时,需要 g氯化钠固体。
①称量时如果用质量为23.1g的烧杯盛放固体,在托盘天平上已放30g的砝码,则天平上的游码位置应是右图的
(填字母)。
②下列仪器中,量取水时需要用
到d和 仪器(填序号),溶解时需要用到e和 仪器(填序号)。
a.烧杯、b.10mL量筒、c.100mL量筒、d.滴管、e.玻璃棒、f.药匙、g.蒸发皿。
7
(2)在粗盐提纯中,将氯化钠溶液蒸发至有较多量固体析出后,应 ,并用玻棒不断搅拌,利用余热将余下溶液蒸发至干。
(1)10 ① B ② c a (2)停止加热(或熄灭酒精灯)
22.(5分)同学们一起探究铝、铁、铜三种金属的活动性,小刚同学设计了用铜丝、铁丝、铝丝和稀盐酸,只用一只试管,取一次盐酸的探究方案。请你和他们一起完善下表的探究方案并回答有关问题。
(1)填表
实验步骤
观察到的现象
① 在试管中取少量盐酸,插入铁丝,充分作用。
② 在①所得的溶液中,插入 ,充分作用。
无明显现象
③ 在②所得的溶液中插入 ,充分作用。
结论:金属活动性Al > Fe > Cu
(2)小华同学认为在小刚设计的方案中,只要补充一个实验,就可得出Al>Fe>H>Cu的结论。小华要补充的实验是 ;
(1)产生气泡,溶液由无色变为浅绿色; 铜丝; 铝丝 溶液由浅绿色变为无色
(2)把铜丝插入稀盐酸中
23.(5分)根据下列装置图,回答有关问题:
浓硫酸
①
A B C D E F
(1)写出装置图中标号仪器的名称:① ;② 。
(2)写出实验室用大理石和稀盐酸制取二氧化碳的化学方程式:
并据此选择上图中 (填字母)组装一套制取干燥二氧化碳的装置。
(3)如选用装置A作为制取氧气的发生装置,其化学方程式可以为
21.(本题共5分,每空1分)
(1)①试管 ②集气瓶
(2)CaCO3+2HCl=CaCl2++CO2↑ BFC
(3)2KClO3==2KCl+3O2↑ (合理答案均给分)
24.(5分)小煜通过学习知道:Na2CO3、NaHCO3均能与盐酸反应,Na2CO3溶液还会与石灰水反应。
【产生疑问】NaHCO3溶液也能与石灰水反应吗?如果能反应,生成物可能是什么?
【进行实验】小煜将NaHCO3溶液与石灰水混合,结果产生了白色沉淀。已知Ca(HCO3)2能溶于水,碳酸氢盐在碱溶液中会生成碳酸盐。此白色沉淀是 ,证明NaHCO3溶液与Ca(OH)2 溶液也能发生反应。为了进一步了解生成的含钠化合物有什么,继续探究:
7
【作出猜想】①只有NaOH;②Na2CO3和NaOH;③
【实验设计】步骤1:取少量上述实验后的上层清液于试管中,再滴加足量的CaCl2 溶液(中性),观察到产生白色沉淀,由此可知生成的含钠化合物中一定含有 ;
步骤2:将步骤1中后应后的混合物过滤,往滤液中先滴加几滴无色酚酞溶液,再滴加足量的稀盐酸,观察到溶液颜色变化情况为 ,整个实验过程中无气泡产生,由此可知猜想②成立。
【拓展提高】若步骤1中未出现白色沉淀,则此时NaHCO3溶液与Ca(OH)2 溶液反应的化学方程式为 。
【进行实验】CaCO3(或碳酸钙)【作出猜想】只有Na2CO3 【实验设计】Na2CO3 溶液由无色变成红色,然后红色变成无色(2分,写对才得分)【拓展提高】Ca(OH)2 +NaHCO3= CaCO3 ↓+ NaOH+ H2O
五、 计算题(本大题包括2道小题,共8分)
25.橡皮是必不可缺少的文具。现在普遍使用的塑料橡皮,主要以氯乙烯基树脂为原料。氯乙烯基树脂是由氯乙烯单体(C2H3Cl)聚合而成,这种小粒子有着很好的附着性和黏着性,因而清洁效果好。
(1)C2H3Cl中碳、氢、氯元素的原子个数比是C:H:Cl =
(2)通过计算求C2H3Cl中碳元素的质量分数。
(1)2:3: (2)C2H3Cl中碳元素的质量分数:C%=24/62、5×100% =38、4%(0、384)
26. )26g黄铜(Cu-Zn合金)与100g稀硫酸在烧杯中恰好完全反应,反应后测得烧杯中剩余物的总质量为125.8克。求:⑴黄铜中铜的质量分数;⑵反应后所得溶液中溶质质量分数。(计算结果精确到0.1%)
解:氢气的质量为0.2克。
设锌的质量为X,
Zn+ H2SO4 = ZnSO4+ H2↑
65 161 2
X Y 0.2g
65:X=2:0.2g X=6.5g
161:Y=2:0.2g Y=16.1g
黄铜中铜的质量分数:×100%=75%
反应后所得溶液中溶质质量分数:×100%=15.1%
答:黄铜中铜的质量分数为75% 反应后所得溶液中溶质质量分数为15.1%
7