- 607.00 KB
- 2021-11-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第5章 金属的冶炼与利用
整理和应用
一、选择题
(2017·哈尔滨市)6.下列实验现象记录正确的是( )
A.把铜丝放入硫酸铝溶液中,紫红色固体表面产生银白色固体,溶液变成蓝色
B.向氢氧化钾溶液中滴入氯化铁溶液.有浅绿色沉淀生成
C.将一氧化碳通入灼热的氧化铁.红棕色粉末逐渐变为黑色粉末
D.将燃着的木炭伸入到氧气中,产生白色火焰,放出热量
【答案】C
二、填空题
三、实验题
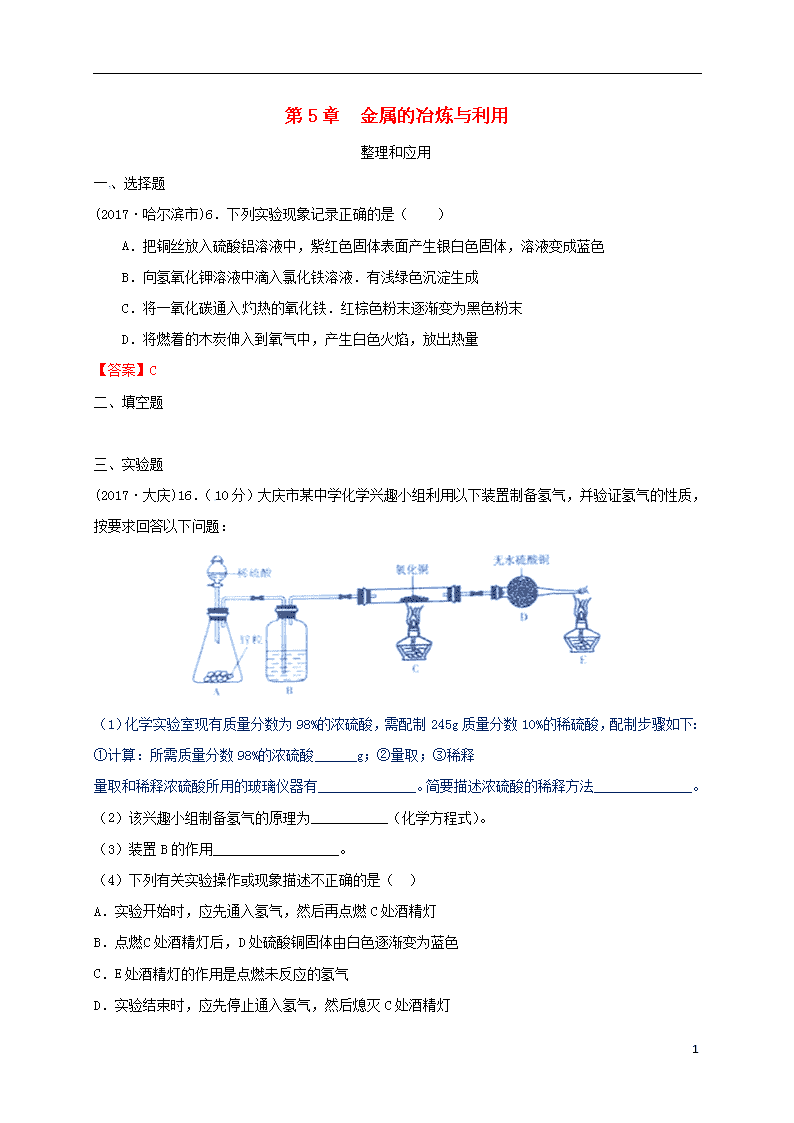
(2017·大庆)16.(10分)大庆市某中学化学兴趣小组利用以下装置制备氢气,并验证氢气的性质,按要求回答以下问题:
(1)化学实验室现有质量分数为98%的浓硫酸,需配制245g质量分数10%的稀硫酸,配制步骤如下:
①计算:所需质量分数98%的浓硫酸______g;②量取;③稀释
量取和稀释浓硫酸所用的玻璃仪器有______________。简要描述浓硫酸的稀释方法______________。
(2)该兴趣小组制备氢气的原理为___________(化学方程式)。
(3)装置B的作用__________________。
(4)下列有关实验操作或现象描述不正确的是( )
A.实验开始时,应先通入氢气,然后再点燃C处酒精灯
B.点燃C处酒精灯后,D处硫酸铜固体由白色逐渐变为蓝色
C.E处酒精灯的作用是点燃未反应的氢气
D.实验结束时,应先停止通入氢气,然后熄灭C处酒精灯
4
(5)实验结束后,发现部分氧化铜未被还原,已知反应前氧化铜质量为a克,反应结束后混合固体质量为b克,则被氢气还原的氧化铜的质量为___________g。
答案:16.(1)① 25 量筒,烧杯,玻璃棒 将浓硫酸沿烧杯壁缓慢地注入水中,用玻璃棒不断搅动。
(2)Zn+H2SO4=ZnSO4+H2↑ (3)吸收气体中的水蒸气 (4)D (5)5(a-b)
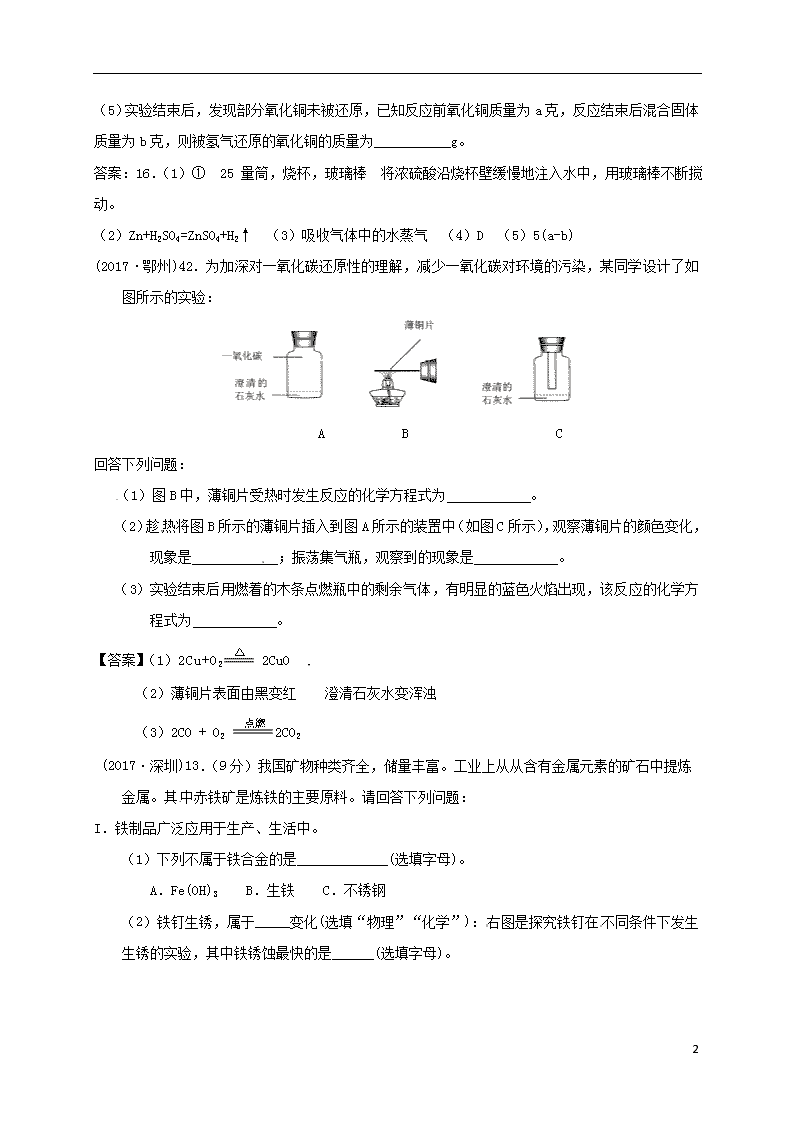
(2017·鄂州)42.为加深对一氧化碳还原性的理解,减少一氧化碳对环境的污染,某同学设计了如图所示的实验:
A B C
回答下列问题:
(1)图B中,薄铜片受热时发生反应的化学方程式为 。
(2)趁热将图B所示的薄铜片插入到图A所示的装置中(如图C所示),观察薄铜片的颜色变化,现象是 ;振荡集气瓶,观察到的现象是 。
(3)实验结束后用燃着的木条点燃瓶中的剩余气体,有明显的蓝色火焰出现,该反应的化学方程式为 。
【答案】(1)2Cu+O2 2CuO
(2)薄铜片表面由黑变红 澄清石灰水变浑浊
(3)2CO + O2 2CO2
(2017·深圳)13.(9分)我国矿物种类齐全,储量丰富。工业上从从含有金属元素的矿石中提炼金属。其中赤铁矿是炼铁的主要原料。请回答下列问题:
I.铁制品广泛应用于生产、生活中。
(1)下列不属于铁合金的是_____________(选填字母)。
A.Fe(OH)3 B.生铁 C.不锈钢
(2)铁钉生锈,属于_____变化(选填“物理”“化学”):右图是探究铁钉在不同条件下发生生锈的实验,其中铁锈蚀最快的是______(选填字母)。
4
II.赤铁矿(主要成分为Fe2O3)可用于生产催化剂。
(3)在Fe2O3中,氧元素的质量分数为_____________。
(4)赤铁矿经提纯后得到的纯净Fe2O3可用于生产某种工业催化剂(主要成分为FeO和Fe2O3),其反应原理为:2 Fe2O3+C4FeO+CO2↑。现将焦炭和过量的Fe2O3混合均匀,按上述原理充分反应,右图为固体混合物的质量随反应时间的变化曲线。
①由图可知:生成CO2气体的质量为_____g。
②计算反应后固体混合物中FeO的质量分数(请根据化学方程式写出完整的计算步骤)。
【答案】(1)A;(2)化学;B;(3)30%;(4)①1.1;②36%。
四、计算题
(2017·大庆)18.铝合金是目前广泛使用的合金材料,已知某铝合金由Al、Fe、Cu三种金属构成,为了测定各种金属含量,取12.5g合金样品与盐酸反应,消耗浓盐酸(质量分数36.5%)100g。另取12.5g合金样品与氢氧化钠溶液反应,消耗含氢氧化钠12g的溶液40mL。
已知:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,Fe,Cu均不与氢氧化钠溶液反应。
请问:(1)12.5g样品中含铝多少克?
(2)铜在合金中所占的质量分数是多少?
答案:18.(1)含铝8.1g (2)铜占12.8%
(2017·哈尔滨市)35.(5分)某钢铁厂实验室为测定赤铁矿中Fe2O3的含量,将矿石粉碎(其中杂质既不溶于水也不与酸反应),进行如下实验:
请回答下列问题:
(1)上述实验过程中发生反应的化学方程式为__________________________________;
(2)样品中Fe2O3的质量分数是_______;
4
(3)根据已知条件列出求解200g稀硫酸中溶质质量(x)的比例式___________________;
(4)若向最终滤液中加入16g水,所得不饱和溶液中溶质的质量分数为_________;
(5)该钢铁厂每天用上述赤铁矿石1900t来生产生铁。则理论上日产含杂质5%的生铁的质量为_________。
【答案】
4