- 316.50 KB
- 2021-11-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第2课时 一定溶质质量分数的氯化钠溶液的配制
知能演练提升
能力提升
1.小红在配制50 g 5%的氯化钠溶液时,进行了以下操作,其中会导致溶液中氯化钠的质量分数大于5%的是( )
A.用量筒量取水时俯视读数
B.在称量前,指针稍向左偏移便进行称量
C.装瓶时部分溶液洒出
D.溶解时烧杯中已有少量水
★2.如果所配6%的氯化钠溶液中溶质质量分数偏小,其原因是( )
A.称取的氯化钠固体质量偏大
B.转移称量好的氯化钠固体时,有少量撒落在桌面上
C.量取水的体积偏小
D.转移配制好的溶液时,有少量液体溅出
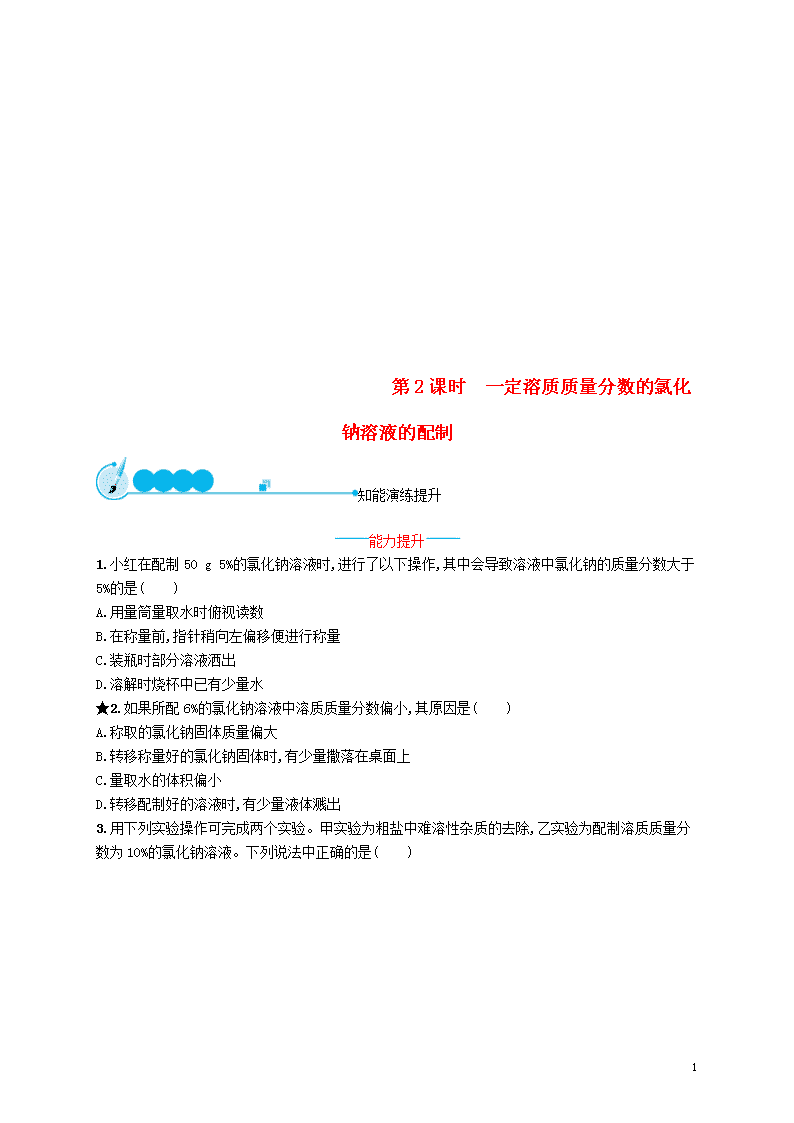
3.用下列实验操作可完成两个实验。甲实验为粗盐中难溶性杂质的去除,乙实验为配制溶质质量分数为10%的氯化钠溶液。下列说法中正确的是( )
4
A.甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发
B.甲实验各步操作中,玻璃棒的作用都是相同的
C.乙实验若按照②③①的步骤进行操作,则配制的溶液浓度偏大(ρ水=1 g/cm3)
D.乙实验中,若①所用的烧杯内壁沾有水,对配制的溶液浓度无影响
4.某同学在配制50 g溶质的质量分数为5%的食盐溶液的过程中,称量时将砝码放在左盘(1 g以下用游码),食盐放在右盘;量水时仰视液面读数。这样配制的食盐溶液中食盐的质量分数( )
A.等于5% B.大于5%
C.小于5% D.不能确定
5.要配制100 g质量分数为5%的氢氧化钠溶液,下列说法正确的是( )
A.实验中要用到的玻璃仪器只有烧杯和玻璃棒
B.称量氢氧化钠固体时应该将砝码放在左盘,药品放在右盘
C.配制好的氢氧化钠溶液中溶质和溶剂的质量之比为1∶20
D.称量时,必须将氢氧化钠固体放在玻璃器皿中称量
6.实验室要配制100 g溶质质量分数为15%的硝酸钾溶液。
(1)配制溶液需完成计算、称量、 三个步骤。
(2)下列因素会导致所得溶液中溶质质量分数偏小的有 。
A.硝酸钾中有杂质
B.称量时使用了生锈的砝码
C.用量筒量取水时,仰视读数
D.配制完成后移取液体时有部分溅出
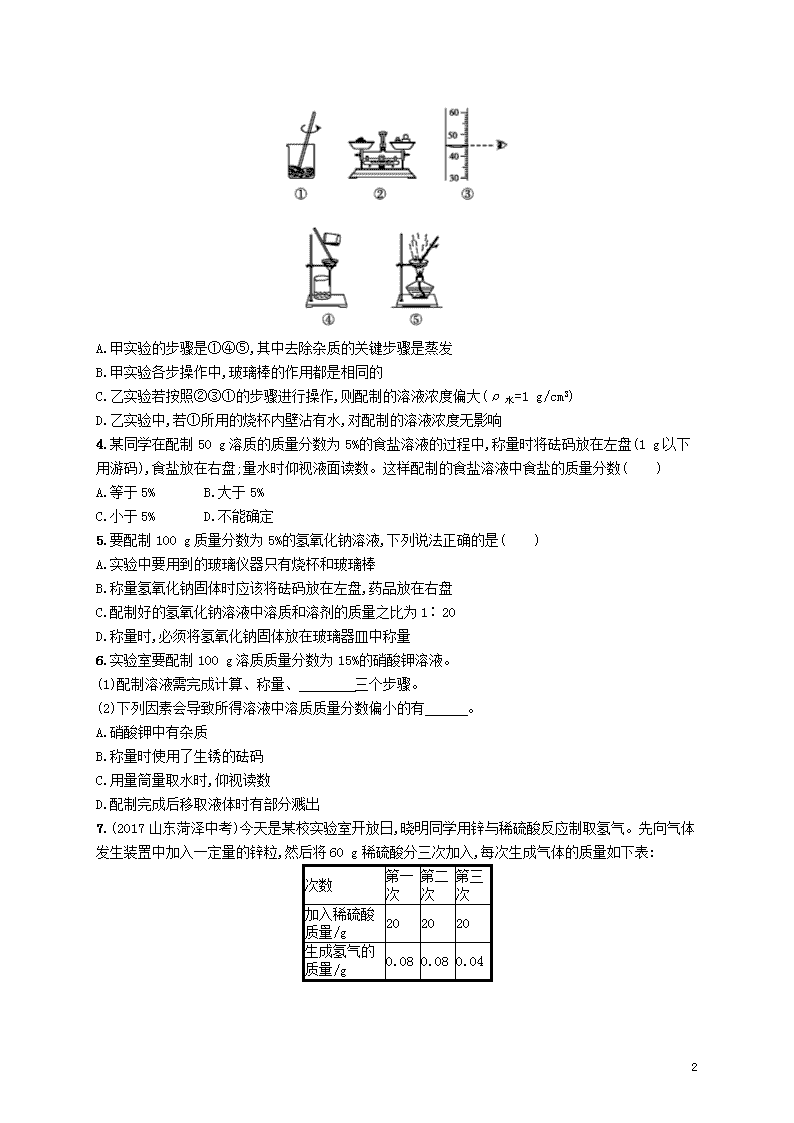
7.(2017山东菏泽中考)今天是某校实验室开放日,晓明同学用锌与稀硫酸反应制取氢气。先向气体发生装置中加入一定量的锌粒,然后将60 g稀硫酸分三次加入,每次生成气体的质量如下表:
次数
第一次
第二次
第三次
加入稀硫酸质量/g
20
20
20
生成氢气的质量/g
0.08
0.08
0.04
4
试计算:
(1)共制得氢气 g。
(2)实验所用稀硫酸中溶质的质量分数。(写出计算过程)
探究创新
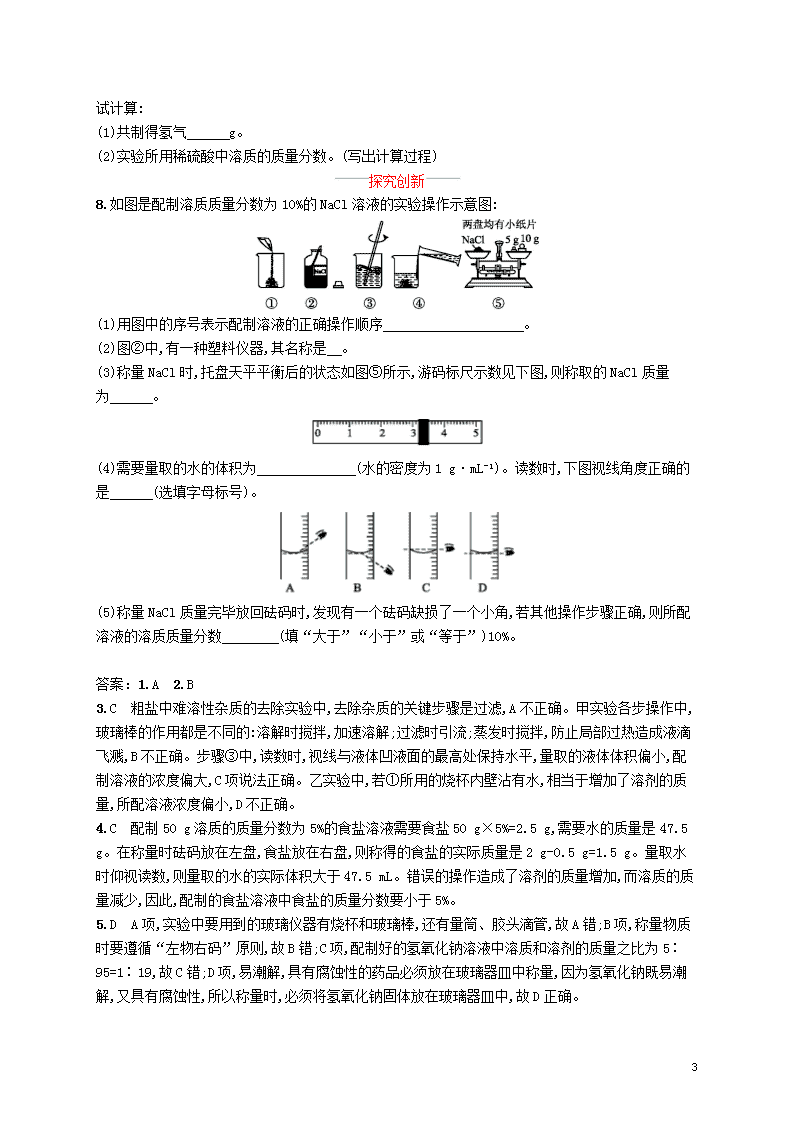
8.如图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图:
(1)用图中的序号表示配制溶液的正确操作顺序 。
(2)图②中,有一种塑料仪器,其名称是 。
(3)称量NaCl时,托盘天平平衡后的状态如图⑤所示,游码标尺示数见下图,则称取的NaCl质量为 。
(4)需要量取的水的体积为 (水的密度为1 g·mL-1)。读数时,下图视线角度正确的是 (选填字母标号)。
(5)称量NaCl质量完毕放回砝码时,发现有一个砝码缺损了一个小角,若其他操作步骤正确,则所配溶液的溶质质量分数 (填“大于”“小于”或“等于”)10%。
答案:1.A 2.B
3.C 粗盐中难溶性杂质的去除实验中,去除杂质的关键步骤是过滤,A不正确。甲实验各步操作中,玻璃棒的作用都是不同的:溶解时搅拌,加速溶解;过滤时引流;蒸发时搅拌,防止局部过热造成液滴飞溅,B不正确。步骤③中,读数时,视线与液体凹液面的最高处保持水平,量取的液体体积偏小,配制溶液的浓度偏大,C项说法正确。乙实验中,若①所用的烧杯内壁沾有水,相当于增加了溶剂的质量,所配溶液浓度偏小,D不正确。
4.C 配制50 g溶质的质量分数为5%的食盐溶液需要食盐50 g×5%=2.5 g,需要水的质量是47.5 g。在称量时砝码放在左盘,食盐放在右盘,则称得的食盐的实际质量是2 g-0.5 g=1.5 g。量取水时仰视读数,则量取的水的实际体积大于47.5 mL。错误的操作造成了溶剂的质量增加,而溶质的质量减少,因此,配制的食盐溶液中食盐的质量分数要小于5%。
5.D A项,实验中要用到的玻璃仪器有烧杯和玻璃棒,还有量筒、胶头滴管,故A错;B项,称量物质时要遵循“左物右码”原则,故B错;C项,配制好的氢氧化钠溶液中溶质和溶剂的质量之比为5∶95=1∶19,故C错;D项,易潮解,具有腐蚀性的药品必须放在玻璃器皿中称量,因为氢氧化钠既易潮解,又具有腐蚀性,所以称量时,必须将氢氧化钠固体放在玻璃器皿中,故D正确。
4
6.答案 (1)溶解
(2)AC
7.答案 (1)0.2
(2)解:设20 g稀硫酸中所含有的硫酸质量为x。
Zn+H2SO4ZnSO4+H2↑
98 2
x 0.08 g
x=3.92 g
所用稀硫酸的质量分数=×100%=19.6%
答:实验所用稀硫酸中溶质的质量分数为19.6%。
8.解析 (1)配制一定溶质质量分数的溶液的步骤:计算、称量、溶解,计算得到所需NaCl的质量和水的体积后,我们首先称取NaCl,步骤为②⑤①,然后量取水,步骤为④,最后溶解,步骤为③。(2)在图②所示仪器中,药匙为塑料仪器。(3)砝码的质量为15 g,游码的质量为3.2 g,则称取的NaCl的质量为15 g+3.2 g=18.2 g。(4)要将18.2 g NaCl配制成10%的溶液,需要水的体积为=163.8 mL。量取液体时,眼睛的视线要与凹液面的最低处保持水平,故D正确。(5)若砝码缺损了一个小角,则称量的NaCl质量偏小,会导致所配溶液溶质的质量分数小于10%。
答案 (1)②⑤①④③
(2)药匙
(3)18.2 g
(4)163.8 mL D
(5)小于
4