- 165.00 KB
- 2021-11-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
实验活动4 金属的物理性质和某些化学性质
01 实验报告
【实验目的】
1.巩固和加深对金属性质的认识。
2.培养实验设计能力。
【实验用品】
试管、试管夹、酒精灯、坩埚钳、电池、导线、小灯泡、火柴、开关。
镁条、锌粒、铝片、铁片、铜片、黄铜片、稀盐酸、稀硫酸、硫酸铜溶液、硝酸银溶液。
【实验步骤】
1.金属的物理性质
(1)观察并描述金属的颜色和光泽:镁__银白色__、铝__银白色__、铁__银白色__、铜__紫红色__,金属都具有__金属光泽__。
(2)用相互刻画的方法比较铜片和铝片、铜片和黄铜片的硬度,可以得出金属的硬度比其相应合金的__小__。
(3)设计实验验证金属具有的物理性质:
验证的性质
设计方案
导电性
把铜片接入连有小灯泡和电池的电路中,闭合开关,灯泡发光
导热性
把一小段铁片放在酒精灯上加热,感觉到铁片烫手
延展性
捶打铝片,可以观察到铝片变薄
2.金属的化学性质
(1)金属与氧气的反应:用坩埚钳夹取一块铜片,放在酒精灯火焰上加热,可看到__紫红色的铜表面变黑__,反应的化学方程式为__2Cu+O22CuO__。
(2)金属与稀酸的反应:
镁条
铝片
锌粒
铁片
铜片
与稀硫酸反应的现象
剧烈反应,产生大量气泡,镁条浮于表面
剧烈反应,产生大量气泡
剧烈反应,产生大量气泡,反应比铝片慢
能产生气泡,反应较慢,溶液由无色逐渐变为浅绿色
不
反
应
反应的化学方程式
Mg+
H2SO4===MgSO4+H2↑
2Al+
3H2SO4===Al2(SO4)3+3H2↑
Zn+
H2SO4===ZnSO4+H2↑
Fe+
H2SO4===FeSO4+
H2↑
(3)比较铁、铜、银的金属活动性强弱:
实验步骤
现象
结论
向2支试管中各放入一小块打磨光亮的铜片,然后分别加入少量的硫酸亚铁溶液和硝酸银溶液,观察现象
放入硫酸亚铁溶液中的铜片无变化,放入硝酸银溶液中的铜片表面产生银白色物质,溶液由无色变为蓝色
金属的活动性顺序:__Fe>Cu>Ag__
【问题与交流】
铁是银白色金属,而铁粉是黑色的,为什么?
因为粉末状态下疏松多孔,吸收可见光,反射能力较差,所以看起来是黑色的。
【反思、拓展与评价】
教师或小组评价:________________________________________________________________________
________________________________________________________________________。
02 实验习题
3
1.下列有关金属的说法中,错误的是(B)
A.铜质插头是利用铜的导电性
B.钨制灯丝是利用钨的熔点低
C.铝制成铝箔是利用铝的延展性
D.用铁锅炒菜是利用铁的导热性
2.(2018·岳阳)甲、乙、丙、丁四种金属,只有丙在自然界中主要以单质形式存在,用甲制的容器不能盛放丁的化合物溶液,用乙制的容器却可以盛放丁的化合物溶液。由此推断四种金属的活动性由强到弱的顺序是(B)
A.丙>乙>甲>丁 B.甲>丁>乙>丙
C.丁>甲>乙>丙 D.甲>乙>丁>丙
3.下列有关金属的叙述中,正确的是(A)
A.硬铝、不锈钢都是合金,合金比成分金属具有更优良的性能
B.铝、铁、铜都是银白色固体,都能导电
C.镁、铝都是活泼金属,相同质量时与足量的盐酸反应放出氢气的体积相同
D.铁在空气中燃烧,冒出浓烈的黑烟,放出热量,生成黑色粉末
4.(2018·安顺)“愚人金”实为铜锌合金,外观与黄金极为相似,常被不法商贩冒充黄金牟取暴利。下列关于鉴别“愚人金”与黄金的实验方案,合理的是(D)
①比较硬度,硬度小的是“愚人金”
②灼烧,表面变色的是“愚人金”
③浸没在稀硫酸中,表面有气泡产生的是“愚人金”
④浸没在硫酸锌溶液中,表面附着白色物质的是“愚人金”
A.①③ B.②④
C.①④ D.②③
5.(2017·益阳)铝、铁、铜三种金属与我们的生活密切相关,下列关于铝、铁、铜的说法错误的是(A)
A.铝与硫酸铜溶液反应的化学方程式为Al+CuSO4===AlSO4+Cu
B.用硫酸铝溶液、氯化铜溶液、单质铁三种物质可探究出三种金属活动性顺序
C.铝制品具有抗腐蚀性,是因为铝制器品表面可形成致密的氧化物薄膜
D.我国历史上最早使用的金属是铜
6.(2018·广东)利用稀盐酸和硝酸银探究铁、铜、银的金属活动性顺序,下列实验可以不需要进行的是(C)
A.铁+稀盐酸 B.铜+稀盐酸
C.银+稀盐酸 D.铜+硝酸银溶液
7.质量相等的镁和铝分别和等浓度、等质量的稀盐酸反应,反应情况如图所示。则下列叙述中正确的是(B)
A.金属均反应完,一定有盐酸剩余
B.反应结束后,参加反应的镁和铝的质量比为4∶3
C.盐酸均反应完,一定有镁剩余
D.图中a、b分别表示铝、镁的反应情况
8.(2017·菏泽)2017年5月5日,我国国产大型客机C919在上海浦东机场首飞成功,标志着我国航空事业有了最大突破。结合所学知识回答下列问题:
(1)大型客机大量使用了铝锂合金、钛合金等,其原因是合金比纯金属具有__更高的强度、硬度和更好的抗腐蚀性__。
(2)空气中,铝比铁具有更好的抗腐蚀性。原因是__铝与空气中的氧气反应形成一层致密的氧化膜,阻止了铝的进一步氧化__(用文字叙述)。
(3)已知金属M和N能够发生如下反应:Fe+MCl2===M+FeCl2,N+FeCl2===Fe+NCl2,判断Fe、M、N三种金属的活动性由强到弱的顺序是__N>Fe>M__。
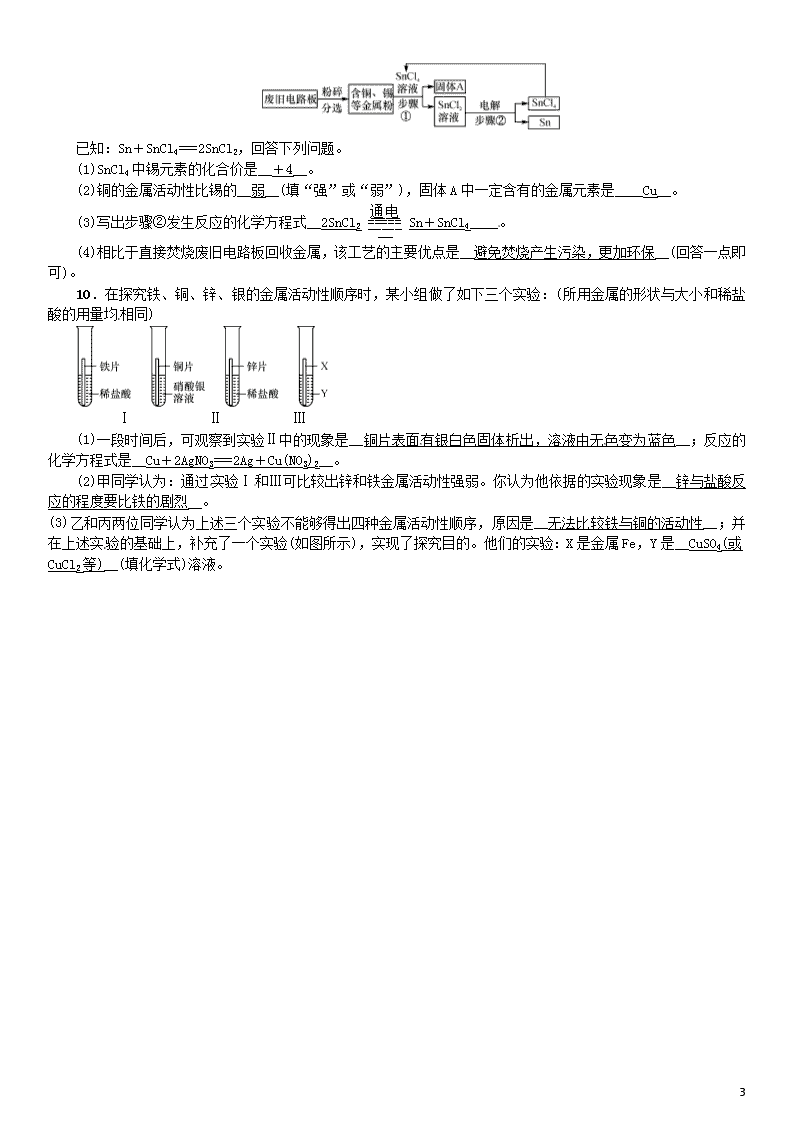
9. (2018·安徽)废旧电路板中主要含有塑料、铜和锡(Sn)等,为实现对其中锡的绿色回收,某工艺流程如下。
3
已知:Sn+SnCl4===2SnCl2,回答下列问题。
(1)SnCl4中锡元素的化合价是__+4__。
(2)铜的金属活动性比锡的__弱__(填“强”或“弱”),固体A中一定含有的金属元素是____Cu__。
(3)写出步骤②发生反应的化学方程式__2SnCl2Sn+SnCl4____。
(4)相比于直接焚烧废旧电路板回收金属,该工艺的主要优点是__避免焚烧产生污染,更加环保__(回答一点即可)。
10.在探究铁、铜、锌、银的金属活动性顺序时,某小组做了如下三个实验:(所用金属的形状与大小和稀盐酸的用量均相同)
Ⅰ Ⅱ Ⅲ
(1)一段时间后,可观察到实验Ⅱ中的现象是__铜片表面有银白色固体析出,溶液由无色变为蓝色__;反应的化学方程式是__Cu+2AgNO3===2Ag+Cu(NO3)2__。
(2)甲同学认为:通过实验Ⅰ和Ⅲ可比较出锌和铁金属活动性强弱。你认为他依据的实验现象是__锌与盐酸反应的程度要比铁的剧烈__。
(3)乙和丙两位同学认为上述三个实验不能够得出四种金属活动性顺序,原因是__无法比较铁与铜的活动性__;并在上述实验的基础上,补充了一个实验(如图所示),实现了探究目的。他们的实验:X是金属Fe,Y是__CuSO4(或CuCl2等)__(填化学式)溶液。
3
相关文档
- 2018年浙江省初中学业水平考试(金2021-11-1010页
- 2020年初中记事类文章写作指导2021-11-1027页
- 初中化学九年级上册第一单元走进化2021-11-1020页
- 新人教版初中化学课后达标训练9-2-2021-11-1011页
- 山东省聊城市2019年初中学生学业水2021-11-1013页
- 初中语文文言文必背篇目:邹忌讽齐王2021-11-102页
- 沪科版初中物理九年级全册第18章电2021-11-106页
- 【教材梳理+中考夺分】初中数学中2021-11-1028页
- 初中物理中考复习单元复习课件PPT2021-11-1051页
- 初中化学真题汇编化学实验基本操作2021-11-1022页