- 1.12 MB
- 2021-11-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
广东省中山市2013年初中化学竞赛试题
考试时间: 9:30----11:30
l 竞赛时间2小时。迟到超过半小时者不能进考场。开始考试后1小时内不得离场。时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
l 试卷装订成册,不得拆散。所有解答(包括选择题)必须写在答题卡指定的方框内,不得用铅笔填写。
l 姓名、考生号和所属学校必须写在答题卡首页左侧指定位置,写在其他地方者按废卷论处。
可能用到的原子量
Na
Mg
Ca
Ba
Cu
N
H
C
S
O
23
24
40
137
64
14
1
12
32
16
一、选择题(15题×2分=30分,每题有1到2个正确选项,选对得2分,错选得0分,漏选得1分)
1、18世纪时,通过实验得出空气是由氮气和氧气组成的结论的科学家是
A.瑞典化学家舍勒 B.英国化学家普利斯特里
C.法国化学家拉瓦锡 D.意大利科学家阿伏伽德罗
2、 某新产品磨牙器能有效帮助去除牙齿表面的牙垢,磨牙器磨头采用50%橡胶与50%的金刚砂(主要成
分为碳化硅)特制而成。已知碳化硅中碳元素显-4价,硅元素显+4价,则碳化硅的化学式为
A.SiC B.Si2C3 C.Si3C2 D.SiC2
3、实验表明,不能用块状大理石与稀硫酸制取CO2气体,而能用大理石粉末与稀硫酸制取CO2气体。由此
得出的合理结论是
A.能发生反应的物质之间是否发生反应,与反应条件有关
B.反应物之间接触面积越大,越有利于反应的进行
C.块状大理石与大理石粉末的化学性质不同
D.块状大理石与大理石粉末中各元素原子间的结合状况不同
4、 已知:NaHCO3 + HCl = NaCl + H2O + CO2↑。某种混合气体中可能含有N2、HCl、 CO,将混合气体
依次通过NaHCO3溶液和灼热的CuO,气体体积无变化但是有红色物质生成;再通过NaOH溶液,气
体体积明显减小;将燃着的木条伸入装有剩余气体的集气瓶中,木条熄灭(假设每步反应都是完全的),
则下列说法中正确的是
A.一定有CO和HCl,肯定无N2 B.一定有CO和N2,可能有HCl
C.一定有CO和HCl,可能有N2 D.一定有CO和N2,肯定无HCl
5、氯气和氧气都是活泼的非金属单质,在一定条件下它们都能跟甲烷反应。已知O2与CH4 充分反应后
的生成物是CO2和H2O,以此类推,Cl2和CH4充分反应后的生成物是
A.CCl4和HCl B.CCl4和Cl2
C.CH2Cl2和H2 D.C和HCl
6、已知NaHS、MgSO4和NaHSO3由组成的混合物中硫元素的质量分数为a%,则氧元素的质量分数为
A.1.75a% B.1.25a% C.1-1.75a% D.无法计算
7、科学家用单个分子制成了“纳米车”,它能在人工操纵下运输药物分子到病源处释放以杀死癌细胞。下列
有关“纳米车”的说法正确的是
A.“纳米车”的研制成功说明分子要在人为外力作用下才能运动
B.“纳米车”分子不是由原子构成的
C.“纳米车”运输药物分子的过程是肉眼不能直接看见的
D.“纳米车”研制成功说明在一定条件下人可以控制分子运动
9
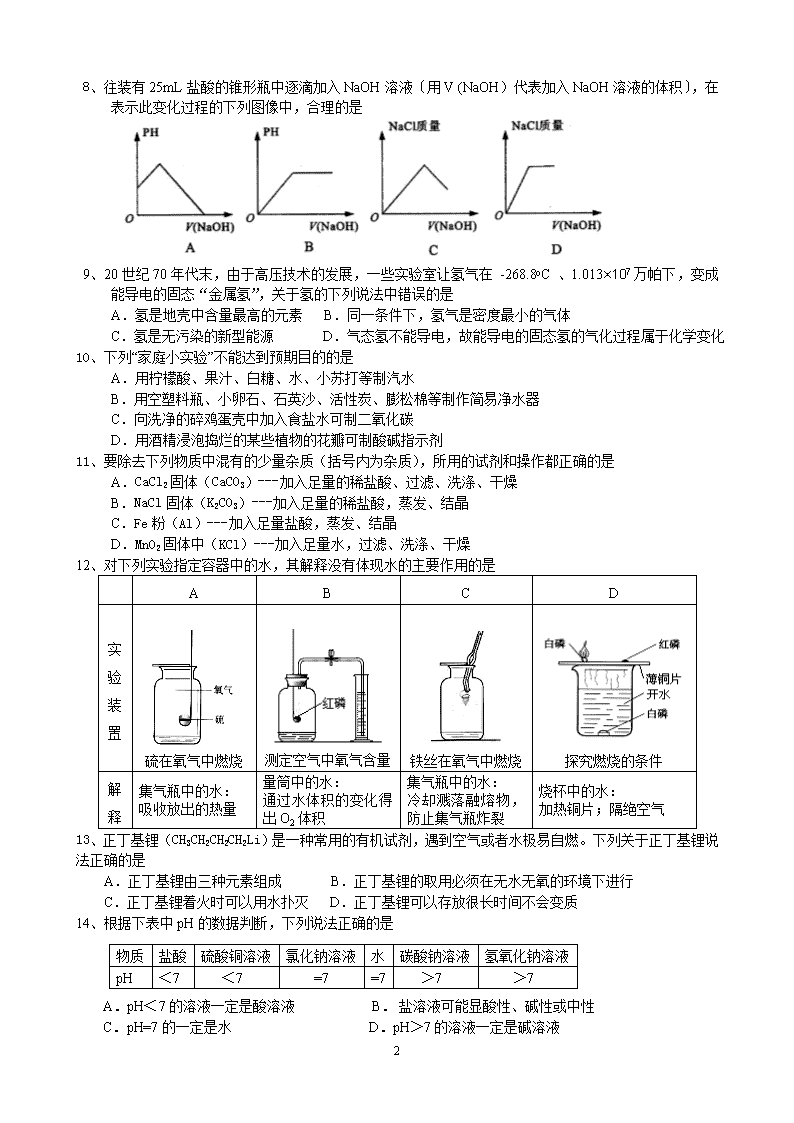
8、往装有25mL盐酸的锥形瓶中逐滴加入NaOH溶液〔用V (NaOH)代表加入NaOH溶液的体积〕,在表示此变化过程的下列图像中,合理的是
9、20世纪70年代末,由于高压技术的发展,一些实验室让氢气在 -268.8oC 、1.013×107万帕下,变成能导电的固态“金属氢”,关于氢的下列说法中错误的是
A.氢是地壳中含量最高的元素 B.同一条件下,氢气是密度最小的气体
C.氢是无污染的新型能源 D.气态氢不能导电,故能导电的固态氢的气化过程属于化学变化
10、下列“家庭小实验”不能达到预期目的的是
A.用柠檬酸、果汁、白糖、水、小苏打等制汽水
B.用空塑料瓶、小卵石、石英沙、活性炭、膨松棉等制作简易净水器
C.向洗净的碎鸡蛋壳中加入食盐水可制二氧化碳
D.用酒精浸泡捣烂的某些植物的花瓣可制酸碱指示剂
11、要除去下列物质中混有的少量杂质(括号内为杂质),所用的试剂和操作都正确的是
A.CaCl2固体(CaCO3)---加入足量的稀盐酸、过滤、洗涤、干燥
B.NaCl固体(K2CO3)---加入足量的稀盐酸,蒸发、结晶
C.Fe粉(Al)---加入足量盐酸,蒸发、结晶
D.MnO2固体中(KCl)---加入足量水,过滤、洗涤、干燥
12、对下列实验指定容器中的水,其解释没有体现水的主要作用的是
A
B
C
D
实
验
装
置
硫在氧气中燃烧
测定空气中氧气含量
铁丝在氧气中燃烧
探究燃烧的条件
解释
集气瓶中的水:
吸收放出的热量
量筒中的水:
通过水体积的变化得出O2体积
集气瓶中的水:
冷却溅落融熔物,防止集气瓶炸裂
烧杯中的水:
加热铜片;隔绝空气
13、正丁基锂(CH3CH2CH2CH2Li)是一种常用的有机试剂,遇到空气或者水极易自燃。下列关于正丁基锂说法正确的是
A.正丁基锂由三种元素组成 B.正丁基锂的取用必须在无水无氧的环境下进行
C.正丁基锂着火时可以用水扑灭 D.正丁基锂可以存放很长时间不会变质
14、根据下表中pH的数据判断,下列说法正确的是
物质
盐酸
硫酸铜溶液
氯化钠溶液
水
碳酸钠溶液
氢氧化钠溶液
pH
<7
<7
=7
=7
>7
>7
A.pH<7的溶液一定是酸溶液 B. 盐溶液可能显酸性、碱性或中性
C.pH=7的一定是水 D.pH>7的溶液一定是碱溶液
9
15、对下列各主题知识的整理完全正确的是
二、填空题(39分)
16、(4分)中山市倡导“135”出行,即1公里以内步行,3公里以内骑自行车,5公里乘坐公共交通工具,提倡“低碳城市”、“绿色出行”。回答下列问题:
(1)“低碳城市”的建设减少了 (填化学式)气体的排放,能减缓气候变暖的速率。
(2)法国化学家PaulSabatier采用“组合转化”技术使CO2和H2在催化剂作用下生成CH4和H2O。试写出该反应的化学方程式 。
(3)请你写出一种日常生活中符合“低碳经济”理念的做法: 。
17、(4分)铁元素在化合物中常显+2、+3价,Fe3O4按照氧化物的形式可表示为FeO•Fe2O3;铅元素常见化合价为+2、+4价。
(1)试对Pb3O4用上述形式表示组成,其氧化物的形式应为( )
A.PbO•Pb2O3 B.2PbO•PbO2 C.Pb•2PbO2 D.Pb(PbO2)2
(2)根据Fe3O4氧化物的形式可表示为FeO•Fe2O3,试写出Fe3O4与盐酸发生反应的化学方程式
____________________________________________________________________________________
18、(7分)汽车给人们生活带来巨大便利的同时也带来了严重的空气污染;汽车发动机是将空气与汽油(设汽油主要成分为:C8H18)以一定的比例混合成良好的混合气,被吸入汽缸,经压缩后由高压放电点火燃烧而产生热能,高温高压的气体作用于活塞顶部,推动活塞作往复运动,从而产生动力,发动机再将燃烧后的废气排出;经过研究发现,汽车尾气中含有NO、CO等有害气体。试着回答下列问题:
(1) 尾气中的NO是在发动机中高压放电或者高温的时候经过化合反应产生,试写出该反应的方程式:_______________________________________________________
CO是由汽油不完全燃烧产生的,试写出该反应可能的方程式:__________________________________
(2) 汽车尾气中的CO在四氧化三钴(Co3O4)纳米棒的催化作用下,低温即与O2反应生成CO2.下列关于该反应的说法中,不正确的是( )
A.反应类型为化合反应 B.可降低汽车尾气对大气的污染
C.反应前后Co3O4质量改变 D.反应前后碳元素的化合价改变
(3)汽车尾气中的NO可以在催化剂的作用下,使CO与NO发生化学反应,生成一种单质和一种化合物,其中单质为组成大气最多的一种成分,试写出该反应的化学方程式:________________________________
19、(4分)有机物的命名与它的组成相关(如下表所示),
则C3H8的名称为 ;丁烷的化学式为 。
名称
甲烷
乙烷
丁烷
戊烷
化学式
CH4
C2H6
C3H8
C5H12
20、(4分)某种炸药的化学式为C8N8O16,是迄今为止最烈性的非核爆炸品之一,爆炸生成两种非常稳
定的气体。
(1)该炸药C、N、O三种元素质量之比为: 。
9
(2)写出它的爆炸反应方程式: 。
21、(6分)侯德榜是在中国化学工业史上一位杰出的科学家,他为祖国的化学工业事业奋斗终生,并以独创的制碱工艺闻名于世界,以下是侯德榜先生制碱工业的简要流程:
下表是四种物质在100g水中不同温度的溶解度,其中NH4HCO3水溶液呈碱性,性质不稳定,36℃时开始分解为二氧化碳、氨和水,60℃可以分解完。
试回答下列问题:
(1)IV的反应条件是加热,请尝试写出IV的反应方程式:
(2)Ⅲ的操作名称叫 。
(3)通过上述溶解度表,如何从含有少量NaCl的NH4Cl溶液中获得NH4Cl晶体:
22、(10分)金属钛(Ti)因为有神奇的性能越来越引起人们的关注,钛是航空、军工、电力等领域的重要的原材料。地壳中的含钛矿石之一是金红石(TiO2),是冶炼钛的重要原料。
【钛的性质】:①常温下,钛既不与常见非金属单质反应、也不和强酸反应;
②加热时,却可以和常见的非金属单质反应。
(1)目前大规模生产钛的方法是(流程如上图所示):
第一步:使TiO2与C混合,在高温条件下反应,再通入Cl2,制得TiCl4和一种可燃性气体X。请根据反应物、生成物前后的变化,推测X的化学式: 。
第二步:在氩气的气流中,高温下用过量的Mg和TiCl4发生置换反应制得钛。写出此反应的化学方程式:___________________________________________;过程中氩气的作用:____________________________。
(2)上述反应制得的金属钛往往会混有另外一种金属单质杂质,该杂质为:______________;可以用何种试剂除去______________(填试剂名称)。
9
三、实验题(17分)
23、(9分)Na2CO3溶液显碱性,CuSO4溶液与Na2CO3溶液混合产生蓝绿色沉淀,以下是某兴趣小组对沉淀组成的探究。
【提出假设】
假设1:沉淀为Cu (OH)2
假设2:沉淀为
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3·mCu (OH)2]
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【物质成分探究】
步骤1:将所得悬浊液过滤,洗涤滤渣后晾干;
步骤2:甲同学取一定量上述蓝绿色固体,用如下装置(气密性良好)进行定性实验;
已知: nCuCO3·mCu (OH)2 受热易分解,生成CuO、CO2、H2O。
蓝绿色固体
碱石灰
K
A
B
C
D
无水CaCl2
澄清石灰水
N2
(1)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设 成立。
(2)乙同学认为只要将上图中B装置的试剂改用下列某试剂后,仅凭肉眼观察到的现象便可验证上
述所有假设,该试剂是 (填代号)。
A.浓硫酸 B.无水CuSO4 C.碱石灰 D.P2O5
(3)乙同学验证假设3成立的实验现象是 。
【物质含量探究】
(4) 乙同学进一步探究假设3中固体的组成,用上述装置进行实验:
若所取蓝绿色固体样品质量为54.2 g置于A装置中,实验结束后装置B的质量增加5.4 g,C中的
产生沉淀的质量为20g。则该蓝绿色固体的化学式为 ;
24、(8分)某兴趣小组对Zn、Ni( 镍)、Cu的金属活动性顺序展开了探究。
【提出假设】对三种金属的活动性顺序提出可能的假设①Zn >Ni>Cu;②Zn >Cu >Ni;你觉得还有其他的可能性吗?请任写一种假设:③__________________________
【查阅资料】小红同学查阅了部分含镍化合物的溶解性如下表,且得知镍能与酸反应。
OH-
NO3-
SO42-
Cl-
Ni2+
不溶
可溶
可溶
可溶
【设计实验】同温下,取大小、厚度相同的这三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,观
察现象。
【记录现象】请帮助小红用实验现象填写完整下表:
Ni
Zn
Cu
与盐酸反应的现象
气体产生缓慢
金属逐渐溶解
气体产生激烈
金属迅速溶解
【得出结论】原假设中正确的是____________________(填序号)。
9
写出镍与盐酸反应的化学方程式___________________________________ ;
【结论应用】
根据以上实验结果,请选择另一类别的一种试剂设计实验,也同样达到一次验证上述假设的正确与否,写出你选择试剂的化学式___________________.
五、计算题(14分)
25、(7分)有一瓶Na2CO3和Na2SO4的药品混合物,某同学欲测定该药品Na2SO4的纯度,进行如下分析:取试样x g,用适量的蒸馏水配成溶液,加入足量的BaCl2溶液使沉淀完全。滤出的沉淀经洗涤、干燥后,质量为 y g。将沉淀用足量盐酸洗涤后过滤,取沉淀洗涤、干燥得到z g固体。
(1)y的取值范围为 。(用含有x的式子表示)
(2)求Na2SO4的质量分数。
26、(7分)广州--中山--珠海城际轻轨的开通大大促进了沿线城市经济的发展。石灰石是主要修路材料之一。某兴趣小组用修路材料石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他们决定利用该废液,测定这瓶Na2CO3溶液中溶质的质量分数。他们将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如下图所示。
(1)在加入Na2CO3溶液的过程中,开始时没有发现沉淀生成,说明滤液中的溶质除含有CaCl2外,还含有______________________;
(2)计算Na2CO3溶液中溶质的质量分数。(计算结果精确到0.1%)
9
广东省中山市2013年初中化学竞赛答题卡
一、选择题(15题×2分=30分,每题有1到2个正确选项,选对得2分,错选得0分,漏选得1分)
1
2
3
4
5
6
7
8
9
10
C
A
AB
B
A
C
CD
D
AD
C
11
12
13
14
15
D
A
AB
B
D
二、填空题(39分)
16:
(1)、CO2 (1分);
(2)(2分)
(3)提倡骑自行车、步行、乘公交等(1分、其他合理答案同样给分)
17:
(1)、B (2分)
(2)、Fe3O4+8HCl=2FeCl3+FeCl2(2分)
18:
4、 、
(每个2分)
催化剂
(2)、 C (1分);
2CO + 2NO = 2CO2 + N2(2分)
19:
(1)、丙烷(2分);
(2)、C4H10(2分)。
9
20:
(1)、6:7:16(2分);
(2)、C8N8O16 = 8CO2+4N2(2分)。
Δ
21:
(1)、2NaHCO3=Na2CO3+H2O+CO2↑(2分);
(2)、过滤(1分);
(3)、蒸发浓缩、冷却结晶、过滤(3分);
22:
(1)、X的化学式为CO(2分)_;
Mg和TiCl4发生反应的化学方程式:2Mg + TiCl4 = Ti + 2MgCl2(2分)_;
过程中氩气的作用:保护气,防止TI与氧气等非金属单质反应(2分);
(2)、杂质为:Mg(2分);除杂试剂为:HCl(2分)。
三、实验题(17分)
23:(9分)
【提出假设】假设2:沉淀为CuCO3(2分);
(1)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设 (1分)成立;
(2),该试剂是B(1分)(填代号);
(3)实验现象是:B中固体变蓝;C中溶液变浑浊。(2分);
(4)该蓝绿色固体的化学式为:2CuCO3·3Cu (OH)2 (3分) 。
24:(8分)
【提出假设】③ Ni>Zn>Cu (2分);
【记录现象】Cu的实验现象:无气泡产生 或者 铜片不反应 或者 无现象(1分);
【得出结论】原假设中正确的是 ① (1分);(填序号)
写出镍与盐酸反应的化学方程式 Ni + 2HCl =NiCl2 + H2↑( 2分) _;
【结论应用】
根据以上实验结果,请选择另一类别的一种试剂设计实验,也同样达到一次验证上述假
设的正确与否,写出你选择试剂的化学式Ni(NO3)2 或NiSO4或NiCl2(2分);
四、计算题(14分)
9
25:
(1) 、
;(3分)
(2)、在下面写出计算过程
BaCl2 + Na2SO4 = 2NaCl + BaSO4↓
142 233
142Z/233 Z 2分
W%=142z/233xⅹ% 2分
26:
(1)、 HCl ;2分
(2)、在下面写出计算过程
分析图意,(25 g-5 g) Na2CO3溶液与氯化钙溶液全部反应,生成5 g碳酸钙沉淀(1分)
设:20gNa2CO3溶液中溶质的质量为x
Na2CO3+CaCl2= CaCO3↓+2NaCl (1分)
106 100
x 5g
106:100=x:5g x=5.3g (2分)
该Na2CO3溶液中溶质的质量分数为×100%=26.5% (1分)
9