- 360.00 KB
- 2021-11-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
建湖实验初中2011~2012学年度九年级第二学期期中试卷
化 学
(本卷满分:70分 考试时间:60分钟)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Cl-35.5 K-39 Ca-40
一、选择题(本题包括15小题,每小题2分,共30分。每小题只有一个选项符合题意, 请将各小题的选项(A、B、C、D)涂在答题卡上)
1.下列成语中属于化学变化的是
A.烛炬成灰 B.花香四溢 C.滴水成冰 D.木已成舟
2.下列性质属于化学性质的是
A.溶解性 B.挥发性 C.金属活动性 D.硬度
3.某校正在创建无烟型校园,你认为在校园内应张贴的标志是
4. 生活中下列做法正确的是
A.食用甲醛溶液浸泡的海鲜产品有利健康
B.用“破皮鞋制成的工业明胶”来生产老酸奶和果冻
C.在饲料中掺入“瘦肉精”,可提高猪肉的瘦肉率
D.为了缓解化石能源短缺和保护环境,开发利用氢能、太阳能等清洁能源
5.在实验操作考查中,小明抽到的题目是“二氧化碳的制取、收集和验满”。下图是他的
主要实验步骤,其中操作有误的是
6.善于归纳知识,利于培养素质。小林同学整理的下列内容有错误的是
A.除杂的方法
B.化学物质中的“三”
粗盐提纯——溶解、过滤、蒸发
木炭粉中混有铁粉——用磁铁吸引
CO2中混有CO——点燃
三大化石燃料——煤、天然气、石油
三种还原剂——C、H2、CO
三种可燃性气体——CO、H2、CH4
C.安全常识
D.化学与生活
①厨房煤气管漏气--关闭阀门并开窗通风
②实验时碰倒酒精灯着火--用湿抹布盖灭
③冬天用煤炉取暖--保证室内通风
①人体缺铁会引起贫血症
②多吃水果蔬菜利于补充维生素
③用活性炭净水器可净化饮用水
7.下列是小远同学在家里设计的“家庭小实验”方案,其中可行的是
A.用氯化钠溶液浸泡树叶,制作“叶脉书签” B.用淬火后的钢针做成鱼钩
C.用铜丝和食醋制取氢气 D.用报纸与保鲜膜对比,研究保鲜膜保鲜原因
8. 右图是三种微粒的结构示意图,有关它们的说法正确的是
A.它们属于同种元素的微粒
B.它们原子的电子层不完全相同
C.它们原子的最外层电子数相同
5
D. 它们都是离子
9.有些年轻人喜欢染发,染发一般要用到一种着色剂——对苯二胺(C6H8N2),是一种有毒的化学药品,有致癌性,会对染发者的身体带来伤害。下列有关苯二胺的说法不合理是
A.对苯二胺的相对分子质量为108 B.对苯二胺中碳、氢、氮元素的质量比为3:4:1
C.对苯二胺中碳元素的质量分数为66.7% D.对苯二胺能被皮肤少量吸收
10.在CuC12和FeC12的混合溶液中,加入一定量的锌粉,充分反应后过滤,向滤渣加稀盐酸,有气体生成,则滤渣中一定含有
A.Cu和Fe B. Fe和Zn C.Zn和Cu D.Cu、Fe和Zn
11.下列说法正确的是
A.从元素周期表中可以获取元素名称、原子序数、相对原子质量等信息
B.升高温度或增大压强均可以加大气体在水中的溶解度
C.将200g质量分数为10%的氯化钠溶液稀释到5%,需要加水100g
D.硝酸铵溶解于水,溶液温度降低,说明该物质溶解时只有扩散吸热过程
12.下列关于“不一定”的说法中,不正确的是
A.含氧化合物不一定是氧化物 B.质子数相等的粒子不一定是同种元素
C.由分子构成的纯净物不一定只含一种分子 D.由同种元素组成的物质不一定是单质
13.根据右图所示的溶解度曲线,判断下列说法中正确的是
A.甲物质的溶解度小于乙物质的溶解度
B.t2℃时,甲物质的饱和溶液和乙物质的饱和溶液中含有
溶质的质量相等
C.将t3℃时的甲、乙两物质的饱和溶液降温到t2℃时析出
晶体的质量甲大于乙
D.当甲物质中混有少量乙物质时,可采用降温结晶的方法提纯甲
14.密闭容器内有M、N、P、Q四种物质,一定条件下反应一段时间后,测得密闭容器内仍然是M、N、P、Q四种物质。反应前和反应一段时间后各物质的质量见下表:
物质
M
N
P
Q
反应前质量(g)
16.8
8.4
23.6
1.6
一段时间后质量(g)
待测
14
13.6
6
下列说法正确的是( )
A.该反应类型属置换反应 B.物质P一定是化合物
C.反应生成的N与Q的质量比为7:3 D.M肯定为该反应的催化剂
15.有一种不纯的k2CO 3固体,可能含有Na2CO3、MgCO3、NaCl中的一种或两种,取该品6.9g加入50g稀盐酸,恰好完全反应,得到无色溶液,同时产生气体2.2g.下列判断正确的是
A.样品中可能含有NaCl B.稀盐酸溶质的质量分数是7.3%
C.样品中一定含有MgCO3 D.样品中肯定不含有Na2CO3
二、非选择题(本题包括4小题,除化学方程式每空2分外,其它每空1分,19题写计算过程3分,共40分)
16. (6分) (1)从H、C、O、N、Ca四种元素中,选择元素填写符合要求的化学式(各写一个):
①最常见的溶剂 ▲ ②具有还原性的气态氧化物 ▲
③常用来改良酸性土壤的碱 ▲ ④汽水中的酸 ▲
⑤可用作补钙剂的盐 ▲ ⑥不含金属元素的盐 ▲
(4分)(2)天然水受到污染后,净化时需要运用科学的方法。
①天然水污染的来源有 ▲ (写出一种即可);保持水的化学性质的最小粒子是 ▲ 。
②高铁酸钾(K2Fe04
5
)是一种集氧化、吸附、凝聚、杀菌、灭藻的新型、高效的多功能水处理剂,高铁酸钾中铁元素的化合价为 ▲ ;完成高铁酸钾与水反应的化学方程式:4K2FeO4+ 10H2O == 4Fe(OH)3↓+8KOH+ 3 ▲
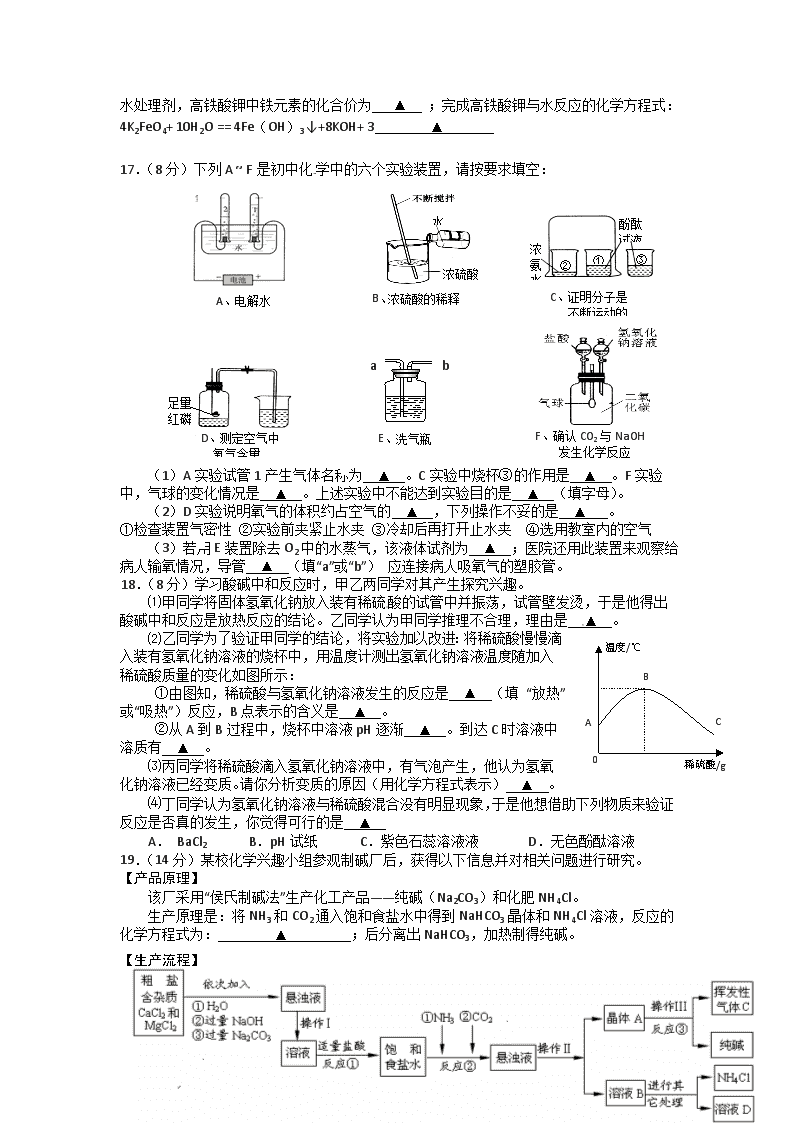
17.(8分)下列A ~ F是初中化学中的六个实验装置,请按要求填空:
D、测定空气中
氧气含量
足量
红磷
F、确认CO2与NaOH
发生化学反应
B、浓硫酸的稀释
浓硫酸
水
C、证明分子是
不断运动的
酚酞
试液
浓氨水
①
②
③
A、电解水
E、洗气瓶
a
b
(1)A实验试管1产生气体名称为 ▲ 。C实验中烧杯③的作用是 ▲ 。F实验中,气球的变化情况是 ▲ 。上述实验中不能达到实验目的是 ▲ (填字母)。
(2)D实验说明氧气的体积约占空气的 ▲ ,下列操作不妥的是 ▲ 。
①检查装置气密性 ②实验前夹紧止水夹 ③冷却后再打开止水夹 ④选用教室内的空气
(3)若用E装置除去O2中的水蒸气,该液体试剂为 ▲ ;医院还用此装置来观察给病人输氧情况,导管 ▲ (填“a”或“b”) 应连接病人吸
氧气的塑胶管。
18.(8分)学习酸碱中和反应时,甲乙两同学对其产生探究兴趣。
⑴甲同学将固体氢氧化钠放入装有稀硫酸的试管中并振荡,试管壁发烫,于是他得出酸碱中和反应是放热反应的结论。乙同学认为甲同学推理不合理,理由是 ▲ 。
B
0
A
稀硫酸/g
温度/℃
C
⑵乙同学为了验证甲同学的结论,将实验加以改进:将稀硫酸慢慢滴入装有氢氧化钠溶液的烧杯中,用温度计测出氢氧化钠溶液温度随加入稀硫酸质量的变化如图所示:
①由图知,稀硫酸与氢氧化钠溶液发生的反应是 ▲ (填 “放热”或“吸热”)反应,B点表示的含义是 ▲ 。
②从A到B过程中,烧杯中溶液pH逐渐 ▲ 。到达C时溶液中溶质有 ▲ 。
⑶丙同学将稀硫酸滴入氢氧化钠溶液中,有气泡产生,他认为氢氧化钠溶液已经变质。请你分析变质的原因(用化学方程式表示) ▲ 。
⑷丁同学认为氢氧化钠溶液与稀硫酸混合没有明显现象,于是他想借助下列物质来验证反应是否真的发生,你觉得可行的是 ▲
A. BaCl2 B.pH试纸 C.紫色石蕊溶液液 D.无色酚酞溶液
19.(14分)某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究。
【产品原理】
该厂采用“侯氏制碱法”生产化工产品——纯碱(Na2CO3)和化肥NH4Cl。
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3晶体和NH4Cl溶液,反应的化学方程式为: ▲ ;后分离出NaHCO3,加热制得纯碱。
【生产流程】
5
△
【相关资料】
⑴ NH4Cl NH3↑+HCl↑
⑵ 已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解的气体体积)
物质
NaCl
NaHCO3
NH4Cl
NH3
CO2
溶解度
36.0g
9.6g
37.2g
710
0.9
【问题讨论】
⑴操作Ⅰ、Ⅱ中,相同操作的名称为 ▲ 。反应①中发生了两个反应,写出其中一个化学方程式: ▲ ,反应①加适量的盐酸,适量是指 ▲ 。
⑵检验挥发性气体C的方法 ▲ 。
⑶上述生产流程中可循环使用的是 ▲ (填序号)。
A.挥发性气体C B.溶液D C.氢氧化镁 D.化肥NH4Cl
【组成确定】
⑴ 称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
⑵ 另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。由上述实验可确定纯碱样品含有杂质 ▲ (写化学式)。
【含量测定】
实验一
实验二
实验三
实验四
固体混合物溶液质量
100g
100g
100g
100g
加入CaCl2溶液质量
10g
20g
30g
40g
生成的沉淀的质量
4g
m
10g
10g
称取该纯碱样品44 g固体混合物,加水配成400g溶液,平均分为四份,然后分别加入一定质量分数的CaCl2溶液,实验数据见表:
请分析表中数据回答并计算:
⑴m= ▲ g;
⑵在实验三中,完全反应后所得溶液中溶质氯化钠的质量分数是多少?(要求写计算过程,结果保留0.1%)
【总结反思】
工业纯碱标准:(Na2CO3% )
优等品
一等品
合格品
次品
≥95
≥80
≥75
≤40
请通过计算并结合下表判断此纯碱样品等级为 ▲ 品,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小。
5
化学试题参考答案和评分标准
说明:1.化学专用名词或仪器名称写错不给分;
2.化学方程式中化学式写错不给分;若化学方程式不配平、未标出产物状态(↑或↓)或出现差错,全卷共扣1分;
3.与参考答案不同的合理答案均给分。
一、选择题(本题包括15小题,每小题2分,共30分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
答案
A
C
D
D
D
A
D
B
B
A
A
C
D
B
b
二、非选择题(本题包括4小题,除化学方程式每空2分外,其它每空1分,19题写计算过程3分,共40分)
16.(6分)(1) ①H2O ②CO ③Ca(OH)2 ④H2CO3 ⑤CaCO3 ⑥NH4NO3
(4分 (2) ①工业废水或生活污水的任意排放,不合理使用农药、化肥等任写一种即可; 水分子(H2O )
②+6 ; O2
17.(8分)(1)氧气 O2; 作对比或对比实验 ; 先变大,后变小; B
(2)1/5 ; ④
(3) 浓硫酸; b
18.(8分)(1) 固体氢氧化钠溶于水会放出大量的热
(2) ①放热 ; 酸碱恰好完全中和 ;②减小 ;硫酸钠 和硫酸;
2NaOH+CO2═Na2CO3+H2O ; BCD。
19.(14分)
【产品原理】 NaCl+ NH3 + CO2 + H2O = NaHCO3↓+ NH4Cl
【问题讨论】(1) ⑴ 过滤 NaOH+HCl===NaCl+H2O
或Na2CO3 + 2HCl=2NaCl+H2O+CO2↑, 滴到无气泡放出为止
(2)将气体通入澄清石灰水中,观察是否变浑浊
(3) A.B
【组成确定】:NaCl
【含量测定】⑴ 8
(2)解:设参加反应的Na2CO3的质量为x,生成的氯化钠的质量为y(计算过程3分。)
Na2CO3+ CaCl2=CaCO3↓+2NaCl
106 100 117
x 10g y
106∶ 100 = x∶10g 100∶117 = 10g∶y
解得:x = 10.6g y=11.7g (1分)
NaCl%= 11.7g+(11g-10.6g) ×100%
100g+30g-10g =10.1% (2分)
【总结反思】优等
5