- 364.50 KB
- 2021-11-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课题2 二氧化碳制取的研究
【学习目标】
1.了解实验室中制取二氧化碳的反应原理。
2.探究实验室制取二氧化碳的装置,并利用设计的装置制取CO2。
3.了解实验室中制取气体的思路和方法。
【重点难点】
1.实验室制取二氧化碳的化学反应原理、实验装置和制取方法。
2.从实验室制取气体的思路出发,学习二氧化碳的实验室制取方法。
学习内容一 实验室制取二氧化碳的原理
【学习指导】
阅读课本第113页的有关内容,观看老师做演示实验,学生作记录,完成下列问题(提示:观察反应有无气泡产生和气泡产生速率的快慢)。
反应原料
实验现象
反应的
快慢
是否便
于收集
结论
石灰石+
稀硫酸
有气泡产生,过
一会儿反应停止
慢
石灰石+
稀盐酸
有气泡产生
反应速
率适中
便于
收集
碳酸钠+
稀盐酸
有气泡产生
反应速
率快
不便于
收集
制二氧化
碳的理想
原料为:
石灰石、
稀盐酸
实验室制取CO2常选用石灰石和稀盐酸,其反应原理是CaCO3+2HCl===CaCl2+H2O+CO2↑。
【讨论交流】
1.为什么稀硫酸与石灰石的反应进行一会儿后反应停止,无气泡产生?
2.实验室制二氧化碳能否使用浓盐酸?
3.实验室制取二氧化碳能否用纯CaCO3或Na2CO3代替大理石或石灰石?
【温馨点拨】
1.稀硫酸与石灰石的反应进行一会儿后就停止的原因:反应生成的CaSO4微溶于水,因而大部分硫酸钙以沉淀形式覆盖在石灰石表面,阻止反应进行。
2.不能使用浓盐酸,因为浓盐酸易挥发,会使制得的二氧化碳气体中混有氯化氢气体而不纯。
4
3.不能用纯CaCO3或Na2CO3代替大理石或石灰石,因为它们与稀盐酸反应速率太快,很难控制,且成本较高。
【名师归纳】
实验室制取一种气体在设计反应时要注意以下几点:a.反应速率必须适中;b.操作简便;c.便于收集;d.只需实验室就能满足反应条件;e.对环境不要造成污染;f.药品价值不要过于昂贵。
【反馈练习】
1.实验室不用稀硫酸与石灰石反应制二氧化碳的理由是(C)
A.稀硫酸与石灰石不反应
B.稀硫酸易挥发,使制得的CO2不纯
C.生成微溶于水的CaSO4,阻止反应进行
D.石灰石中含有杂质
2.下列反应或作用中不产生二氧化碳的是(D)
A.用红热的木炭还原氧化铜
B.大理石与稀硫酸反应
C.在空气中点燃木炭
D.绿色植物的光合作用
学习内容二 实验室制取CO2的装置和步骤
【学习指导】
阅读课本第113-115页的有关内容,完成下列填空。
1.装置的确定
(1)实验室里制取气体的装置包括发生装置和收集装置。气体发生装置要考虑反应物的反应条件和反应物的状态。实验室制取CO2,反应物是固态和液态,条件不需加热,所以发生装置选用固液不需加热型。
(2)气体的收集装置要考虑气体的密度和水溶性。二氧化碳的密度比空气大,且不与空气中的任何成分发生反应,故二氧化碳可以用向上排空气法收集。二氧化碳能溶于水且与水发生反应,故不能使用排水集气法收集。选用的收集装置是集气瓶和玻璃片。当气体的密度和空气的密度相近且难溶于水时,一般采用排水集气法收集。
(3)计算CO2、NH3、CO、O2、H2的相对分子质量,并与空气的密度作比较。说出它们的收集方法。
2.操作步骤
(1)实验室制取二氧化碳,装药品前必须先检查装置的气密性。课本中图6-12的发生装置的优点:装置简单,操作方便。
(2)装药品时,先装入石灰石(或大理石)再加入稀盐酸,长颈漏斗的末端应在液面以下。
(3)收集二氧化碳时,用向上排空气法,导管末端插入集气瓶的底部。
(4)检验:向集气瓶中滴入澄清石灰水,澄清的石灰水变浑浊,证明该气体是二氧化碳。
(5)验满:将燃着的木条放在集气瓶口,木条熄灭,证明已满。
【讨论交流】
1.如何检验生成的气体为二氧化碳?怎样知道二氧化碳已经收集满?
2.实验室制取氧气、二氧化碳有哪些不同?
【温馨点拨】
1.向澄清石灰水中通入生成的气体——石灰水变浑浊,可检验生成的气体为二氧化碳;将燃着的木条置于集气瓶口,看木条是否熄灭来检验二氧化碳是否收集满。
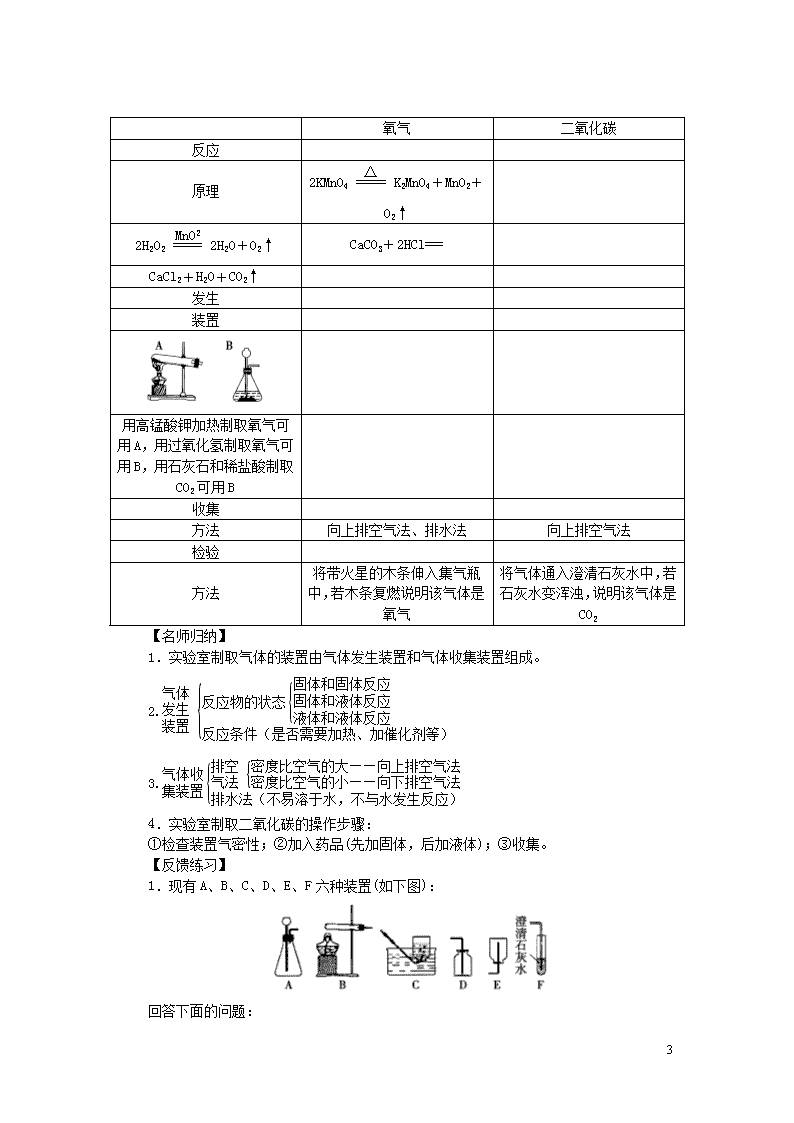
2.实验室制取氧气、二氧化碳的比较
4
氧气
二氧化碳
反应
原理
2KMnO4K2MnO4+MnO2+O2↑
2H2O22H2O+O2↑
CaCO3+2HCl===
CaCl2+H2O+CO2↑
发生
装置
用高锰酸钾加热制取氧气可用A,用过氧化氢制取氧气可用B,用石灰石和稀盐酸制取CO2可用B
收集
方法
向上排空气法、排水法
向上排空气法
检验
方法
将带火星的木条伸入集气瓶中,若木条复燃说明该气体是氧气
将气体通入澄清石灰水中,若石灰水变浑浊,说明该气体是CO2
【名师归纳】
1.实验室制取气体的装置由气体发生装置和气体收集装置组成。
2.
3.
4.实验室制取二氧化碳的操作步骤:
①检查装置气密性;②加入药品(先加固体,后加液体);③收集。
【反馈练习】
1.现有A、B、C、D、E、F六种装置(如下图):
回答下面的问题:
4
(1)将实验室制取O2、H2和CO2应选用的发生和收集装置填入下表中(填装置图的字母代号,下同):
制取的
气体
O2(用KMnO4
作原料)
H2(用Zn
和稀硫酸)
CO2
发生装置
B
A
A
收集装置
C或D
C或E
D
(2)实验室做木炭还原氧化铜的实验并检验生成的气体时,应选用装置B和F连接。
(3)实验室为什么不用木炭与氧化铜反应生成CO2?反应太慢且收集到的气体不纯。
2.根据下图装置填空:
(1)写出图中标号仪器的名称:①酒精灯,②长颈漏斗,③试管。
(2)实验室制取二氧化碳气体的发生装置是B,收集装置是E(填序号)。
在初中化学里,可用A装置进行的实验有(写出任意一个反应的化学方程式即可)2KClO32KCl+3O2↑。
(3)
实验室用加热氯化铵和氢氧化钙两种固体混合物来制取氨气。氨气的密度比空气小,且极易溶于水,则实验室制取并收集氨气所用到的装置分别是A、C。将一支收集满干燥氨气的试管,倒插入蒸馏水中(如图),可能发生的现象是水槽内的液面下降、试管内的液面上升。
4
相关文档
- 2020学年度初中人教版九年级化学第2021-11-1013页
- 初中化学九年级上册第六单元碳和碳2021-11-1022页
- 2012中考化学复习精品 碳和碳的氧2021-11-106页
- 初中化学九年级上册第六单元碳和碳2021-11-103页
- 初中化学九年级上册第六单元碳和碳2021-11-1018页
- 九年级化学上册第六单元碳和碳的氧2021-11-105页
- 九年级化学上册第六单元碳和碳的氧2021-11-105页
- 初中化学九年级上册第六单元碳和碳2021-11-1017页
- 包头专版2020中考化学复习方案主题2021-11-1020页
- 九年级化学上册碳和碳的氧化物单元2021-11-1021页