- 229.50 KB
- 2021-11-11 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1
浙 江省宁波市 2013 年中考化学试卷
一、选择题
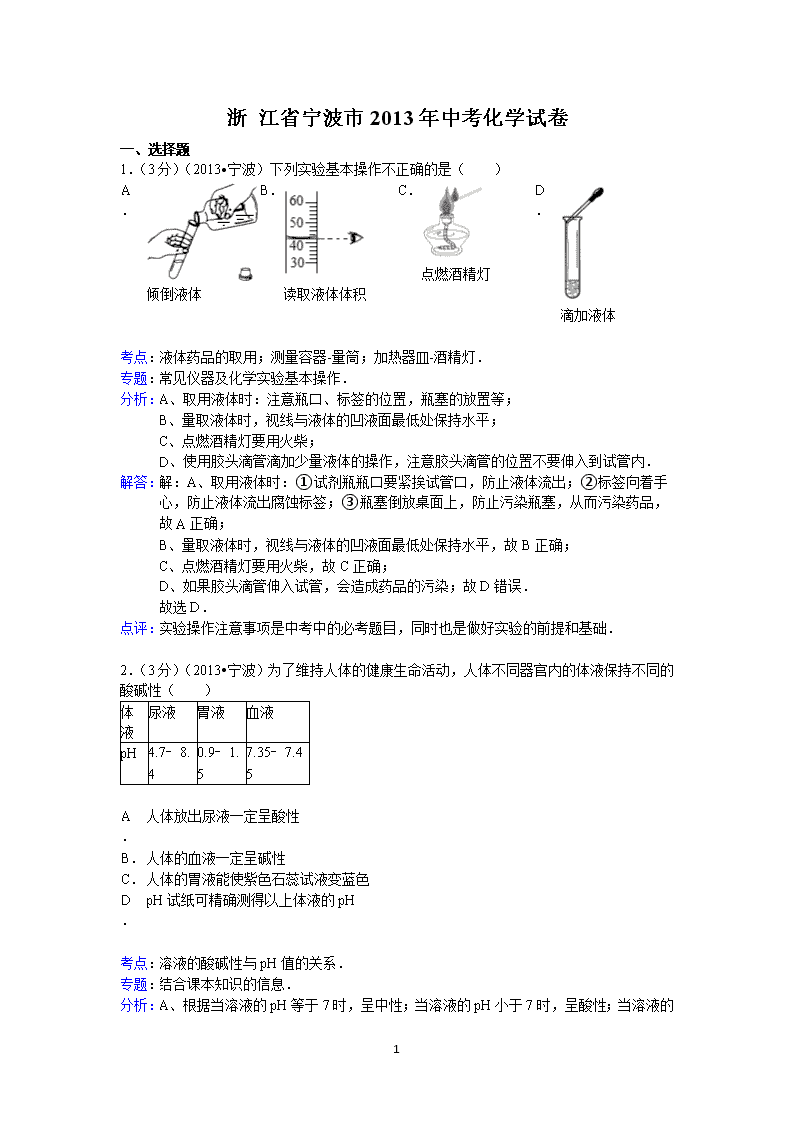
1.(3 分)(2013•宁波)下列实验基本操作不正确的是( )
A.
倾倒液体
B.
读取液体体积
C.
点燃酒精灯
D.
滴加液体
考点:液体药品的取用;测量容器-量筒;加热器皿-酒精灯.
专题:常见仪器及化学实验基本操作.
分析:A、取用液体时:注意瓶口、标签的位置,瓶塞的放置等;
B、量取液体时,视线与液体的凹液面最低处保持水平;
C、点燃酒精灯要用火柴;
D、使用胶头滴管滴加少量液体的操作,注意胶头滴管的位置不要伸入到试管内.
解答:解:A、取用液体时:①试剂瓶瓶口要紧挨试管口,防止液体流出;②标签向着手
心,防止液体流出腐蚀标签;③瓶塞倒放桌面上,防止污染瓶塞,从而污染药品,
故 A 正确;
B、量取液体时,视线与液体的凹液面最低处保持水平,故 B 正确;
C、点燃酒精灯要用火柴,故 C 正确;
D、如果胶头滴管伸入试管,会造成药品的污染;故 D 错误.
故选 D.
点评:实验操作注意事项是中考中的必考题目,同时也是做好实验的前提和基础.
2.(3 分)(2013•宁波)为了维持人体的健康生命活动,人体不同器官内的体液保持不同的
酸碱性( )
体
液
尿液 胃液 血液
pH 4.7﹣
8.4
0.9﹣
1.5
7.35﹣
7.45
A.人体放出尿液一定呈酸性
B.人体的血液一定呈碱性
C.人体的胃液能使紫色石蕊试液变蓝色
D.pH 试纸可精确测得以上体液的 pH
考点:溶液的酸碱性与 pH 值的关系.
专题:结合课本知识的信息.
分析:A、根据当溶液的 pH 等于 7 时,呈中性;当溶液的 pH 小于 7 时,呈酸性;当溶液的
pH 大于 7 时,呈碱性进行分析判断.
B、根据当溶液的 pH 大于 7 时,呈碱性进行分析判断.
2
C、根据胃液的酸碱性以及紫色石蕊试液的变色情况判断.
D、根据 pH 试纸测得的结果是整数判断.
解答:解:A、尿液的 pH 为 4.7﹣8.4,可能显酸性、中性或碱性,故选项错误.
B、血液的 pH 为 7.35﹣7.45,大于 7,显碱性,故选项正确.
C、胃液的 pH 为 0.9﹣1.5,小于 7,显酸性,因此人体的胃液能使紫色石蕊试液变红,
故选项错误.
D、pH 试纸测得的结果是整数,故选项错误.
故选 B.
点评:本题难度不大,掌握溶液的酸碱性和溶液 pH 大小之间的关系是正确解题的关键.
3.(3 分)(2013•宁波)2013 年 4 月,用我国自主研发的 1 号生物航空煤油的飞机首次试飞
成功.生物航空煤油是以多种动植物油脂为原料,采用自主研发的加氢技术、催化剂体系和
工艺技术生产.我国正积极研发餐饮废油(地沟油)和海藻加工生产生物航空煤油的技术.下
列有关说法中.错误的是( )
A.此项技术有助缓解民用航空业的能源问题
B.生物航空煤油的生产过程中没有发生化学变化
C.“地沟油”流入餐桌会对食用者产生危害
D.“地沟油”可以进行合理利用变废为宝
考点:资源综合利用和新能源开发.
专题:化学与生活.
分析:随着社会的发展,能源危机日益凸显;
化学变化的本质特征是有新物质生成;
地沟油中含有多种有害物质;
某些物质经过处理后,可以变废为宝.
解答:解:A、化石燃料面临枯竭,能源危机摆在人们面前,餐饮废油(地沟油)和海藻加
工生产生物航空煤油的技术可以缓解能源危机.正确.
B、以油脂为原料,采用加氢技术、在催化剂作用下生成的煤油是一种新物质,属于
化学变化.错误.
C、食用“地沟油”能够危害身体健康.正确.
D、将废油(地沟油)和海藻加工生产生物航空煤油的技术,是废物再利用的技术,
利国利民.正确.
故选:B.
点评:正确区别物理变化和化学变化关键是判断是否有新物质的生成,方法是比较变化前后
物质的差别:是只限于物质的状态变化,还是物质发生了根本变化.
3
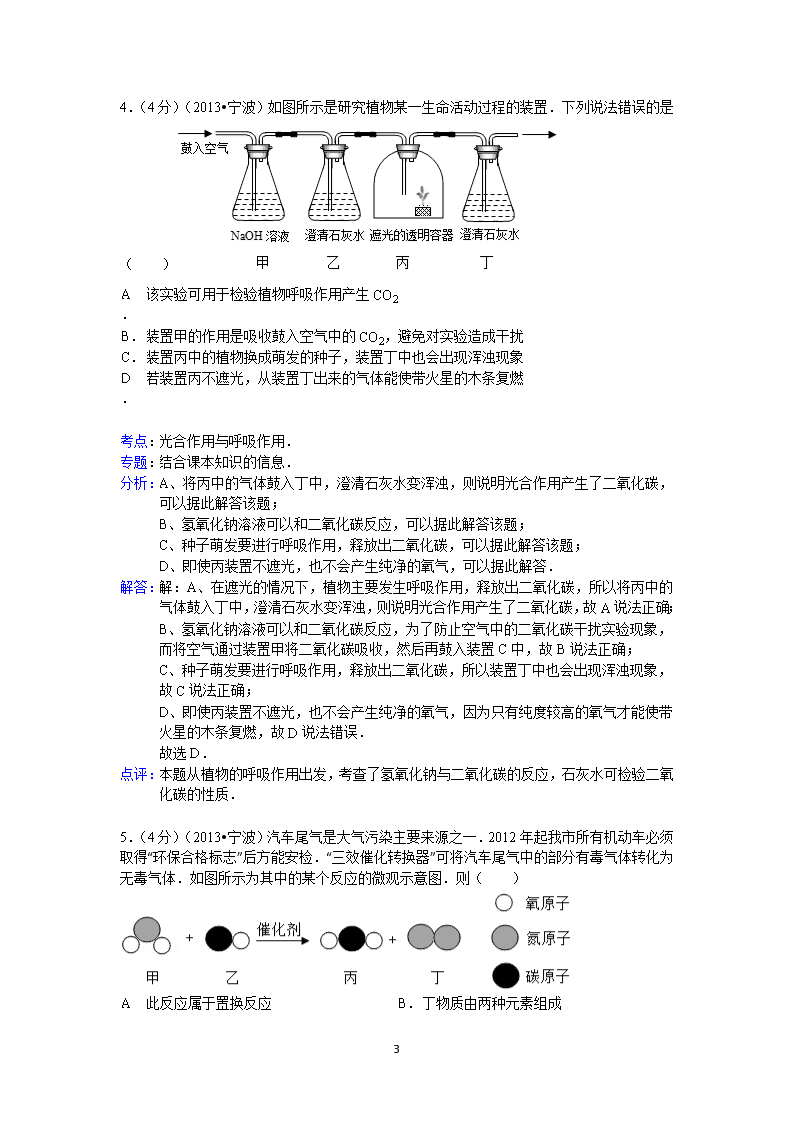
4.(4 分)(2013•宁波)如图所示是研究植物某一生命活动过程的装置.下列说法错误的是
( )
A.该实验可用于检验植物呼吸作用产生 CO2
B.装置甲的作用是吸收鼓入空气中的 CO2,避免对实验造成干扰
C.装置丙中的植物换成萌发的种子,装置丁中也会出现浑浊现象
D.若装置丙不遮光,从装置丁出来的气体能使带火星的木条复燃
考点:光合作用与呼吸作用.
专题:结合课本知识的信息.
分析:A、将丙中的气体鼓入丁中,澄清石灰水变浑浊,则说明光合作用产生了二氧化碳,
可以据此解答该题;
B、氢氧化钠溶液可以和二氧化碳反应,可以据此解答该题;
C、种子萌发要进行呼吸作用,释放出二氧化碳,可以据此解答该题;
D、即使丙装置不遮光,也不会产生纯净的氧气,可以据此解答.
解答:解:A、在遮光的情况下,植物主要发生呼吸作用,释放出二氧化碳,所以将丙中的
气体鼓入丁中,澄清石灰水变浑浊,则说明光合作用产生了二氧化碳,故 A 说法正确;
B、氢氧化钠溶液可以和二氧化碳反应,为了防止空气中的二氧化碳干扰实验现象,
而将空气通过装置甲将二氧化碳吸收,然后再鼓入装置 C 中,故 B 说法正确;
C、种子萌发要进行呼吸作用,释放出二氧化碳,所以装置丁中也会出现浑浊现象,
故 C 说法正确;
D、即使丙装置不遮光,也不会产生纯净的氧气,因为只有纯度较高的氧气才能使带
火星的木条复燃,故 D 说法错误.
故选 D.
点评:本题从植物的呼吸作用出发,考查了氢氧化钠与二氧化碳的反应,石灰水可检验二氧
化碳的性质.
5.(4 分)(2013•宁波)汽车尾气是大气污染主要来源之一.2012 年起我市所有机动车必须
取得“环保合格标志”后方能安检.“三效催化转换器”可将汽车尾气中的部分有毒气体转化为
无毒气体.如图所示为其中的某个反应的微观示意图.则( )
A.此反应属于置换反应 B.丁物质由两种元素组成
C.乙和丙由相同的元素组成 D.反应前后共有三种分子
4
考点:微粒观点及模型图的应用.
专题:化学反应模拟图型.
分析:根据反应的微观示意图,分析反应物、生成物,写出反应的方程式,根据方程式分析
有关的问题.
解答:解:由反应的微观示意图可知,反应物甲、乙分别是二氧化氮和一氧化碳,生成物丙
丁分别是二氧化碳和氮气,反应的方程式是:2NO+2CO 2CO2+N2,由此可
知:
A、该反应的反应物是两种化合物,此反应不属于置换反应.故 A 错误;
B、丁是氮气,有一种元素组成.故 B 错误;
C、乙是一氧化碳,丙是二氧化碳,由相同的元素组成.故 C 正确;
D、反应前后有二氧化氮、一氧化碳、二氧化碳、氮气四种分子.故 D 错误.
故选 C.
点评:本题在解答时,根据物质的微观构成示意图,写出反应的方程式,由方程式再解答简
单了.
6.(4 分)(2013•宁波)如图所示是甲、乙两种物质的溶解度曲线.将 t2℃时等质量的甲、
乙两种物质的饱和溶液降温到 t1℃时( )
A.两种溶液仍是饱和溶液 B.两种溶液的质量仍相同
C.乙溶液的溶质质量分数比甲大 D.乙溶液中的溶剂质量比甲多
考点:固体溶解度曲线及其作用.
专题:溶液、浊液与溶解度.
分析:A、据甲、乙的溶解度随温度变化情况分析降温后溶液状态变化;
B、甲的溶解度随温度降低而减小,要析出晶体,溶液质量减小,乙的溶解度随温度
降低而增大,溶液质量不变;
C、据二者溶解度随温度变化及饱和溶液中溶质的质量分数计算法分析解答;
D、根据 t2℃时二者的溶解度及溶液质量相等分析溶剂质量多少.
解答:解:A、乙的乙的溶解度随温度降低而增大,所以降温后变为不饱和溶液,故错误;
B、甲的溶解度随温度降低而减小,要析出晶体,溶液质量减小,乙的溶解度随温度
降低而增大,溶液质量不变,故错误;
C、由 B 可知,甲降温后溶质减小,溶质的质量分数减小,乙中溶质、溶剂质量均不
变,溶质的质量分数不变,与降温前相等,根据饱和时质量分数的计算式
×100%,可知溶解度大则溶质的质量分数大,而 t1℃时甲的溶解度大于
t2℃时乙的溶解度,故降温后乙溶液的溶质质量分数比甲小,故错误;
5
D、t2℃时甲的溶解度大于乙 的溶解度,所以 t2℃时等质量的甲、乙两种物质的饱和
溶液中甲溶液中溶剂的质量比乙少,降温溶剂的质量不变,故正确;
故选 D.
点评:本题考查了溶解度曲线的意义,注重考查学生对知识的掌握和应用能力.
7.(4 分)(2013•宁波)下列图象能正确表示对应变化关系的是( )
A.图甲表示水通电分解产生的气体质量 m 与反应时间 t 的关系
B.图乙表示两份完全相同的双氧水在有无 MnO2 的情况下,产生的 O2 的质量与反应时间 t
的关系
C.图丙表示往锌中加入足量的稀 H2SO4,产生的 H2 的质量 m 与反应时间 t 的关系
D.图丁表示往稀盐酸和 CuCl2 混合液中滴入 NaOH 溶液,产生的沉淀质量 m2 与 NaOH 溶
液质量 m1 的关系
考点:电解水实验;催化剂的特点与催化作用;金属的化学性质;碱的化学性质.
专题:元素化合物知识型.
分析:A、根据电解水时生成的氢气和氧气的质量关系分析;
B、根据双氧水放出氧气的质量与有无催化剂无关分析;
C、根据锌与硫酸反应生成的氢气和时间的之间的关系分析;
D、往稀盐酸和 CuCl2 混合液中滴入 NaOH 溶液,首先稀盐酸与 NaOH 溶液反应,当
稀盐酸反应完,CuCl2 再与 NaOH 溶液反应生成沉淀.
解答:解:A、电解水时生成的氢气和氧气的质量比是 1:8,故 A 错误;
B、双氧水放出氧气的质量与有无催化剂无关,生成的氧气的质量相等.故 B 错误;
C、锌与硫酸反应生成的氢气随时间的增加而增大,故 C 错误;
D、向含有盐酸和 CuCl2 的混合溶液中加入 NaOH 溶液,开始没有沉淀生成,因为如
果生成氢氧化铜沉淀也会被盐酸溶解.当盐酸完全和氢氧化钠溶液反应后开始生成沉
淀,当氯化铜完全和氢氧化钠溶液反应后不再生成沉淀.故 D 正确.
故选 D.
点评:解答本题的关键是要充分理解图中提供的信息和物质的性质,只有这样才能对问题做
出正确的判断.
8.(4 分)(2013•宁波)现有铁、氧化铁、稀硫酸、氢氧化钙、碳酸钠溶液等五种物质,存
在着如图所示的相互反应或转化关系(图中“﹣”表示物质间可以发生化学反应,“→”表示物
6
质间存在相应的转化关系).下列判断合理的是( )
A.丙可能是碳酸钠溶液 B.丁可能是氢氧化钙溶液
C.乙必须通过置换反应转化为铁 D.甲和丁的反应一定是中和反应
考点:物质的鉴别、推断.
专题:框图型推断题.
分析:根据题中所给的物质的性质结合反应间的转化关系,找到题中的题眼进行推断解题,
硫酸会和其余的四种物质反应,可以知道丁就是硫酸,然后根据其他物质的性质进行
验证推导.
解答:解:根据下列图示解答,
铁 氧化铁 硫酸 氢氧化钙 碳酸钠
铁 ﹣﹣ 不会反应 会反应 不会反应 不会反应
氧化铁 不会反应 ﹣﹣ 会反应 不会反应 不会反应
硫酸 会反应 会反应 ﹣﹣ 会反应 会反应
氢氧化钙 不会反应 不会反应 会反应 ﹣﹣ 会反应
碳酸钠 不会反应 不会反应 会反应 会反应 ﹣﹣
A、根据上表可以看出,碳酸钠会和两种物质反应,而碳酸钠和氢氧化钙都会和两种
物质反应,所以甲和丙要从碳酸钠和氢氧化钙中选,丙可能是碳酸钠溶液,故 A 正确;
B、根据上表可以看出,会与四种物质发生反应的只有硫酸,可知丁一定是硫酸,故
B 错;
C、只有氧化铁会转化成铁,但是不一定都是置换反应,比如一氧化碳还原氧化铁就
不是置换反应,故 C 错;
D、中和反应必须是酸和碱反应生成盐和水,丁是硫酸,属于酸,但是甲可能是氢氧
化钙,也可能是碳酸钠,所以不一定是中和反应,故 D 错.
故选 A.
点评:根据反应的特点,分析满足条件的反应.本题开放度较大,分析时不必追求面面俱到
穷尽所有结果
二、简答题
9.(4 分)(2013•宁波)2013 年 4 月 25 日晚 8 点,台州市的一金属堆场发生火灾,十多吨
金属镁发生爆燃后发出刺眼的白光,将夜空映照得如同白昼,消防指挥部立即动员力量,寻
找沙土进行灭火.镁是一种银白色的金属,在高温条件下遇水反应释放出氢气.
(1)利用沙土灭火的原理是 使可燃物隔绝空气(或氧气) .
(2)本次火灾消防员不能用水来灭火,其原因是 镁在高温条件下遇水反应释放出氢气,
氢气在空气中能燃烧,甚至发生爆炸 .
考点:灭火的原理和方法.
专题:化学与生活.
7
分析:根据灭火的原理:(1)清除可燃物或使可燃物与其他物品隔离,(2)隔绝氧气或空气,
(3)使温度降到可燃物的着火点以下,解答本题.
解答:解:(1)覆盖沙土灭火的原理是:使可燃物隔绝空气(或氧气);
(2)据题中信息可知,镁在高温条件下遇水反应释放出氢气,氢气在空气中能燃烧,
甚至发生爆炸.
故答为:(1)使可燃物隔绝空气(或氧气);(2)镁在高温条件下遇水反应释放出氢
气,氢气在空气中能燃烧,甚至发生爆炸.
点评:根据燃烧需要同时满足的三个条件,灭火可采取隔绝氧气、降低温度到着火点以下或
撤离可燃物的原理进行灭火.
10.(6 分)(2013•宁波)在实验课中,各小组作了如下实验:
实验编号 1 2 3 4
实验操作
实验后,同学们按老师要求将废液都倒在指定的大烧杯中,小科猜想该烧杯中的废液可能有
硫酸铜、硫酸锌、硫酸亚铁…,应该可以从中提炼出铁和铜.经思考后,他设计了如图所示
的实验,并设法使滤液甲和乙所含的溶质相
同.
则固体 C 是 铁 ,操作③的名称是 过滤 ,实验中所加的过量金属粉末是 锌 .
考点:金属活动性顺序及其应用.
专题:金属与金属材料.
分析:根据题意,固体 C 能被磁铁所吸起,应是铁,根据提炼出铁和铜流程图,结合溶液的
成分及金属的活动性,当加入过量的锌粉时,过量锌粉与硫酸铜、硫酸锌、硫酸亚铁
等的混合溶液反应后,将溶液中的铁、铜全部置换出来,所得溶液为 ZnSO4 溶液,铜
粉与锌粉的混合物与足量稀硫酸反应后,所得溶液为 ZnSO4 溶液;由实验过程图可判
断,操作③完成后原混合物分成了固体和滤液两部分;利用这一特点可判断操作③
为过滤操作.
解答:解:由题意可知,固体 C 能被磁铁所吸起,应是铁.由于金属活动性是锌>铁>铜,
当加入过量的锌粉时,过量锌粉与硫酸铜、硫酸锌、硫酸亚铁的混合溶液反应后,将
溶液中的铁、铜全部置换出来,所得溶液为 ZnSO4 溶液;铜粉与锌粉的混合物与足量
稀硫酸反应后,所得溶液为 ZnSO4 溶液,能使滤液甲和乙所含的溶质相同;由实验过
8
程图可判断,操作③完成后原混合物分成了固体和滤液两部分;利用这一特点可判
断操作③为过滤操作.
故答为:铁;过滤;锌.
点评:此题是对物质分离知识的考查,解题时只要抓住反应过程中金属与盐溶液的反应实
质,并结合相关的实验过程就能顺利解题.
三、实验探究题
11.(8 分)(2013•宁波)小科发现暖水瓶中有一层淡黄色的水垢.据悉,该地区的水垢中
除了碳酸钙外,无其它盐类.他想探究还有没有其它物质,于是他收集水垢后经低温烘干进
行下列实验:
(1)取 2.5g 水垢按图甲中的 A 装置高温加热充分反应(已知 CaCO3 CaO+CO2↑),
产生的气体依次通过 B、C 装置,实验后发现 C 装置中氢氧化钠溶液增加了 0.88g.
①写出 C 装置中发现的化学反应方程式 2NaOH+CO2═Na2CO3+H2O
②B 装置中的浓硫酸是用来吸收反应中产生的水蒸气,这是利用了浓硫酸的 吸水 性.
③该水垢所含碳酸钙的质量分数为 80% .
(2)按图乙所示的方法来实验,结果发现澄清石灰水没有变浑浊,原因是 浓盐酸具有挥
发性,与氢氧化钙反应(或浓盐酸有挥发性,产生的沉淀被盐酸溶解) .
考点:实验探究物质的组成成分以及含量.
专题:科学探究.
分析:氢氧化钠溶液能够吸收二氧化碳、二氧化硫等物质;
浓硫酸具有吸水性、脱水性、强氧化性;
根据化学方程式可以进行相关方面的计算;
浓盐酸具有挥发性,能和显碱性的物质反应.
解答:解:(1)①氢氧化钠和二氧化碳反应能生成碳酸钠和水,反应的化学方程式为:CO2
+2NaOH═Na2CO3+H2O.
故填:CO2 +2NaOH═Na2CO3+H2O.
②浓硫酸能够用来吸收反应中产生的水蒸气,说明浓硫酸具有吸水性.
故填:吸水.
③C 装置中氢氧化钠溶液增加了 0.88g,说明碳酸钙分解生成了 0. 88g 二氧化碳,
设碳酸钙的质量为 X,
CaCO3 CaO+CO2↑
100 44
9
X 0.88g
=
X=2g,
该水垢所含碳酸钙的质量分数为: ×100%=80%,
故填:80%.
(2)浓盐酸具有挥发性,挥发出的氯化氢和二氧化碳进入石灰水中,氯化氢溶于水
形成盐酸,盐酸能和氢氧化钙反应,也能够和生成的碳酸钙反应,所以不能产生沉淀.
故填:浓盐酸具有挥发性,与氢氧化钙反应(或浓盐酸有挥发性,产生的沉淀被盐酸
溶解).
点评:求某种物质的质量分数时,注意不要漏掉×100%,这是做题时经常忽略的.
四、分析计算题
12.(4 分)(2013•宁波)2013 年 5 月 9 日,宁波一家面馆误把亚硝酸钠(NaNO2)当成食
盐和进面里,导致多人中毒.
(1)NaNO2 中 N 元素的化合价为 +3 .
(2)NaNO2 中氮、氧元素的质量比为 7:16 .
考点:有关元素化合价的计算;元素质量比的计算.
专题:化学式的计算.
分析:(1)根据在化合物中正负化合价代数和为零,结合 NaNO2 的化学式进行解答本题.
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析.
解答:解:(1)钠元素显+1 价,氧元素显﹣2 价,设 NaNO2 中 N 元素的化合价为 x,根据
在化合物中正负化合价代数和为零,可得:(+1)+x+(﹣2)×2=0,则 x=+3 价.
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,NaNO2 中
氮、氧元素的质量比是(14×1):(16×2)=7:16;
故答案为:(1)+3;(2)7:16.
点评:本题难度不大,掌握利用化合价的原则计算指定元素的化合价的方法、化学式的有关
计算等是正确解答本题的关键.
13.(7 分)(2013•宁波)有一天,某学习小组进行野炊活动.所带的物品如下表:
食
物
大米、猪排骨、猪肝、鸡肉、鸡蛋、豆腐
调
料
食盐、碱面、蔗糖、食醋、味精、酱油、食用油
用
品
铁锅、锅铲、碗、筷子、肥皂
(1)在讨论中餐食谱时,他们发现所带食物不符合平衡膳食的要求,因为食物中缺少了 水
果、蔬菜 .
(2)到了目的地同学们发现忘了给装食盐和碱面(只要成分是碳酸钠)的瓶子做标记.可
用所带物品 食醋 来鉴别.
(3)野炊活动中,有一同学被蜜蜂意外蛰伤,蜜蜂毒液呈酸性,其他同学马上利用肥皂水
为其涂抹于患处,结果症状大大减轻,这是因为肥皂水呈 碱 性.
10
(4)野炊回来后,小科从资料中获悉:某品牌酱油每 100ml 中铁营养剂的标准添加量是
0.2g.铁营养几中铁元素质量分数为 12.5%.由此可计算一瓶 448ml 该品牌酱油中所含的铁
元素相当于多少克硫酸亚铁中所含的铁元素质量?如果这些硫酸亚铁是通过铁和稀硫酸反
应制得,则需要 9.8%的稀硫酸质量多少?
考点:生命活动与六大营养素;中和反应及其应用;酸、碱、盐的鉴别;根据化学反应方程
式的计算.
专题:物质的鉴别题;有关化学方程式的计算;化学与生活.
分析:人类需要的营养物质有糖类、油脂、蛋白质、维生素、水和无机盐;
碳酸盐能和显酸性的物质反应生成二氧化碳;
显酸性的物质能和显碱性的物质发生反应;
根据化学式和化学方程式可以进行相关方面的计算.
解答:解:(1)人体必需的营养素有六种,其中大米中含有丰富的糖类,猪排骨、猪肝、鸡
肉、豆腐等食物中含有丰富的蛋白质,鸡蛋中含有丰富的蛋白质和油脂,水和无机盐
在部分食物中存在,主要缺少维生素,水果、蔬菜中含有丰富的维生素.
故填:水果、蔬菜.
(2)食盐不能和食醋反应,碳酸钠能和食醋反应生成醋酸钠、水和二氧化碳,向两
种物质中分别滴加食醋时,有气泡出现的是碱面,没有明显现象的是食盐.
故填:食醋.
(3)蜜蜂毒液呈酸性,能和显碱性的物质反应,涂上肥皂水后,症状大大减轻,说
明肥皂水显碱性.
故填:碱.
(4)解:设 448ml 该品牌酱油中所含的铁元素相当于质量为 X 的硫酸亚铁中所含的
铁元素质量,
0.2g 添加剂中铁元素的质量为:0.2g×12.5%=0.025g,
448ml 酱油中所含的铁元素的质量为:0.025g× =0.112g,
根据题意有:X× ×100%=0.112g,
X=0.304g,
答:448ml 该品牌酱油中所含的铁元素相当于 0.304g 硫酸亚铁中所含的铁元素质量.
解:设需要硫酸的质量为 Y,
Fe+H2SO4=FeSO4+H2↑
98 152
Y 0.304g
=
Y=0.196g,
设需要 9.8%的稀硫酸的质量为 Z,
则有:Z×9.8%=0.196g,
Z=2g,
答:需要 9.8%的稀硫酸的质量为 2g.
点评:本题比较容易,关键是计算要准确,题中涉及的数值很繁琐,稍不注意就会出错,考
查计算能力的题目也是会经常出现的.
11
相关文档
- 【中考化学试题,word版,含答案,可再编2021-11-1110页
- 【2020年中考化学,含答案,word版,可再2021-11-1115页
- 2012中考化学复习精品 常见的酸和2021-11-1110页
- 【中考化学试题,word版,含答案,可再编2021-11-119页
- 中考化学专项练习实验探究题(6)2021-11-113页
- 辽宁省辽阳市2013年中考化学试题(wo2021-11-1116页
- 山东省东营市2013年中考化学试题(wo2021-11-1114页
- 2014年中考化学专题训练:常见气体的2021-11-119页
- 中考化学第一轮复习考点分析:金属资2021-11-111页
- 云南省2021年中考化学模拟试题及答2021-11-1115页