- 1.21 MB
- 2021-11-11 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
扬州市江都区2013年九年级化学模拟试卷
2013.04.
(满分:100分 考试时间:100分钟)注 意 事 项
考生在答题前请认真阅读本注意事项及各题答题要求:
1.本试卷共6页,包含选择题(第1题~第20题,共40分)、非选择题(第21题~第26题,共60分)两部分。本次考试时间为100分钟,满分100分。考试结束后,请将答题纸交回。
2.答题前,请考生务必将自己的学校、班级、姓名、准考证号用0.5毫米的黑色签字笔写在答题纸上相应的位置。请在答题纸指定区域作答,在试卷或草稿纸上作答一律无效。
你可能用到的相对原子质量:H:1 C:12 O:16 Na:23 Fe:56
一、选择题(本题包括15小题,每小题2分,共30分。每小题只有一个选项符合题意)
1.下列行为中,不符合“绿V客(Green Week)”环保活动主题的是
A.缩短城市景观灯亮灯时间
B.周末呆在家里上网看电视
C.尽量使用可降解方便袋
D.步行或骑单车上下班
2.下列变化属于物理变化的是
A.玻璃破碎
B.燃气燃烧
C.钢铁锈蚀
D.光合作用
3.下列属于人体必需微量元素的是
A.H
B.Zn
C.Ca
D.O
4.二氧化氯(ClO2)是一种新型杀菌消毒剂,其中Cl元素的化合价是
A.—1
B.0
C.+4
D.+5
5.草木灰的主要成分是K2CO3,K2CO3属于
A.氧化物
B.酸
C.碱
D.盐
6.空气成分中,体积分数最大的是
A.氮气
B.氧气
C.二氧化碳
D.稀有气体
7.下列关于用微粒知识解释生活中现象的说法,不正确的是
A.酒香不怕巷子深 —— 微粒在不停运动
B.1滴水中含有1.7×1021个H2O分子 —— 微粒是很小的
C.等体积的大米和绿豆混合后总体积减小 —— 微粒间有间隙
D.食盐溶液能导电 —— 溶液中存在能自由移动的离子
8.下列物质加入水中能形成溶液的是
A.粉笔灰
B.植物油
C.蔗糖
D.生铁
8
9.在化学反应:4HgS + 4CaO = 4Hg + 3CaS + X中,X的化学式为
A. SO2
B.SO3
C.CaSO3
D.CaSO4
10.下列有关实验现象的描述,正确的是
A.白磷在空气中燃烧产生大量白雾
B.NaOH溶于水时,吸收热量,温度降低
C.细铁丝在氧气中燃烧,火星四射,生成红棕固体
D.电解水正极得到的气体能使带火星的木条复燃
11.用灯帽盖灭酒精灯的原理是
A.隔离可燃物
B.隔绝空气
C.降低酒精的着火点
D.降低温度至酒精的着火点以下
12.下列实验操作正确的是
A.读取液体体积
B.点燃酒精灯
C.加热液体
D.稀释浓硫酸
13.下列物质中,能与稀盐酸发生中和反应的是
A.Mg
B.MgO
C.Mg(OH)2
D.MgCO3
14.下列化学肥料中,属于复合肥的是
A.CO(NH2)2
B.K2SO4
C.NH4H2PO4
D.NH4HCO3
15.维生素C(C6H8O6)可预防病毒性传染病,下列关于维生素C的说法,错误的是
A.由C、H、O元素组成
B.是一种有机物
C.C、H、O元素质量比是3:4:3
D.相对分子质量为176
二、选择题(本题包括5小题,每小题2分,共10分。每小题有一个或两个选项符合题意。漏选得1分,错选不得分。)
16.下列有关化学基本概念的说法中,错误的是
A.同种元素可以组成不同的单质
B.发光发热现象都由物质燃烧引起
C.含氧元素的化合物不一定是氧化物
D.含碳化合物不一定是有机化合物
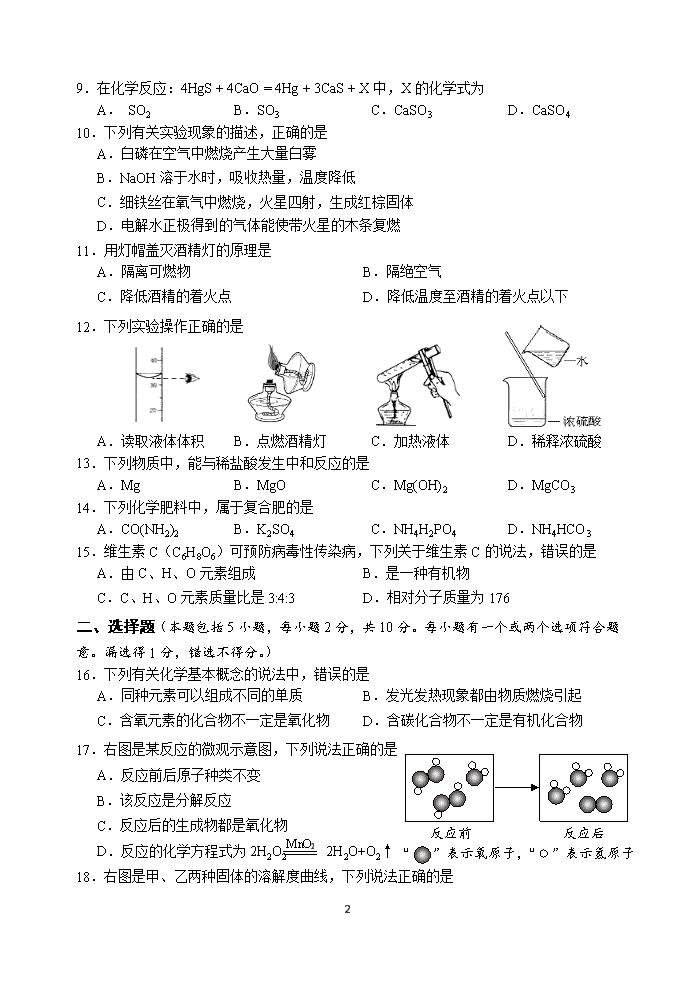
反应前 反应后
“ ”表示氧原子,“ ”表示氢原子
17.右图是某反应的微观示意图,下列说法正确的是
A.反应前后原子种类不变
B.该反应是分解反应
MnO2
C.反应后的生成物都是氧化物
D.反应的化学方程式为2H2O2 2H2O+O2↑
18.右图是甲、乙两种固体的溶解度曲线,下列说法正确的是
8
A.甲的溶解度大于乙的溶解度
B.10℃时,等质量的甲乙饱和溶液中溶质质量相等
C.20℃时,将10g甲物质加入50g水中,得到60g溶液
D.30℃时,甲物质饱和溶液中,溶质质量分数最大为60%
19.下列物质的除杂实验中,所选用的试剂、方法及反应类型均正确的是
选项
物质(括号内为杂质)
试剂、方法
反应类型
A.
CaO(CaCO3)
高温
分解反应
B.
Fe(Fe2O3)
足量CO
置换反应
C.
CO2(CO)
足量O2
化合反应
D.
CaCl2溶液(HCl)
足量CaCO3
复分解反应
20.某钢铁厂用800吨(Fe%=75%)FeO、Fe2O3、Fe3O4的混合铁矿石炼铁,炼得生铁(非铁元素含量<8%)的质量可能是(生铁中C%为2% ~ 4.3%)
A.600吨
B.608吨
C.625吨
D.676.5吨
三、(本题包括4小题,每空1分,共27分)
21.(4分)(1)用化学用语填空:
3个氧分子 ▲ ;沼气的主要成分 ▲ ;+5价的P元素 ▲ ;地壳中含量最多的金属元素 ▲ 。
22.(6分)用字母序号填空:
a.CO2 b.Ca(OH) 2 c.CaO d.NaHCO3 e.NaCl f.O2
常用作食品干燥剂的是 ▲ ;可改良酸性土壤的是 ▲ ;用于运动饮料生产的气体是 ▲ ;可作调味品的是 ▲ ;用于焙制糕点的是 ▲ ;可供给呼吸的是 ▲ 。
23.(9分)材料在生活中应用很广泛。
(1)下列生活物品属于无机材料的是 ▲ ;
A.玻璃杯 B.铁锅 C.塑料桶 D.玻璃钢转椅
(2)现行流通的硬币材质均为金属材料,如一元硬币是钢芯镀镍(Ni),伍角硬币是钢芯镀铜,一角硬币是铝合金或不锈钢。
①选择铸造硬币的材料不需要考虑的因素是 ▲ (填序号);
A.金属的导电性 B.金属的耐腐蚀性
C.金属的硬度 D.金属价格与硬币面值的吻合度
②五角硬币镀铜是因为常温下,铜的化学性质 ▲ (填“稳定”或“活泼”);
③钢是一种含碳量为 ▲ (填数值)的铁合金,其硬度比铁 ▲ (填“大”或“小”);
镍原子
④在一定条件下,镍在空气中会形成致密的氧化膜(NiO)
8
,反应的化学方程式为 ▲ 。镍和稀硫酸反应会生成硫酸镍(NiSO4)和一种可燃性气体单质,反应化学方程式为 ▲ ;
⑤根据右图镍原子的结构示意图回答:镍原子的原子序数是 ▲ ,在化学变化中易 ▲ 电子(填“得到”或“失去”)。
24.(8分)关注碳排放。
(1)化石燃料属于 ▲ (填“可再生”或“不可再生”)能源,请你推荐一种新型绿色的能源 ▲ ;
(2)下列做法不符合“低碳”生活理念的是 ▲ ;
A.使用一次性木筷和纸巾 B.推广电热水器 C.逐步淘汰白炽灯
33
32
31
30
傍晚温度
/℃
农村 城郊 Ⅰ Ⅱ 城郊 农村
(3)CO2过多排放是城市“热岛效应”的原因之一。右图中地点Ⅰ、Ⅱ分别为
▲ ;
A.农田、商业区
B.公园、居民区
C.市中心、公园
(4)下表是CO2排放系数及一个家庭的月消耗(产生)数量:
项目
电
液化石油气
自来水
垃圾
……
系数
0.36 kg/kwh
6.3 kg/m3
0.58 kg/m3
0.84 kg/ kg
……
数量(/月)
100 kwh
7 m3
5 m3
15 kg
……
则一个家庭每月至少排放 ▲ kg CO2;
(5)研究发现:CO2和H2在催化剂、加热条件下反应生成甲醇(CH4O)和水,反应的化学方程式为 ▲ 。金属铈(Ce)和CO2、H2O在900℃条件下反应,生成两种可燃性气体和CeO2,反应的化学方程式为 ▲ 。利用CO2和环氧乙烷制成的塑料无污染、易降解,可减少 ▲ 的发生。
四、(本小题包括1小题,每空1分,共10分)
25.(10分)现有下列装置,回答问题:
A B C D E
①
(1)写出有标号仪器的名称:① ▲ ;
(2)检查B装置的气密性的方法是: ▲ ,向长颈漏斗中加适量的水,若观察到长颈漏斗末端出现稳定的水柱,则装置不漏气;
8
(3)实验室制取H2的反应化学方程式为 ▲ ,发生装置为 ▲ ;
(4)实验发现:用40%的硫酸制取H2效果最好。现欲配制30mL 40%(密度为1.30g·mL—1)的硫酸,需要98%(密度为1.84g·mL—1)的浓硫酸 ▲ mL(精确到小数点后一位),需要水 ▲ mL(精确到小数点后一位)。量取浓硫酸时,若仰视读数(其他操作均正确),则所配硫酸的质量分数 ▲ 40%(填“>”或“=”或“<”),配制过程不需要的仪器是 ▲ ;
A.托盘天平 B.量筒 C.烧杯 D.玻璃棒 E.胶头滴管 F.铁架台
(5)实验室制取H2时,在硫酸溶液中滴入饱和CuSO4溶液会影响反应速率。右图是滴入饱和CuSO4溶液体积(X)与反应速率(Y)的关系图,请回答:
①滴入CuSO4溶液后,发生反应的化学方程式为 ▲ ;
②a点过后,反应速率降低的原因可能是 ▲ 。
五、(本小题包括1小题,共23分,除有说明的外,每空1分)
26.(23分)过碳酸钠(2Na2CO3·3H2O2)广泛用于洗涤、纺织、医疗、造纸等。某兴趣小组展开了深入的学习:
【资料卡片】:
1、过碳酸钠具有碳酸钠和过氧化氢的双重性质,不稳定,受热、遇水易分解;
2、过碳酸钠分解的化学方程式为2(2Na2CO3·3H2O2) == 4Na2CO3 + 6H2O + 3O2↑
3、H2O2分解放出热量,Na2CO3受热不分解;
Ⅰ、制备研究:下图是制备过碳酸钠的工艺流程。
洗涤
干燥
反应器
成品洗涤
晶体
母液
常温结晶
微量稳定剂
操作A
较多NaCl
Na2CO3溶液
30%H2O2溶液
请回答问题:
(1)反应器中发生反应的化学方程式为 ▲ ;
(2)生产中,反应及干燥均需在较低温度下进行,原因是 ▲ ;
(3)生产过程中,需加入较多的NaCl,以便过碳酸钠晶体析出,这是因为 ▲ 。
(4)操作A的名称是 ▲ ,若在实验室完成此操作,需要的玻璃仪器是烧杯、 ▲
和 ▲ ;
(5)洗涤过碳酸钠晶体最好选用 ▲ 。
A.蒸馏水 B.无水酒精 C.饱和碳酸钠溶液 D.饱和NaCl溶液
(6)母液可以循环使用,其中主要含有的溶质是 ▲ 和 ▲ ;
8
Ⅱ、纯度测定:测定过碳酸钠样品(杂质不溶于水)中2Na2CO3·3H2O2的质量分数。
小组同学设计了如下图所示实验装置(部分仪器略去),并进行实验。
水
A B
导管
【实验步骤】:① ▲ ;②将过碳酸钠样品(2.20g)和少许黑色粉末均匀混合后置于装置A中,在量筒中加满水;③连接仪器,打开分液漏斗活塞,缓缓滴入水;④待装置A中 ▲ 时,停止滴加水,并关闭活塞;⑤待量筒中水面不再变化时,记录其中水面刻度;⑥根据数据进行计算。
【实验分析及数据处理】:
(7)完善实验步骤的相关内容:① ▲ 、④ ▲ ;
(8)实验中,水的作用是 ▲ ;黑色粉末能加快过碳酸钠的分解速率,其自身质量和化学性质在反应前后均不变,可能是 ▲ (填化学式);
(9)实验中, ▲ ,则开始收集气体;(2分)
A.刚开始出现气泡时 B.当气泡均匀连续出现时
C.若用带火星木条放在导管口部,复燃时
(10)若量筒中收集到气体的体积是224mL(通常情况下,氧气的密度近似为1.43g·L—1。),计算过碳酸钠样品中2Na2CO3·3H2O2的质量分数[3分,Mr(2Na2CO3·3H2O2)=314、Mr(O2)=32] ▲ ;
【实验反思】:
(11)经过讨论,小组同学一致认为测定结果偏大,可能原因是 ▲ ;
(12)量筒中长导管的作用是 ▲ ;
(13)有同学提出,装置中原有空气会使测定结果偏大。这种说法是否正确,如不正确,请说明理由。 ▲ ;
(14)经过讨论,小组同学一致认为可用下述方案进行测定。方案:将装置A中剩余物过滤,洗涤滤渣,并将洗涤液并入滤液蒸发得无水固体1.39g。则样品中2Na2CO3·3H2O2的质量分数为 ▲ 。
(15)根据资料卡片,你还能设计出什么方案测定样品中2Na2CO3·3H2O2的质量分数? ▲ 。(只需给出简要的方案)
8
参考答案及评分标准
【评卷说明】
1、 所有专业术语、化学用语(符号、化学式等)错误均不给分。
2、 化学方程式中反应物或生成物书写错误、未配平不给分。
3、 文字表达只要答到关键词即可得分。
4、 答题中其它合理的说法和解法均可得分。
一 二、选择题(本题包括20小题,每小题2分,共40分)
题号
1
2
3
4
5
6
7
8
9
10
答案
B
A
B
C
D
A
C
C
D
D
题号
11
12
13
14
15
16
17
18
19
20
答案
B
A
C
C
C
B
AB
BC
AD
C
三、(本题包括4小题,每空1分,共27分)
+5
P
21.(4分)3O2 CH4 Al
22.(6分)c b a e d f
23.(9分)(1)AB (共1分,全对得1分) (2)①A ②稳定 ③0.03% ~ 2% 大
④2Ni + O2 == 2NiO Ni + H2SO4 == NiSO4 + H2↑ ⑤28 失去
催化剂
加热
24.(8分)(1)不可再生 太阳能等 (2)AB (3)C (4)95.6
900℃
(5)CO2 + 3H2 ====== CH4O + H2O Ce + CO2 + H2O ==== CeO2 + CO + H2 白色污染
四、(本题包括1小题,每空1分,共10分)
25.(10分)(1)铁架台 (2)堵住右侧导气管 (3)Zn + H2SO4 == ZnSO4 + H2↑ (或
Zn+2HCl=ZnCl2+ H2↑) B (4)8.7 23.0(或23.1) > AF (共1分,全对得1分)
(5)①Zn + CuSO4 == ZnSO4 + Cu ②生成的Cu覆盖在Zn表面,阻止反应进一步进行(或硫酸浓度变小,使反应速率降低)
五、(本题包括1小题,共23分,除有说明的外,每空1分)
26.(1)2Na2CO3 + 3H2O2 == 2Na2CO3·3H2O2 (2)防止过碳酸钠分解,影响产量和产率
8
(3)过碳酸钠在NaCl溶液中溶解度较小,易析出晶体
(4)过滤 玻璃棒 漏斗 (5)B (6)NaCl Na2CO3(或H2O2)
(7)检查气密性 不再产生气体时 (8)溶解过碳酸钠,利于其分解 MnO2(或CuO)
(9)A(2分)
(10)过碳酸钠分解产生氧气质量为224mL ×10—3×1.43g·L—1 = 0.32g ……………… 1分
2(2Na2CO3·3H2O2) ~ 3O2↑
314×2 32×3
X 0.32g
解得X=2.09g ……………………………………………………………… 1分
则样品中,2Na2CO3·3H2O2的质量分数为:(或95.2%)… 1分
(11)滴入的水占据了锥形瓶内的体积,使得O2体积偏大
(12)起缓冲作用,防止温度降低至室温时,测量结果产生偏差(或防倒吸)
(13)不正确,装置中原有空气和生成的O2等体积代换 (注:理由叙述不正确不给分)
(14)93.6%(或93.5%)
(15)想方法测出过碳酸钠和酸反应生成CO2的体积或质量,进而进行计算(或过碳酸钠和氯化钙、氯化钡等溶液生成沉淀质量进行测定)(其他合理答案也可得分)
8