- 335.50 KB
- 2021-11-11 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2019 年福建省初中毕业及高中阶段各类学校招生考试(化学) 试题
第Ⅰ卷
本卷共 10 小题,每小题 3 分,共 30 分。
1. 十一世纪,中国就用“卓筒井”凿井技术获取食盐。食盐的主要成分是( )
A.NaHCO3 B.Na2CO3 C.NaCl D.NaOH
2. 下列应用只涉及物质的物理性质的是( )
A.煤用作燃料 B.干冰用于人工降雨
C.熟石灰用于改良酸性土壤 D.生石灰用作干燥剂
3. 《化学通讯》报道:“人造肉汉堡”的研制被称为突破性技术,可以减轻畜牧业生产造成的环境污染。“人造肉”的营养价值接近真实肉类,它可以为人体补充的最重要的营养素 是 ( )
A.蛋白质 B.糖类 C.维生素 D.无机盐
4. 下图所示实验操作正确的是( )
A.稀释浓硫酸
B.倾倒液体
C.读取液体体积
D.点燃酒精灯
5. 高氯酸钾(KClO4)可用于制备火箭燃料。有关 KClO4 的说法正确的是( )
A.含 6 种元素 B.属于混合物
C.氯元素的化合价为+6 D.钾、氧元素的质量比为 39:64
6. 化学与生产、生活息息相关,下列说法错误的是( )
A. 油锅着火,可用锅盖盖灭
B. 港珠澳大桥使用的吊绳所含的聚乙烯纤维,属于有机合成材料C.洗洁精有乳化作用,可用来清洗油污
D.为延迟食品的保质期,可用福尔马林(甲醛的水溶液)作防腐剂
7. 一定条件下,水在密闭容器里的冷却过程中,温度和时间的关系如下图所示。①、②、
③表示水在不同时刻的存在状态,下列有关判断正确的是( )
A.水分子间的间隔:①>③
B.水分子的运动速率:②>① C.状态③的水分子静止不动D.①→②发生了化学变化
1. 下列实验操作不能达到实验目的的是( )
实验目的
实验操作
A
区别蚕丝与棉线
取样,灼烧,辨别气味
B
鉴别 H2SO4 溶液和 NaOH 溶液
取样,滴加酚酞溶液,观察现象
C
区别硬水和软水
取样,加肥皂水,振荡,观察现象
D
配制 100g 溶质质量分数为 20%的盐酸
将 20g 浓盐酸加入 80g 水中,充分搅拌
2. KNO3 的溶解度曲线如下图所示。下列说法错误的是( )
A.0~60℃,KNO3 的溶解度随温度升高而增大B.60℃时的 KNO3 饱和溶液降温至 20℃,有晶体析出C.20℃,100g 水中最多能溶解 31.6g KNO3
D.60℃时,可配制溶质质量分数为 60%的 KNO3 溶液
10.t℃时,加热烧杯中的石灰水,发现溶液变浑浊,测得此时溶液的 pH>7。关于溶液变浑浊的原因,同学们有两种观点:①Ca(OH)2 的溶解度随温度升高而减小;②Ca(OH)2 与空气中的 CO2 反应。他们设计以下方案进行探究,其中没有意义的是( )
A. 将装有浊液的烧杯,用冷水冷却,恢复至 t℃,观察浑浊是否消失
B. 取适量浊液,过滤,往滤渣中加入盐酸,观察是否有气泡产生
C. 取适量浊液,过滤,往滤液中加入 Na2CO3 溶液,观察是否有沉淀生成
D. 其他条件不变,隔绝空气,再做一个加热石灰水的对比实验
第Ⅱ卷
本卷共 8 题,共 70 分。
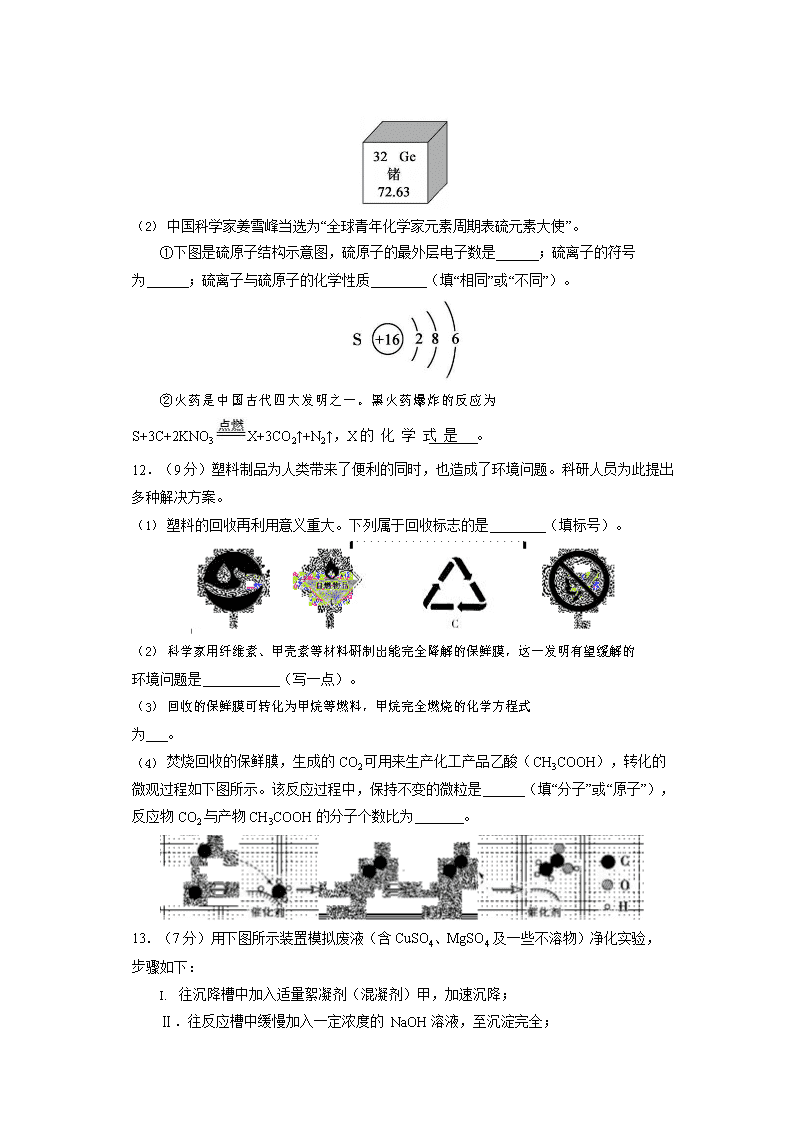
11.(7 分)2019 年是“国际化学元素周期表年”
(1) 中国科学院院士张青莲对铟、铱、锗等的相对原子质量的测定做出了杰出贡献。锗 元素在元素周期表中的部分信息如下图所示,锗的相对原子质量为 ,该元素属于
(填“金属元素”或“非金属元素”)。
(1) 中国科学家姜雪峰当选为“全球青年化学家元素周期表硫元素大使”。
①下图是硫原子结构示意图,硫原子的最外层电子数是 ;硫离子的符号为 ;硫离子与硫原子的化学性质 (填“相同”或“不同”)。
②火药是中国古代四大发明之一。黑火药爆炸的反应为S+3C+2KNO3 X+3CO2↑+N2↑,X 的 化 学 式 是 。
12.(9 分)塑料制品为人类带来了便利的同时,也造成了环境问题。科研人员为此提出多种解决方案。
(1) 塑料的回收再利用意义重大。下列属于回收标志的是 (填标号)。
(2) 科学家用纤维素、甲壳素等材料硏制岀能完全降解的保鲜膜,这一发明有望缓解的 环境问题是 (写一点)。
(3) 回收的保鲜膜可转化为甲烷等燃料,甲烷完全燃烧的化学方程式 为 。
(4) 焚烧回收的保鲜膜,生成的 CO2 可用来生产化工产品乙酸(CH3COOH),转化的微观过程如下图所示。该反应过程中,保持不变的微粒是 (填“分子”或“原子”), 反应物 CO2 与产物 CH3COOH 的分子个数比为 。
13.(7 分)用下图所示装置模拟废液(含 CuSO4、MgSO4 及一些不溶物)净化实验,步骤如下:
I. 往沉降槽中加入适量絮凝剂(混凝剂)甲,加速沉降;
Ⅱ.往反应槽中缓慢加入一定浓度的 NaOH 溶液,至沉淀完全;
Ⅲ.通过盛装有活性炭的水槽后,调节溶液的 pH=7,储存在指定容器中。
(1) 测得原废液 pH=5,显 (填“酸性”“碱性”或“中性”)。
(2) 甲是 (写物质名称);操作 X 可使固体与液体分离,操作 X 是 ;活性炭的作用是 。
(3) 反应槽中生成沉淀的化学方程式为 (写一个)。
14.(8 分)《天工开物》中介绍了锌的冶炼方法:把炉甘石(ZnCO3)和煤炭饼装入炼锌罐(如下图所示),泥封,“其底铺薪,发火煅红”“冷定毁罐取出”。(已知:锌的熔点 为 419℃,沸点为 907℃)
(1) 反应区中,ZnCO3 分解生成 ZnO 和另一种氧化物,反应的化学方程式
为 。C 与 ZnO 发生置换反应得到 Zn,反应中化合价升高的元素是 。
(2) 冷凝区中,锌由气态转化为液态,理论上该区应控制的温度范围是 ℃。
(3) “冷定”后方能“毁罐”取锌、从化学变化角度解释其原因: 。
15.(8 分)如下图所示,甲、乙、丙、丁、戊五种物质(或其溶液)俨然是滑冰赛道上参加接力比赛的“运动员”,相邻“运动员”之间能发生化学反应。已知:五种物质分别是 Fe、HCl、NaOH、CaCO3 和 CuCl2,中的一种,其中,甲是单质,丁与戊反应产生的气体可以熄灭终点的火炬。
(1) 甲能分别与另四种物质中的 、 反应(写化学式)。
(2) 丁与戊反应的化学方程式为 。
(3) 丙与丁的反应属于 (填基本反应类型)。
(4) 若把无机物按单质、氧化物、酸、碱和盐进行分类,无机物 X 的类别不同于上述五种物质,如果用 X 替换戊,它也能与丁反应生成一种生活中常用的液态灭火剂,X 是
(写一种)。
16.(10 分)实验室制取氧气并模拟氢氧焰实验。
(1) 用过氧化氢制取氧气(二氧化锰作催化剂)
①反应的化学方程式为 。
②仪器 A 的名称为 。现用下列仪器组装氧气的发生装置,应选用的仪器有
(填标号)。
③欲用浓硫酸干燥氧气,应从装置 F 的 (填“a”或“b”)处通入气体。
(2) 模拟氢氧焰实验:按下图所示装置进行实验
①关闭 K,通入氢气,点燃。为保证安全,点燃氢气之前应先 。将铁丝网放在火焰上灼烧,铁丝网只发红,不熔断。
②打开 K,通入氧气,火焰更明亮,铁丝熔断,说明燃烧的剧烈程度与氧气的 有关。
17.(17 分)某兴趣小组开展“测定密闭容器中某种气体的体积分数”的探究实验。
【实验 1】按图 1 所示装置,用红磷燃烧的方法测定空气中氧气的体积分数。
【实验 2】按图 2 所示装置,在集气瓶内壁用水均匀涂附铁粉除氧剂(其中辅助成分不干扰实验),利用铁锈蚀原理测定空气中氧气的体积分数。
(1) 实验 1 中,红磷燃烧的主要现象是 。红磷熄灭后,集气瓶冷却至室温,打开 K,水能倒吸入集气瓶的原因是 。
(2) 为提高实验的准确性,以上两个实验都需要注意的事项是 (写一点)。
(3) 实验过程中,连接数字传感器,测得实验 1、实验 2 中氧气的体积分数随时间变化的关系分别如图 3、图 4 所示。依据图 3、图 4 信息, (填"实验 1”或“实验 2") 的测定方法更准确,判断依据是 。
(4) 结合你的学习经验,若要寻找红磷或铁粉除氧剂的替代物。用图 1 或图 2 装置测定空气中氧气的体积分数,该替代物应满足的条件是 (写两点)。
【实验 3】测定用排空气法收集到的集气瓶中二氧化碳的体积分数。
(5) 甲同学设计图 5 所示装置进行测定。浓 NaOH 溶液的作用是 (用化学方程式表示)。
(6) 乙同学提出,仅利用图 6 所示装置,在不添加其他试剂的前提下,也能测得集气瓶中二氧化碳的体积分数。为达到实验目的,操作方法
是 。
18.(6 分)改革开放以来,我国钢铁工业飞速发展,近年来钢铁产量已稳居世界首位。
某钢铁厂采用赤铁矿(主要成分为 Fe2O3)炼铁,反应原理为 Fe2O3+3CO 2Fe+3CO2。若该厂日产含铁 1.4×104 t 的生铁,至少需要含 Fe2O3 80%的赤铁矿的质量是多少?(要求写出计算过程)
化学试题参考答案
第Ⅰ卷共 10 小题,每小题 3 分,共 30 分
1.C 2.B 3.A 4.B 5.D 6.D 7.A 8.D 9.D 10.C
第Ⅱ卷共 8 小题,共 70 分
11.(7 分)
(1)72.63 金属元素
(2)①6 S2- 不同 ②K2S 12.(9 分)
(1)C
(2)白色污染
(3)CH4+2O2 CO2+2H2O
(4)原子 1:1 13.(7 分)
(1) 酸性
(2) 明矾(或其他合理答案) 过滤 吸附
(3) CuSO4+2NaOH Na2SO4+Cu(OH)2↓[或 MgSO4+2NaOH Na2SO4+ Mg(OH)2↓]
14.(8 分)
(1)ZnCO3 ZnO+CO2↑ C(或“碳”)
(2)419~907
(3)防止生成的锌在较高温度下又被氧化成氧化锌(或“2Zn+O2 2ZnO”) 15.(8 分)
(1) HCl CuCl2(不分先后)
(2) CaCO3+2HCl CaCl2+CO2↑+H2O
(3) 复分解反应
(4) CuO(或“Fe2O3”等其他合理答案)
16.(10 分)
(1) ①2H2O2 2H2O+O2↑ ②锥形瓶 ACD ③a
(2) ①验纯 ②浓度
17.(15 分)
(1) 产生大量白烟(或“黄色火焰”“放热”等合理答案) 氧气被消耗,集气瓶内气体压强小于大气压
(1) 装置的气密性良好(或“红磷和铁粉除氧剂足量”等其他合理答案)
(2) 实验 2 反应后,实验 1 集气瓶中剩余氧气的体积分数为 8.6%,而实验 2 集气瓶中氧气几乎耗尽
(3) 能够和氧气反应;生成物不影响测定结果(或其他合理答案)
(5)2NaOH+CO2 Na2CO3+H2O
(6)用冰水冷却集气瓶,打开 K(或其他合理答案) 18.(6 分)
解:设需要赤铁矿的质量为 m。
Fe2O3+3CO 2Fe+3CO2
160 2×56
80% m 1.4×104t
m=2.5×104t
答:需要含 Fe2O3 80%赤铁矿的质量为 2.5×104t。
(注:其他合理解题方法可参照评分标准给分)
相关文档
- 2019年全国各地中考化学试题-重庆2021-11-1112页
- 2019年中考化学试题分类:3实验方案 2021-11-114页
- 2019年中考化学试题分类:3化学与人2021-11-117页
- 2019年中考化学试题分类:综合 解释2021-11-113页
- 2018年福建省中考化学试题(解析版)2021-11-1110页
- 2019年中考化学试题分类:无明显现象2021-11-111页
- 2019年全国各地中考化学试题-甘肃2021-11-117页
- 2019年中考化学试题分类:1物质的分2021-11-116页
- 2019年中考化学试题分类:综合 4气体2021-11-1132页
- 2019年中考化学试题分类:考点9 氧气2021-11-111页