- 170.37 KB
- 2021-11-11 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
(2019·重庆中考B)21.(5分)我国制碱工业的先驱——侯德榜成功地探索和改进了西方的制碱方法。下表为侯氏制碱法中部分物质的溶解度。
温度/℃
10
20
30
40
溶解度/g
Na2CO3
12.2
21.8
39.7
48.8
NaCl
35.8
36.0
36.3
36.6
NaHCO3
8.2
9.6
11.1
12.7
(1) 由上表可知,在10℃-40℃之间溶解度随温度变化最小的物质是 (填名称)。
(2) 40℃时,将等质量的三种表中物质的饱和溶液降温至20℃ ,所得溶液中溶质的质量分数由大到小的顺序是 (用化学式表示)。
(3) 侯氏制碱法制得的碱为纯碱,纯碱的化学式为 。
(4)制碱原理为向饱和的NaCl溶液中通人足量NH3和CO2生成NaHCO3晶体和NH4Cl,NaHCO3加热分解即制得纯碱。
①生成NaHCO3的化学方程式为 。
②结合上表分析,析出NaHCO3晶体的原因可能有 (填序号)。
A.溶剂质量减少
B.同温下NaHCO3溶解度小于NaCl
C.生成的NaHCO3质量大于消耗的NaCl质量
【答案】 (1)氯化钠 (2) NaCl、Na2CO3、NaHCO3(合理表达即可)
(3) Na2CO3;(4) H2O+NaCl+NH3+CO2=NH4Cl+NaHCO3↓ ABC
【解析】(1)根据表格判断在10℃-40℃之间溶解度随温度变化最小的物质是氯化钠;(2) 40℃时,将等质量的三种表中物质的饱和溶液降温至20℃ ,所得溶液仍然是饱和溶液,其溶液的 溶质质量分数=溶解度/(溶解度+100)×100%,即它们溶质的质量分数由大到小的顺序是NaCl、Na2CO3、NaHCO3(合理表达即可);(3) 纯碱是碳酸钠的化学式为Na2CO3 ; (4)根据反应物、生成物和反应条件判断生成NaHCO3的化学方程式为H2O+NaCl+NH3+CO2=NH4Cl+NaHCO3↓,溶剂质量减少、同温下NaHCO3溶解度小于NaCl
和生成的NaHCO3质量大于消耗的NaCl质量都能析出NaHCO3晶体。故选ABC。
(2019·济宁中考)我国科学家侯德榜在氨碱法的基础上创立了更为先进的联合制碱法(候氏制碱法),其生产流程简明如图1:
请读识流程图并回答下面问题:
(1)写出沉淀池中发生反应的化学方程式______;
(2)上述流程中气体X的化学式是______;
(3)沉淀池中晶体转移至焙烧炉时用到操作①,操作①的名称是______。16.【答案】NaCl+H2O+NH3+CO2=NH4Cl+NaHCO3 CO2 过滤
【解析】
解:(1)沉淀池中氯化钠和水和氨气和二氧化碳反应生成氯化铵和碳酸氢钠;故答案为:NaCl+H2O+NH3+CO2=NH4Cl+NaHCO3;
(2)上述流程中气体X是二氧化碳;故答案为:CO2;
(3)沉淀池中晶体转移至焙烧炉时用到操作①,操作①的名称是过滤;故答案为:过滤;
由题目的信息可知,(1)沉淀池中氯化钠和水和氨气和二氧化碳反应生成氯化铵和碳酸氢钠;
(2)上述流程中气体X是二氧化碳;
(3)过滤是固体和液体分开的一种方法。
本考点考查了纯碱的制取、混合物的分离、化学方程式的书写等,综合性强,要加强记忆、综合应用。
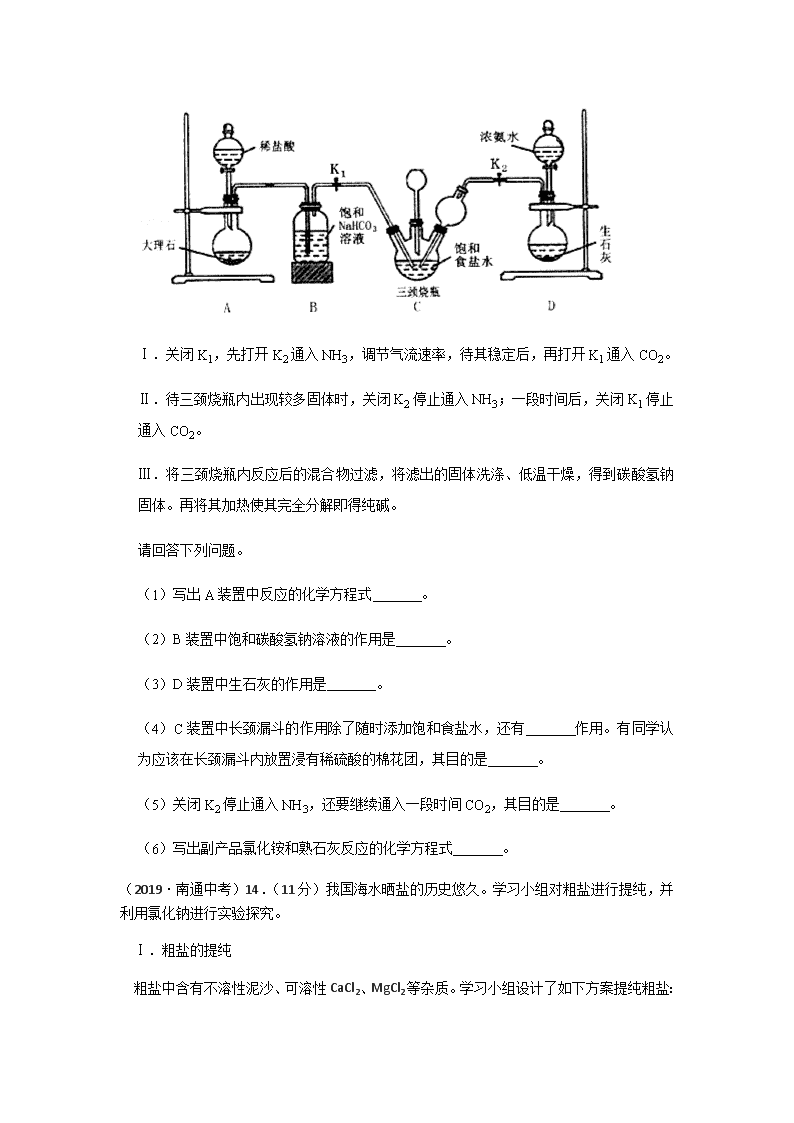
24.(7分)(2019•绥化)我国制碱工业采用联合制碱法生产纯碱,其反应原理如下:
NaCl+NH3+H2O+CO2═NaHCO3↓+NH4C1 2NaHCO3Na2CO3 H2O+CO2↑
【资料阅读】
①通常情况下,浓氨水具有较强的挥发性,易挥发出氨气。氨气是一种无色有刺激性气味的气体,极易溶于水,排放到空气中会污染空气。
②饱和碳酸氢钠溶液不能吸收二氧化碳。
化学兴趣小组在实验室模拟联合制碱法进行了如下实验:
Ⅰ.关闭K1,先打开K2通入NH3,调节气流速率,待其稳定后,再打开K1通入CO2。
Ⅱ.待三颈烧瓶内出现较多固体时,关闭K2停止通入NH3;一段时间后,关闭K1停止通入CO2。
Ⅲ.将三颈烧瓶内反应后的混合物过滤,将滤出的固体洗涤、低温干燥,得到碳酸氢钠固体。再将其加热使其完全分解即得纯碱。
请回答下列问题。
(1)写出A装置中反应的化学方程式 。
(2)B装置中饱和碳酸氢钠溶液的作用是 。
(3)D装置中生石灰的作用是 。
(4)C装置中长颈漏斗的作用除了随时添加饱和食盐水,还有 作用。有同学认为应该在长颈漏斗内放置浸有稀硫酸的棉花团,其目的是 。
(5)关闭K2停止通入NH3,还要继续通入一段时间CO2,其目的是 。
(6)写出副产品氯化铵和熟石灰反应的化学方程式 。
(2019·南通中考)14.(11分)我国海水晒盐的历史悠久。学习小组对粗盐进行提纯,并利用氯化钠进行实验探究。
Ⅰ.粗盐的提纯
粗盐中含有不溶性泥沙、可溶性CaCl2、MgCl2等杂质。学习小组设计了如下方案提纯粗盐:
(1)用化学方程式表示Na2CO3溶液的作用: 。
(2)“过滤”中玻璃棒的作用为 ;“操作X”的名称为 。
Ⅱ.探究氨盐水与二氧化碳的反应
步骤1 取50mL浓氨水于锥形瓶中,加入NaCl晶体至不再溶解,制得氨盐水。
步骤2 向烧瓶中加入20mL氨盐水和约16g干冰,塞紧瓶盖,振荡、静置。一段时间后溶液中析出细小晶体,过滤、用冷水洗涤晶体并低温干燥。
【提出问题】晶体的成分是什么?
【实验探究1】①经甲同学检验,晶体中不含铵盐。甲同学的实验操作及现象是
。
②乙同学取晶体少许,加入稀硝酸,晶体溶解并产生无色气体,再滴加几滴AgNO3溶液,未见明显现象,说明晶体中不含有 离子。
【提出猜想】晶体的成分为Na2CO3或NaHCO3或两者的混合物。
【查阅资料】Na2CO3受热不分解;
NaHCO3受热易分解:。
【实验探究2】称取m1 g晶体,利用下图装置(夹持仪器略)探究晶体的成分。
【实验现象】反应一段时间后,试管口凝结了少量小液滴,溶液变浑浊。
【实验分析】①晶体中一定含有 (填化学式)。
②将晶体加热至残留固体的质量不再改变,测得残留固体的质量为m2 g。
若 ,说明晶体为NaHCO3。
【拓展延伸】①氨盐水与二氧化碳反应所得铵盐的用途为 。
②丙同学认为通过测定装置B中沉淀的质量,经计算分析也可确定晶体的组成。请对丙同学的观点进行评价: 。
相关文档
- 2019年中考化学试题分类:常见气体的2021-11-111页
- 2019年中考化学试题分类:综合 1图像2021-11-117页
- 2019年中考化学试题分类:化学研究和2021-11-112页
- 2019年中考化学试题分类:考点8 空气2021-11-111页
- 2019年中考化学试题分类:考点20 燃2021-11-114页
- 2019年中考化学试题分类:考点8 空气2021-11-114页
- 2019年中考化学试题分类:2研究化学2021-11-118页
- 2019年中考化学试题分类:考点7 化学2021-11-112页
- 2019年中考化学试题分类:3实验方案 2021-11-114页
- 2019年中考化学试题分类:3化学与人2021-11-117页