- 446.31 KB
- 2021-11-12 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
25.(2019·徐州中考)某兴趣小组对氨气(NH3)的某些性质进行探究。
【实验回顾】(1)按图所示,在小烧杯 A 中盛有少量浓氨水,小烧杯 B 中盛有少量含酚酞试
液的蒸馏水,几分钟后,B 中溶液变红,原因是浓氨水挥发出的氨分子进入溶液中产生了
(填离子符号)。若取少许 B 中变红后的溶液在试管中加热,你认为溶液颜色会
(填“变深”“变浅”或“不变”)。
(2)图 2 是该小组对图 1 装置的改进,和图 1 相比,其优点有 (任写一条)。
【提出问题】氨气在水中的溶解性如何?
【查阅资料】常温常压下,氨气极易溶于水,可用图 3 装置验证。
【进行实验】步骤 1:按图 3 连接装置,检查气密性。
步骤 2:在干燥的烧瓶内充满氨气,塞上带有玻璃管和胶头滴管(预先吸入少量水)的胶塞,
把玻璃管插入烧杯的水中。
步骤 3:打开橡皮管上的止水夹, (填具体操作),使少量水进入烧瓶,观察到的现
象是 ,产生该现象的原因是 。
实验完毕,向烧瓶内的氨水中加入少量稀硫酸将其转化为可用作氮肥的(NH4)2SO4,该反应
的化学方程式为 。
【反思拓展】实验后请教老师知道,氨水中的 NH3 大部分与 H2O 结合成一水合氨(NH3·H2O),
则氨水中含有的分子有 H2O、 、 (都填化学式)。
答案:【实验回顾】(1)OH- 变浅 (2)环保(合理即可) 【进行实验】挤压胶头滴管
的 胶 帽 烧 杯 中 的 水 被 吸 入 烧 瓶 中 氨 气 溶 于 水 , 烧 瓶 内 气 压 小 于 大 气 压
2NH3·H2O+H2SO4=(NH4)2SO4+2H2O 【反思拓展】NH3·H2O NH3
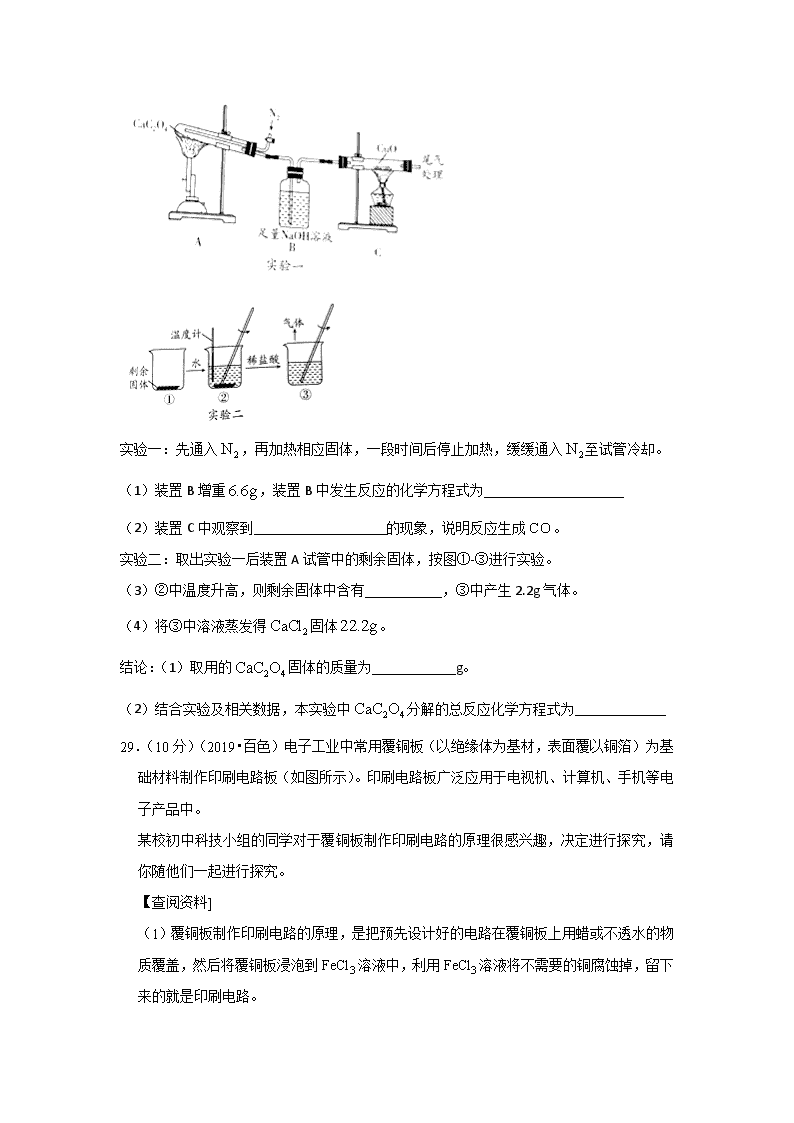
(2019·镇江中考)27.(7 分)草酸( )是一种酸,易溶于水。
(一)草酸的化学性质
(1)草酸溶液的 pH____________7(选填“>”“<”或“=”)。
(2)草酸溶液中加入石灰水,生成草酸钙( )固体,该反应的化学方程式为
_________________(二) 热分解探究
资料:
兴趣小组成一定量的 固体,在老师的指导下用下图装置进行实验。
2 2 4H C O
2 4CaC O
2 4CaC O
2 4 3CaC O CaCO CO∆ + ↑
2 4CaC O
实验一:先通入 ,再加热相应固体,一段时间后停止加热,缓缓通入 至试管冷却。
(1)装置 B 增重 ,装置 B 中发生反应的化学方程式为____________________
(2)装置 C 中观察到___________________的现象,说明反应生成 。
实验二:取出实验一后装置 A 试管中的剩余固体,按图①-③进行实验。
(3)②中温度升高,则剩余固体中含有___________,③中产生 2.2g 气体。
(4)将③中溶液蒸发得 固体 。
结论:(1)取用的 固体的质量为____________g。
(2)结合实验及相关数据,本实验中 分解的总反应化学方程式为_____________
29.(10 分)(2019•百色)电子工业中常用覆铜板(以绝缘体为基材,表面覆以铜箔)为基
础材料制作印刷电路板(如图所示)。印刷电路板广泛应用于电视机、计算机、手机等电
子产品中。
某校初中科技小组的同学对于覆铜板制作印刷电路的原理很感兴趣,决定进行探究,请
你随他们一起进行探究。
【查阅资料]
(1)覆铜板制作印刷电路的原理,是把预先设计好的电路在覆铜板上用蜡或不透水的物
质覆盖,然后将覆铜板浸泡到 FeCl3 溶液中,利用 FeCl3 溶液将不需要的铜腐蚀掉,留下
来的就是印刷电路。
2N 2N
6.6g
CO
2CaCl 22.2g
2 4CaC O
2 4CaC O
(2)FeCl3 溶液呈酸性,在与铜单质反应后 Fe3+变为 Fe2+,反应后有 Cu2+产生。
【提出问题】FeCl3 溶液为什么能将铜腐蚀掉?
【猜想假设】
(1)小明同学从资料中获知 FeCl3 溶液呈酸性,用石蕊试纸检验 FeCl3 溶液,试纸变
色,他认为一定是溶液中的 H+与 Cu 发生反应,将 Cu 腐蚀掉,但大家用 (填物
质的化学式)不能与 Cu 反应置换出氢气的知识否定小明的观点。
(2)小文同学认为可能是 FeCl3 溶液与铜发生了置换反应,Fe3+将铜置换成可溶于水的
Cu2+,大家也否定他的观点,因为置换反应原理是 ,而不是一种离子置换另一种
离子。
(3)根据查阅的信息,小丽同学认为这个腐蚀过程是一个新的反应,写出反应的化学方
程式 。
【原理分析】根据信息和上述反应的化学方程式,得知铁元素由+3 价下降为+2 价的特点,
从化合价的角度,小明同学又归纳出这个反应的另外两个特点:① ;② 。
【拓展研究】考虑到使用后的腐蚀液富含 Cu2+,具有很高的回收再利用价值,小组同学
继续进行回收探究。在 100mL 反应后的废液中投入足量的锌粉,析出 0.64gCu(若废液
中仍有 FeCl3 剩余,则锌粉先与 FeCl3 反应,再与氯化铜反应),则说明原来配制的 FeCl3
溶液浓度至少是 g/L(g/L 是质量体积浓度的单位,表示的是在每升溶液中所含溶
质的质量)。
【交流讨论】经思考,小丽同学推断 FeCl3 溶液作为腐蚀液也可以与 Fe 发生反应。
请写出她的推断依据: 。
34.(7 分)(2019•兰州)“鱼浮灵”是常用的化学增氧剂,主要成分是过氧碳酸钠(2Na2CO3
•3H2O2),溶于水能迅速增加水体溶氧量,提高鱼苗及活鱼运输成活率。某化学兴趣小组
对“鱼浮灵”的化学性质、增氧原理进行了探究。
【查阅资料】1.过氧碳酸钠具有碳酸钠和过氧化氢的双重性质,其水溶液中含有 Na+、
OH﹣、CO32﹣、H2O2。
2.Na+不能催化过氧化氢分解。
3.相同温度下,pH 相同的溶液,OH﹣的浓度也相同。
探究一 过氧碳酸钠的化学性质
实验步骤 实验现象 实验解释(化学方程式)
1.取样,溶于水,滴加 溶液 有白色沉淀生成 /
2.取样,溶于水,加入二氧化锰粉
末
探究二“鱼浮灵”增氧原理
【提出问题】过氧碳酸钠溶液中的哪种微粒对过氧化氢分解有催化作用?
【猜想假设】猜想一:CO32﹣ 猜想二:OH﹣猜想三:
【实验过程】相同温度下,进行 H2O2 溶液以及 H2O2 溶液中分别加 Na2CO3、NaOH 的实
验,测定相同时间内溶液的 pH、溶解氧含量(mg/L),数据如下:
实验序号 1 2 3 4
试剂 H2O2 H2O2+Na2CO3 H2O2+NaOH H2O2+NaOH
pH 6.01 8.14 8.14 9.26
溶解氧 6.44 9.11 9.11 10.97
【实验结论】对比实验数据,证明猜想 正确。
【反思交流】设计实验 2、3 的目的是 。
16.(6 分)(2019•新疆)粮食、蔬菜、肉类、豆制品等食物是我们日常营养的主要来源。
菠菜营养丰富,豆腐中含有丰富的蛋白质及钙盐等,但民间有“菠菜、豆腐不宜同食”
的说法。某化学兴趣小组针对此说法进行探究。
【查阅资料】①菠菜含有丰富的铁、草酸盐、碳酸盐等;②草酸钙(CaC2O4)不溶于水,
不易被人体吸收;③醋酸不与草酸钙反应,但能与碳酸钙反应生成可溶性盐等。
【提出猜想】“菠菜、豆腐不宜同食”的原因可能是 。
【实验探究】
(1)加入足量 CaCl2 溶液的目的是 。
(2)已知气体 C 能使澄清石灰水变浑浊,写出该反应的化学方程式 。
(3)醋酸的化学式可简写为 HAc.写出步骤④发生的化学反应方程式 。
(4)白色沉淀 B 的主要成分是 (填化学式)。可见菠菜中的草酸盐能与钙盐反应
生成草酸钙。
【反思与应用】家庭中常常将菠菜放在开水中烫过后再烹饪,其目的是 。
(2019·河北中考)35.兴趣小组在课外实验中意外发现:将镁条放入 Na?CO3 溶液中,快速
产生较多气泡,有白色沉淀生成。小组同学对此进行了系列探究活动。
探究 l:反应产生的气体是什么?
【作出猜想】小组同学经查阅资料和讨论,根据化学变化过程中元素不变,且反应物中含有
_____________________三种元素,作出如下猜想:
①氢气;②二氧化碳;③氢气和二氧化碳。
【实验 1】取适量镁条、100mLNa?CO:溶液于反应装置 A 中,按图 21 所示方案进行实验。B
中石灰水不变浑浊;C 处气体燃烧,烧杯内壁有水珠。说明猜想①正确。
(1)反应装置 A 应选用图 22 中的________(填写序号)。
(2)小组同学讨论认为,上述实验中“烧杯内壁有水珠”作为“反应产生的气体是氢气”
的证据不可靠。为使这一证据可靠,且仍能一次性地验证三个猜想,只需在图 21 所示方案
的基础上加以改进完善。你的改进方案是___________________________________________。
探究Ⅱ:快速产生气体的原因是什么?
【查阅资料】镁与水缓慢反应生成氢气;Na2CO3 溶液显碱性,其
溶液中除 Na+、퐶푂2―3 ”
外,还有 OH-。
【作出猜想】可能是 Na2CO3 溶液中的某一种离子促进了镁与水的
反应。
【实验 2】按图 23 所示方案进行实验。G、I 中缓慢产生气泡,H
中快速产生较多气泡,说明是퐶푂2―3 而不是 Na+、OH-促进了镁与水的反应。
(1)G 中实验的作用是________________。
(2)试剂 X 是________________________。
探究 III:反应产生的白色沉淀中是否含有 MgCO3?
【实验 3】取实验 1 反应生成的沉淀于试管中,加入试剂 Y,根据实验现象说明白色沉淀中
含 有 MgCO3 。 试 剂 Y 及 实 验 现 象 为
__________________________________________________;
该反应的化学方程式为___________________________________________________。
反思交流:有些伟大的发现就是从异常现象中得到启发,通过深入研究而实现的。
15.(7 分)(2019•孝感)超市出现了一种名为“污渍爆炸盐”的洗新产品,能在瞬间去除
洗衣粉难以除去的多种顽固污渍。某校化学兴趣小组的同学在老师的指导下对该产品开
展了以下探究活动。
【阅读标签】本产品不含 ,环保。
【查阅资料】①“污渍爆炸盐”的主要成分是过碳酸钠(Na2CO4),它是一种白色结晶
颗粒,易溶于水,且能与水反应,生成碳酸盐和其他化合物。
②氢氧化镁是不溶于水的白色固体。
【提出问题】“污渍爆炸盐”水溶液的成分是什么呢?
【作出猜想】猜想一:Na2CO3 和 H2O2 猜想二:Na2CO3 和 NaOH
猜想三:Na2CO3、H2O2 和 NaOH。
【实验探究】
序
号
实验步骤 实验现象 实验结
论
① 取少量“污渍爆炸盐”于烧杯中,加入足量蒸馏水充分
搅拌。
固体完全溶解形
成无色溶液
/
② 取适量①的溶液于试管中,先向其中加入少量二氧化锰
粉末,再将带火星的木条置于试管口
有大量气泡产生,
木条复燃
含有
③ 取适量①的溶液于试管中,向其中加入足量 ,
振荡、静置。
有白色淀产生 含有碳
酸钠
④ 取适量③的上层清液于试中,向其中滴加少量氯化镁溶
液,振荡
清液中 不含氢
氧化钠
【得出结论】猜想 正确。
请写出过碳酸钠与水反应的化学方程式: 。
8.(6 分)(2019•湖州)课堂上,老师演示氢气还原氧化铜实验时,试管内壁出现光亮的紫
红色。科学兴趣小组重做了这个实验,小明发现试管内壁显砖红色。为什么会出现不同
的颜色呢?是否产生了别的物质?
小明查阅了相关资料。
资料 1:氧化亚铜是砖红色不溶于水的固体
资料 2:氧化亚铜能与硫酸反应,化学方程式为 Cu2O+H2SO4=Cu+CuSO4+H2O
于是,小明往试管中加入一些稀硫酸浸泡一段时间后,根据产生的现象得出结论:附着
在试管内壁上的物质中含有氧化亚铜。
(1)得出“附着在试管内壁上的物质中含有氧化亚铜”这一结论,依据的现象是 。
(2)小明与其他几个兴趣小组的同学进行了交流,发现加热前:第一小组是在潮湿的试
管中加氧化铜粉未的;第二小组氧化铜粉末堆积在试管底部;第三小组氧化铜粉末薄薄
地平铺在试管内壁。三个小组其他操作都相同且规范。结果是第一、二小组实验后试管
内壁都显砖红色,第三小组试管内壁显光亮的紫红色。
通过比较分析,试管内壁出现砖红色物质的原因可能是 。
(3)第三小组实验虽然很成功,但是实验后试管内壁不容易清洗。老师告诉他们这是由
于氧化铜粉末铺在试管内壁上造成的。如何既让实验成功又不会在试管内壁留下难以清
洗的铜?小明经过思考重新设计了一个实验:他选择一束光亮的铜丝,对铜丝进行
处理,将处理过的铜丝代替氧化铜粉末进行验,达到了预期的效果。
(2019·北京中考)24.右图“黑面包”实验中,蔗糖(C12H22O11)变黑,体积膨胀,变成
疏松的炭,放出有刺激性气味的气体。
【提出问题】改变糖的种类、浓硫酸的体积、水的滴数和温度是否会影响实验效果呢?
【进行实验】分别取 5g 糖粉进行实验,根据前 2min 的现象对实验效果进行评分,
记录如下:
表 1 实验记录
实验 糖 浓硫酸体积/mL 水的滴数 温度/℃ 效果得分
1 蔗糖 4 5 22 65
2 蔗糖 5 10 30 81
3 蔗糖 6 15 50 93
4 冰糖 4 10 50 91
5 冰糖 5 15 22 88
6 冰糖 a 5 30 75
7 葡萄糖 4 15 30 0
8 葡萄糖 5 5 50 0
9 葡萄糖 6 10 22 0
【处理数据】分析表 1,计算效果得分均值,结果如下:
表 2 效果得分均值
糖 浓硫酸体积/mL 水的滴数 温度/℃因素
蔗糖 冰糖 葡萄糖 4 5 6 5 10 15 22 30 50
均值 79.7 84.7 0 52.0 56.3 56.0 46.7 57.3 60.3 51.0 52.0 61.3
依据均值推断最佳实验方案,均值越高,效果越好。
【解释与结论】
(1)蔗糖变成黑色的炭,发生了_____________(填“物理”或“化学”)变化。
(2)推测放出的气体含 SO2,从元素守恒角度说明理由:
________________________________。
(3)实验 6 中,a 为_____________mL。
(4)根据表 2 推断,“黑面包”实验最好选择 5g 冰糖、5mL 浓硫酸、_____滴水和 50℃
【反思与评价】
( 5 ) 表 2 中 , 22 ℃ 对 应 的 均 值 为 51.0, , 计 算 该 值 所 依 据 的 3 个 数 据 分 别 是
________________________________。
( 6 ) 综 合 分 析 , 使 实 验 3 的 效 果 得 分 高 于 实 验 4 的 因 素 有
________________________________。
28.(10 分)(2019•益阳)向一定量的 NaOH 溶液中慢慢通入 CO2 气体,看不到明显现象。
某实验小组的同学对所得溶液成分进行了如下探究。请你参与他们的探究活动,并完成
以下问题:
【提出问题】所得溶液中溶质的成分是什么?
【査阅资料】资料一:将 CO2 气体慢慢地通入一定量的 NaOH 溶液中,可能发生以下两
个化学反应:
先发生反应:2NaOH+CO2═Na2CO3+H2O
当 NaOH 反应完全后,继续发生反应:Na2CO3+CO2+H2O═2NaHCO3
資料二;Ca(HCO3)2 易溶于水;CaCl2 溶液与 NaCl 溶液均呈中性; NaHCO3 溶液呈
碱性,可使酚酞溶液变红色。
【猜想与假设】小组同学通过讨论,提出了以下四种猜想
猜想一:溶质为 NaOH 和 Na2CO3
猜想二:溶质全为 Na2CO3
(1)你认为猜想三:溶质为
猜想四:溶质全为 NaHCO3
【实验探究】小组同学设计并完成了如下实验:
实验步骤 实验过程 实验现象 实验结论
① 取适量反应后的溶液置于试管
中,加入过量 CaCl2 溶液
有白色沉淀生成 (2)猜想
不成立
② 取适量步骤①反应后的上层
清
液,滴加几滴酚酞溶液
(3)现象为 猜想二不成立
③ 取适量步骤①反应后的上层
清
液,加入适量稀 HCl
有气泡产生 (4)猜想
成立
【实验总结】针对上述实验,实验小组的同学总结并写出了上述探究过程中的各步反应
方程式。
(5)你认为步骤①发生反应的化学方程式是 。
(2019·无锡中考)20.(10分)水产养殖的速效增氧剂“鱼浮灵”的主要成分是过氧碳酸
钠( )。
某化学研究小组对“鱼浮灵”的制备、成分测定及增氧原理进行了如下探究。
【查阅资料】①过氧碳酸钠有 和 的双重性质;50℃开始分解。
②过氧碳酸钠在异丙醇(有机溶剂)中的溶解度较低。
Ⅰ.“鱼浮灵”的制备。
实验室用 与稳定剂的混合溶液和30%的 溶液反应制备过氧碳酸钠,实验装置
如图7所示。
(1)反应温度不能超过20℃的原因是________________________________。
(2)反应结束后,停止搅拌,向反应液中加入异丙醇,静置过滤、洗涤、干燥,获得过氧
碳酸钠固体。加入异丙醇的目的________________。
Ⅱ.“鱼浮灵”的成分测定。
【定性检测】检测过氧碳酸钠溶液中的成分。
(3)请补充完成下列实验报告中的相关内容。
实验序号 实验步骤 实验现象 解释或结论
① 取样,加入 粉末,
用带火星的木条伸入试管
内
木条复燃 反应的化学方程式
______________________
② ______________________ ______________________ 溶液中含有
【定量研究】测定“鱼浮灵”中过氧碳酸钠的组成。
实验③:称取一定质量的“鱼浮灵”样品于小烧杯中,加适量水溶解,向小烧杯中加入足量
2 3 2 2Na CO H Oa b⋅
2 3Na CO 2 2H O
2 3Na CO 2 2H O
2MnO
2 3Na CO
,溶液,过滤、洗涤、干燥,得到碳酸钡( )固体3.94g。
实验④:另称取相同质量的“鱼浮灵”样品于锥形瓶中,加入足量稀硫酸,再逐滴加入高锰
酸钾溶液,充分反应,消耗 的质量为1.896g,该反应的原理是:
。
(4)计算确定过氧碳酸钠( )的化学式(写出计算过程)。
Ⅲ.“鱼浮灵”的增氧原理。
研究小组通过测定常温下相同时间内水溶液中溶解氧的变化,探究 、 对
分解速率的影响,设计了对比实验,实验数据记录如下表。
编号 ① ② ③ ④ ⑤
试剂 溶液 固体
溶液
溶液
溶液
溶液
溶液
pH 6.96 6.01 8.14 8.15 9.26
溶解氧
( )
5.68 6.44 9.11 9.12 10.97
(5)由实验②可知,常温下,过氧化氢水溶液呈________(填“酸性”“中性”或“碱
性”)。
( 6 ) 过 氧 碳 酸 钠 可 以 速 效 增 氧 的 原 理 是
__________________________________________________________
_______________________________________________________________________________
____________。
2Ba(OH) 3BaCO
4KMnO
4 2 2 2 4 2 4 4 2 22KMnO 5H O 3H SO K SO 2MnSO 5O 8H O+ + = + + ↑ +
2 3 2 2Na CO H Oa b⋅
2
3CO − OH−
2 2H O
2H O 2 24%H O 2 3Na CO
2 24%H O
NaOH
2 24%H O
NaOH
2 24%H O
-1mg L⋅
相关文档
- 2019年中考化学试题分类:3一氧化碳2021-11-121页
- 2019年中考化学试题分类:考点21 化2021-11-121页
- 2019年中考化学试题分类:考点9 氧气2021-11-121页
- 2019年中考化学试题分类:10粗盐和提2021-11-123页
- 2019年中考化学试题分类:3化学与人2021-11-126页
- 2019年中考化学试题分类:考点13 溶2021-11-125页
- 2019年中考化学试题分类:考点20 燃2021-11-127页
- 2019年中考化学试题分类:化肥 1单一2021-11-123页
- 2019年中考化学试题分类:实验结论2021-11-121页
- 2019年中考化学试题分类:3综合 1合2021-11-122页