- 367.50 KB
- 2021-11-12 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2019年浙江省嘉兴市中考化学试卷
一、选择题(共4小题,每小题3分,满分12分)
1.(3分)地球上有丰富的水资源,科学家一直在研究成本低、效率高的催化剂,使水发生反应获得氢能源。下列说法错误的是( )
A.水是由氢元素和氧元素组成的化合物
B.保持水化学性质的最小微粒是氢原子和氧原子
C.水发生反应生成氢气和氧气属于分解反应
D.催化剂在化学反应前后化学性质和质量不发生改变
2.(3分)20℃时,把36克氯化钠放入64克水中,使其充分溶解(20℃时氯化钠的溶解度为36克)。对所得溶液的有关说法错误的是( )
A.该溶液是饱和溶液
B.溶液中Na+和Cl﹣个数一定相等
C.溶液质量为100克
D.溶质与溶剂质量比为9:25
3.(3分)科学兴趣小组对金属R的活动性探究时发现:将R放入稀硫酸中,有气泡产生,同时生成正二价的盐:将R放入ZnSO4溶液中无任何变化。根据以上信息,下列化学方程式正确的是( )
A.R+MgCl2=RCl2+Mg B.R+2AgCl=RCl2+2Ag
C.R+2HCl=RCl2+H2↑ D.Al+RSO4=AlSO4+R
4.(3分)小明在学习了元素和物质的知识后,进行了梳理,共中正确的是( )
A.铁元素的质量分数由高到低:FeO、Fe2O3、FeS
B.钙的化合物在水中的溶解性由大到小:CaCl2、CaCO3、Ca(OH)2
C.氮元素的化合价由高到低:HNO3、NH3、NO
D.空气中主要气体的体积分数由大到小:O2、N2、CO2
二、填空题(本每空格2分,共32分)
5.(4分)非洲的尼奥斯湖是火山口湖,湖底溶有大量含二氧化碳的火山气体。1986年8月21日,大量的降水使上层湖水变凉而下沉,下层湖水上涌,二氧化碳气体从水中逸出,并沿着山谷向下扩散,导致山脚的大量居民窒息死亡。根据以上信息回答:
(1)湖水上涌后,溶解的二氧化碳气体从水中逸出,是由于液体压强随深度的减小而 ,导致了二氧化碳的溶解性减小。
(2)逸出的二氧化碳气体沿着山谷向下扩散,是由于二氧化碳具有 的性质。
6.(4分)2019年是门捷列夫元素周期表诞生150周年。某拓展小组模仿门捷列夫用扑克牌寻找元素规律的方法,对部分元素进行排列,位置如图所示。
(1)根据规律,图中钠元素扑克牌应放入的位置是 (填序号)。
(2)拓展小组用同样方法将其它元素排入相应的位置,并从表中选出几种元素,与钠元素组成了一种能和稀硫酸反应的盐。请写出该盐与稀硫酸反应的化学方程式 。
7.(4分)质量守恒定律的发现,对科学的发展作出了重要贡献。
(1)为了验证质量守恒定律,实验小组分别选取以下四组药品,通过称量比较各组物质在密闭容器内混合前后的总质量,能达到目的有 。
A.氯化铁溶液和氢氧化钠溶液
B.生石灰和水
C.氯化钙溶液和硝酸钾溶液
D.碘和酒精
(2)在一定条件下,A和B反应生成C,微粒种类变化如图所示(“”、“”表示不同原子)
则参加反应的A、B物质的分子数之比为 。
三、实验探究题每空3分
8.(9分)小明发现某食品包装袋中有一个小袋,上面标有“成分:生石灰、铁粉;作用:防潮、防氧化”等字样。他想了袋内解粉末是否已失效,取少量粉末在水中充分溶解,滴入无色酚酞发现不变色。通过查阅资料获知,常温下铁在空气中不能反应生成Fe3O4
和FeO,于是对粉末成分做出如下猜想:
猜想一:可能是CaCO3和Fe;
猜想二:可能是CaCO3和Fe2O3;
猜想三:可能是 。
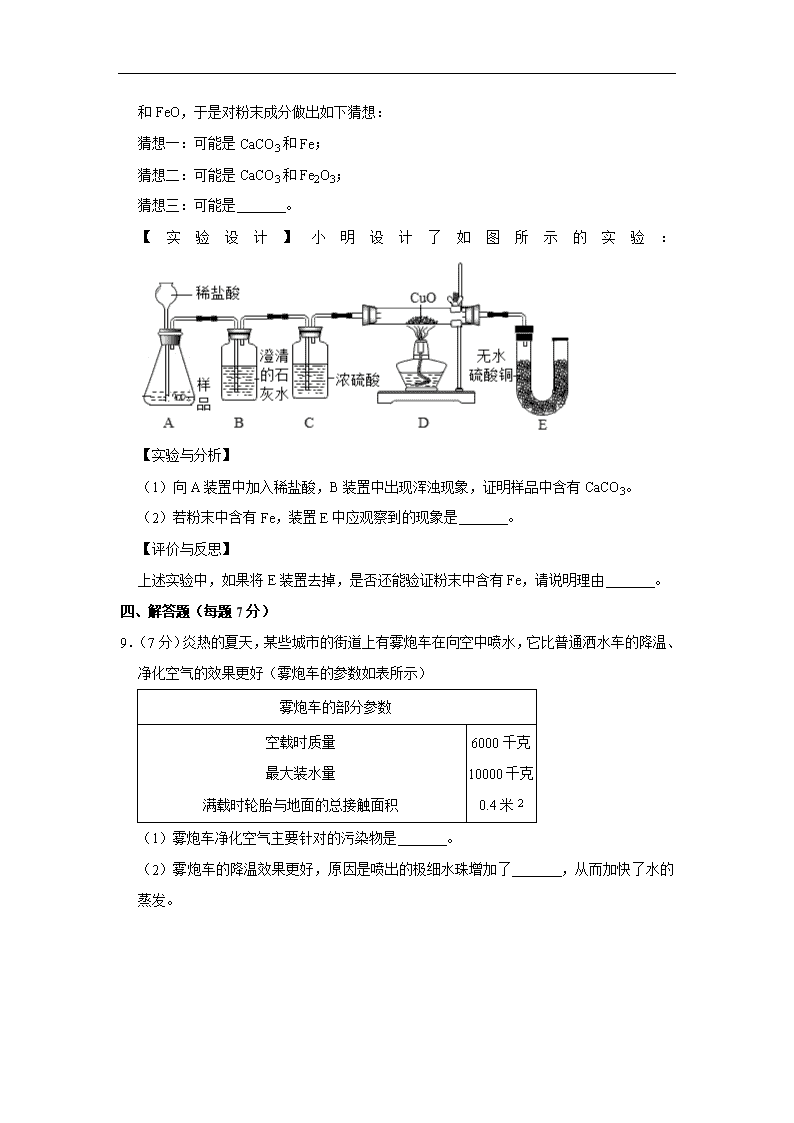
【实验设计】小明设计了如图所示的实验:
【实验与分析】
(1)向A装置中加入稀盐酸,B装置中出现浑浊现象,证明样品中含有CaCO3。
(2)若粉末中含有Fe,装置E中应观察到的现象是 。
【评价与反思】
上述实验中,如果将E装置去掉,是否还能验证粉末中含有Fe,请说明理由 。
四、解答题(每题7分)
9.(7分)炎热的夏天,某些城市的街道上有雾炮车在向空中喷水,它比普通洒水车的降温、净化空气的效果更好(雾炮车的参数如表所示)
雾炮车的部分参数
空载时质量
最大装水量
满载时轮胎与地面的总接触面积
6000千克
10000千克
0.4米2
(1)雾炮车净化空气主要针对的污染物是 。
(2)雾炮车的降温效果更好,原因是喷出的极细水珠增加了 ,从而加快了水的蒸发。
10.(7分)烟头掉落、炉火忘关……,稍不注意就可能引发火灾。如图是某型号的干粉灭火器的结构示意图。
(1)干粉灭火器使用时,拔下保险销,用于握紧压把,通过连杆把高压气体容器打开。“压把”属于 杠杆。
(2)打开高压气体容器后,气体充满整个筒体,粉末状的灭火剂就会喷射出来,此时喷管受到一股反冲力,这是由于 。
(3)某种于粉灭火剂的主要成分是碳酸氢钠。当干粉灭火剂喷射到燃烧区,即能灭火。已知:碳酸氢钠受热分解的化学方程式为:2NaHCO3Na2CO3+H2O+CO2↑
请结合燃烧的条件,简述该干粉灭火器灭火的原理。
11.(7分)为了使大众吃得明白、吃得健康,我国规定包装食品必须标注营养成分表,标注的内容包括能量以及4种核心营养素的含量值(碳水化合物即糖类),及其占营养素参考值的百分比(NRV%表示每100克该食品中,所含的营养素占人体一天所需该营养素的百分比)。
如图是某品牌饼干的营养成分表,请回答下列问题:
(1)每100克该种饼干中具有2369千焦能量,这些能量不可能来自4种营养素中的 。
(2)钠的过多摄入会引发高血压等慢性心血管疾病,因此国家卫计委推荐每人每食盐摄入量不超过6克,通过计算判断,按该企业依据的钠营养素标准,若人体摄入的钠全部来自食盐,则人体摄入的食盐量是否合卫计委的要求?(精确到小数点后一位)
三、选考部分B组
12.黄铜(铜和锌的合金)因性能优良,被广泛用于制作钱币、饰品和生产中,铜的质量分数在59%﹣65%之间的黄铜性能优良。兴趣小组为了解某黄铜螺母的材料性能进行如下实验:取多个黄铜螺母放入烧杯中,另取80克19.6%的稀硫酸,分四次等质量加入,每次均充分反应,实验过程数据记录如表。
实验次数
1
2
3
4
稀硫酸的用量/克
20
20
20
20
剩余固体的质量/克
20.0
17.4
14.8
13.5
分析上述数据,请回答下列问题:
(1)第4次实验结束后溶液的pH 7(选填“>”“=”或“<”)。
(2)配制80克溶质质量分数为19.6%的稀硫酸,需98%的浓硫酸(密度为1.84克/厘米3)多少毫升?(精确到小数点后一位)
(3)通过计算说明该黄铜螺母的材料性能是否优良。
13.用久的热水瓶内胆有一层水垢【主要成分是CaCO3和Mg(OH)2
】。兴趣小组为了解具体成分进行了实验。他们取样品25克放入质量为100克的锥形瓶中,置于电子天平上,往瓶内加入150克稀盐酸时,恰好完全反应(样品中的杂质不与稀盐酸反应),此时天平示数如图。对所得混合物进行过滤、洗涤、干燥、称量,得到固体4.2克。请回答下列问题:
(1)恰好完全反应时,溶液中的溶质为 (填化学式)。
(2)样品中CaCO3的质量分数是多少?
(3)反应结束时溶液中MgCl2的质量分数是多少?(精确到0.1%)。
2019年浙江省嘉兴市中考化学试卷
参考答案与试题解析
一、选择题(共4小题,每小题3分,满分12分)
1.(3分)地球上有丰富的水资源,科学家一直在研究成本低、效率高的催化剂,使水发生反应获得氢能源。下列说法错误的是( )
A.水是由氢元素和氧元素组成的化合物
B.保持水化学性质的最小微粒是氢原子和氧原子
C.水发生反应生成氢气和氧气属于分解反应
D.催化剂在化学反应前后化学性质和质量不发生改变
【分析】A、根据水的组成进行分析;
B、根据分子的定义及水的构成分析;
C、根据分解反应的概念进行分析;
D、根据催化剂的概念进行分析。
【解答】解:A、水是由氢元素和氧元素组成的化合物,故说法正确。
B、分子是保持物质化学性质的最小微粒,水是由水分子构成的,保持水化学性质的最小微粒是水分子,故说法错误。
C、水发生反应生成氢气和氧气,反应物是一种,生成物是两种,属于分解反应,故说法正确。
D、催化剂在化学反应前后化学性质和质量不发生改变,故说法正确。
故选:B。
【点评】本题难度不大,掌握保持水化学性质的最小微粒、分解反应的概念以及催化剂的概念等是正确解答本题的关键。
2.(3分)20℃时,把36克氯化钠放入64克水中,使其充分溶解(20℃时氯化钠的溶解度为36克)。对所得溶液的有关说法错误的是( )
A.该溶液是饱和溶液
B.溶液中Na+和Cl﹣个数一定相等
C.溶液质量为100克
D.溶质与溶剂质量比为9:25
【分析】溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量;溶解度定义中的四要素:一定温度、100g溶剂、溶液达到饱和状态、溶解的质量及单位克。
【解答】解:根据溶解度的概念,20℃时氯化钠的溶解度是36g,其涵义是20℃时,100g水中最多溶解36g氯化钠,溶液达到饱和状态。
A、20℃时,36克氯化钠放入64克水中,没有全部溶解,该溶液是饱和溶液,故选项说法正确。
B、根据NaCl中Na+和Cl﹣比例为1:1知,溶液中Na+和Cl﹣个数一定相等,故选项说法正确。
C、20℃时,64克水中最多溶解23.04克氯化钠,故该溶液的质量是87.04克,故选项说法错误。
D、20℃时,氯化钠的溶解度为36克,则溶质与溶剂质量比为:36:100=9:25,故选项说法正确。
故选:C。
【点评】本题难度不大,理解溶解度的概念,熟记溶解度的四要素(温度、100g溶剂、饱和状态、单位是克)是正确解答本题的关键。
3.(3分)科学兴趣小组对金属R的活动性探究时发现:将R放入稀硫酸中,有气泡产生,同时生成正二价的盐:将R放入ZnSO4溶液中无任何变化。根据以上信息,下列化学方程式正确的是( )
A.R+MgCl2=RCl2+Mg B.R+2AgCl=RCl2+2Ag
C.R+2HCl=RCl2+H2↑ D.Al+RSO4=AlSO4+R
【分析】根据金属活动顺序和化学方程式的书写进行分析。
【解答】将R放入稀硫酸中,有气泡产生,说明在金属活动顺序中R在氢的前面;将R放入ZnSO4溶液中无任何变化,说明R在Zn的后面。
A.根据以上分析可知,在金属活动顺序中,R在镁的后面,R不能置换出氯化镁中的镁,故A错误;
B.因为氯化银不溶于水形不成溶液,所以R不能置换出氯化银中的银,故B错误;
C.在金属活动顺序中,R在氢的前面,在化合物中显+2价,R+2HCl=RCl2+H2↑能够反应,故C正确;
D.铝元素在形成化合物时显+3价,与RSO4反应的化学方程式为:2Al+3RSO4=Al2(SO4)
3+3R,故D错误。
故选:C。
【点评】本题考查了金属活动顺序的应用和化学方程式的书写,有一定的难度,掌握相应的知识是解答本题的关键。
4.(3分)小明在学习了元素和物质的知识后,进行了梳理,共中正确的是( )
A.铁元素的质量分数由高到低:FeO、Fe2O3、FeS
B.钙的化合物在水中的溶解性由大到小:CaCl2、CaCO3、Ca(OH)2
C.氮元素的化合价由高到低:HNO3、NH3、NO
D.空气中主要气体的体积分数由大到小:O2、N2、CO2
【分析】A、根据化合物中元素质量分数的比较方法来分析;
B、根据物质的溶解性来分析;
C、根据在化合物中正负化合价代数和为零,结合各选项中的化学式进行分析;
D、根据空气的组成及其含量来分析。
【解答】解:A、在FeO、Fe2O3、FeS三种含铁化合物中,将化学式变形得①6FeO ②3Fe2O3③6FeS,因32×6>16×3×3>16×6,含铁的质量分数由大到小排列为FeO>Fe2O3>FeS,故A正确;
B、碳酸钙不溶于水、氢氧化钙微溶于水,氯化钙能溶于水,故B错误;
C、根据在化合物中正负化合价代数和为零,HNO3、NH3、NO中氮元素的化合价分别为+5、﹣3、+2,故C错误;
D、空气中氮气的体积分数为78%,氧气约为21%,二氧化碳约为0.03%,故D错误;
故选:A。
【点评】明确化合物中元素质量分数的比较方法、物质的溶解性、化合物中元素化合价的计算、以及空气的组成及其含量是解题的关键。
二、填空题(本每空格2分,共32分)
5.(4分)非洲的尼奥斯湖是火山口湖,湖底溶有大量含二氧化碳的火山气体。1986年8月21日,大量的降水使上层湖水变凉而下沉,下层湖水上涌,二氧化碳气体从水中逸出,并沿着山谷向下扩散,导致山脚的大量居民窒息死亡。根据以上信息回答:
(1)湖水上涌后,溶解的二氧化碳气体从水中逸出,是由于液体压强随深度的减小而 减小 ,导致了二氧化碳的溶解性减小。
(2)逸出的二氧化碳气体沿着山谷向下扩散,是由于二氧化碳具有 密度比空气大
的性质。
【分析】(1)根据气体的溶解度随着压强的增大而增大,进行分析解答。
(2)根据逸出的二氧化碳气体沿着山谷向下扩散,进行分析解答。
【解答】解:(1)气体的溶解度随着压强的增大而增大,湖水上涌后,溶解的二氧化碳气体从水中逸出,是由于液体压强随深度的减小而减小,导致了二氧化碳的溶解性减小。
(2)逸出的二氧化碳气体沿着山谷向下扩散,是由于二氧化碳具有密度比空气大的性质。
故答案为:
(1)减小;
(2)密度比空气大。
【点评】本题难度不大,掌握气体溶解度的两个影响因素(温度、压强)、二氧化碳的物理性质是正确解答本题的关键。
6.(4分)2019年是门捷列夫元素周期表诞生150周年。某拓展小组模仿门捷列夫用扑克牌寻找元素规律的方法,对部分元素进行排列,位置如图所示。
(1)根据规律,图中钠元素扑克牌应放入的位置是 ③ (填序号)。
(2)拓展小组用同样方法将其它元素排入相应的位置,并从表中选出几种元素,与钠元素组成了一种能和稀硫酸反应的盐。请写出该盐与稀硫酸反应的化学方程式 Na2CO3+2HCl═2NaCl+H2O+CO2↑ 。
【分析】(1)根据元素中间的符号、符号的个数,进行分析解答。
(2)与钠元素组成了一种能和稀硫酸反应的盐,该盐可以是碳酸钠,碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,进行分析解答。
【解答】解:(1)表示钠元素的扑克牌中间的符号是黑桃,且数量是3个,则图中钠元素扑克牌应放入的位置是③。
(2)与钠元素组成了一种能和稀硫酸反应的盐,该盐可以是碳酸钠,碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2
↑。
故答案为:
(1)③;
(2)Na2CO3+2HCl═2NaCl+H2O+CO2↑。
【点评】本题难度不大,理解题意,掌握盐的化学性质、化学方程式的书写方法等是正确解答本题的关键。
7.(4分)质量守恒定律的发现,对科学的发展作出了重要贡献。
(1)为了验证质量守恒定律,实验小组分别选取以下四组药品,通过称量比较各组物质在密闭容器内混合前后的总质量,能达到目的有 AB 。
A.氯化铁溶液和氢氧化钠溶液
B.生石灰和水
C.氯化钙溶液和硝酸钾溶液
D.碘和酒精
(2)在一定条件下,A和B反应生成C,微粒种类变化如图所示(“”、“”表示不同原子)
则参加反应的A、B物质的分子数之比为 2:1 。
【分析】化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
【解答】解:(1)A.氯化铁溶液和氢氧化钠溶液反应生成氢氧化铁沉淀和氯化钠,可以验证质量守恒定律;
B.生石灰和水反应生成氢氧化钙,可以验证质量守恒定律;
C.氯化钙溶液和硝酸钾溶液不能反应,不能验证质量守恒定律;
D.碘和酒精不能反应,不能验证质量守恒定律。
故填:AB。
(2)反应前后原子总个数不变,ABC分子个数比是2:1:2时,恰好遵循质量守恒定律。
故填:2:1。
【点评】化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
三、实验探究题每空3分
8.(9分)小明发现某食品包装袋中有一个小袋,上面标有“成分:生石灰、铁粉;作用:防潮、防氧化”等字样。他想了袋内解粉末是否已失效,取少量粉末在水中充分溶解,滴入无色酚酞发现不变色。通过查阅资料获知,常温下铁在空气中不能反应生成Fe3O4和FeO,于是对粉末成分做出如下猜想:
猜想一:可能是CaCO3和Fe;
猜想二:可能是CaCO3和Fe2O3;
猜想三:可能是 CaCO3、Fe、Fe2O3 。
【实验设计】小明设计了如图所示的实验:
【实验与分析】
(1)向A装置中加入稀盐酸,B装置中出现浑浊现象,证明样品中含有CaCO3。
(2)若粉末中含有Fe,装置E中应观察到的现象是 无水硫酸铜遇水变蓝色 。
【评价与反思】
上述实验中,如果将E装置去掉,是否还能验证粉末中含有Fe,请说明理由 能,能通过D中氧化铜的颜色变化来判断 。
【分析】猜想三:根据可能是三者的混合物,进行分析解答。
【实验与分析】(2)若粉末中含有Fe,铁能与稀盐酸反应生成氢气,氢气能与氧化铜反应生成铜和水蒸气,进行分析解答。
【评价与反思】根据氢气具有还原性,进行分析解答。
【解答】解:猜想三:可能是三者的混合物,可能是CaCO3、Fe、Fe2O3。
【实验与分析】(2)若粉末中含有Fe,铁能与稀盐酸反应生成氢气,氢气能与氧化铜反应生成铜和水蒸气,无水硫酸铜遇水变蓝色,则会观察到无水硫酸铜遇水变蓝色。
【评价与反思】氢气具有还原性,在加热条件下能与氧化铜反应生成铜和水,D中会观察到黑色粉末逐渐变红。
故答案为:
猜想三:CaCO3、Fe、Fe2O3;
【实验与分析】(2)无水硫酸铜遇水变蓝色;
【评价与反思】能,能通过D中氧化铜的颜色变化来判断。
【点评】本题难度不大,理解题意,掌握水蒸气的检验方法、氢气的化学性质等是正确解答本题的关键。
四、解答题(每题7分)
9.(7分)炎热的夏天,某些城市的街道上有雾炮车在向空中喷水,它比普通洒水车的降温、净化空气的效果更好(雾炮车的参数如表所示)
雾炮车的部分参数
空载时质量
最大装水量
满载时轮胎与地面的总接触面积
6000千克
10000千克
0.4米2
(1)雾炮车净化空气主要针对的污染物是 颗粒物 。
(2)雾炮车的降温效果更好,原因是喷出的极细水珠增加了 液体表面积 ,从而加快了水的蒸发。
【分析】空气污染的途径主要有两个:有害气体和粉尘。有害气体主要有一氧化碳、二氧化硫、二氧化氮等气体;粉尘主要指一些固体小颗粒。雾炮车净化空气主要针对的污染物是:颗粒物;雾炮车的降温效果更好,原因是喷出的极细水珠增加了液体表面积,从而加快了水的蒸发。
【解答】解:(1)雾炮车净化空气主要针对的污染物是:颗粒物;故答案为:颗粒物;
(2)雾炮车的降温效果更好,原因是喷出的极细水珠增加了液体表面积,从而加快了水的蒸发;故答案为:液体表面积;
【点评】环保问题已经引起了全球的重视,关于“三废”的处理问题,是中考的热点问题,化学上提倡绿色化学工艺,要从源头上杜绝污染。
10.(7分)烟头掉落、炉火忘关……,稍不注意就可能引发火灾。如图是某型号的干粉灭火器的结构示意图。
(1)干粉灭火器使用时,拔下保险销,用于握紧压把,通过连杆把高压气体容器打开。“压把”属于 省力 杠杆。
(2)打开高压气体容器后,气体充满整个筒体,粉末状的灭火剂就会喷射出来,此时喷管受到一股反冲力,这是由于 力的作用是相互的 。
(3)某种于粉灭火剂的主要成分是碳酸氢钠。当干粉灭火剂喷射到燃烧区,即能灭火。已知:碳酸氢钠受热分解的化学方程式为:2NaHCO3Na2CO3+H2O+CO2↑
请结合燃烧的条件,简述该干粉灭火器灭火的原理。
碳酸氢钠喷射到可燃物上受热会分解生成水和二氧化碳,水汽化吸热降低可燃物的温度,由因为二氧化碳不燃烧、也不支持燃烧,密度比空气大,会覆盖在可燃物的表面而隔绝氧气,从而起到灭火的作用
【分析】(1)根据杠杆的工作原理来分析;
(2)根据力的性质来分析;
(3)根据物质的性质以及燃烧的条件来分析。
【解答】解:(1)“压把”的动力臂大于阻力臂,属于省力杠杆;故填:省力;
(2)力的作用是相互的,所以打开高压气体容器后,气体充满整个筒体,粉末状的灭火剂就会喷射出来,此时喷管受到一股反冲力,故填:力的作用是相互的;
(3)碳酸氢钠受热会分解生成水和二氧化碳,水汽化吸热降低可燃物的温度,由因为二氧化碳不燃烧、也不支持燃烧,密度比空气大,会覆盖在可燃物的表面而隔绝氧气,从而起到灭火的作用;故填:碳酸氢钠喷射到可燃物上受热会分解生成水和二氧化碳,水汽化吸热降低可燃物的温度,由因为二氧化碳不燃烧、也不支持燃烧,密度比空气大,会覆盖在可燃物的表面而隔绝氧气,从而起到灭火的作用。
【点评】本题考查了根据灭火原理的知识进行解题的能力。
11.(7分)为了使大众吃得明白、吃得健康,我国规定包装食品必须标注营养成分表,标注的内容包括能量以及4种核心营养素的含量值(碳水化合物即糖类),及其占营养素参考值的百分比(NRV%表示每100克该食品中,所含的营养素占人体一天所需该营养素的百分比)。
如图是某品牌饼干的营养成分表,请回答下列问题:
(1)每100克该种饼干中具有2369千焦能量,这些能量不可能来自4种营养素中的 钠 。
(2)钠的过多摄入会引发高血压等慢性心血管疾病,因此国家卫计委推荐每人每食盐摄入量不超过6克,通过计算判断,按该企业依据的钠营养素标准,若人体摄入的钠全部来自食盐,则人体摄入的食盐量是否合卫计委的要求?(精确到小数点后一位)
【分析】(1)根据能提供能量的是糖类(碳水化合物)、脂肪(或油脂)、蛋白质进行分析;
(2)根据相关数据进行计算。
【解答】解:(1)在人体所需的六大营养中,能提供能量的是糖类(碳水化合物)、脂肪(或油脂)、蛋白质,其中钠不能提供能量;
(2)人体摄入的钠量为:400mg÷20%=2000mg=2g
含有2g钠元素食盐的质量为:
2g÷=5.1g<6g
人体摄入的食盐质量符合卫计委的要求。
故答案为:
(1)钠;
(2)人体摄入的食盐质量符合卫计委的要求。
【点评】关注生命,呵护健康,是人类不断探求的永恒主题,它既是社会热点,也是重要的中考热点之一。
三、选考部分B组
12.黄铜(铜和锌的合金)因性能优良,被广泛用于制作钱币、饰品和生产中,铜的质量分数在59%﹣65%之间的黄铜性能优良。兴趣小组为了解某黄铜螺母的材料性能进行如下实验:取多个黄铜螺母放入烧杯中,另取80克19.6%的稀硫酸,分四次等质量加入,每次均充分反应,实验过程数据记录如表。
实验次数
1
2
3
4
稀硫酸的用量/克
20
20
20
20
剩余固体的质量/克
20.0
17.4
14.8
13.5
分析上述数据,请回答下列问题:
(1)第4次实验结束后溶液的pH < 7(选填“>”“=”或“<”)。
(2)配制80克溶质质量分数为19.6%的稀硫酸,需98%的浓硫酸(密度为1.84克/厘米3)多少毫升?(精确到小数点后一位)
(3)通过计算说明该黄铜螺母的材料性能是否优良。
【分析】根据第二次和第三次固体都是减少了2.6g,所以第一次也是减少2.6g,所以样品质量为20g+2.6g=22.6g,而第四次只减少了1.3g,所以此时硫酸过量。根据溶液稀释过程中溶质的质量不变求算需要的浓硫酸的体积(不是质量)。结合生成固体的质量求算样品中铜的质量分数,进而与标准对比分析。
【解答】解:
根据第二次和第三次固体都是减少了2.6g,所以第一次也是减少2.6g,所以样品质量为20.0g+2.6g=22.6g,而第四次只减少了1.3g,所以此时硫酸过量。所以第4次实验结束后溶液的pH<7。
根据溶液稀释过程中溶质的质量不变,配制80克溶质质量分数为19.6%的稀硫酸,需98%的浓硫酸(密度为1.84克厘米3)。设需要的浓硫酸的体积为x
x×1.84克/厘米3×98%=80g×19.6%
x≈8.7厘米3=8.7mL
样品中铜的质量分数为×100%≈59.7%介于59%﹣65%之间,所以性能优良。
故答案为:
(1)<;
(2)8.7mL;
(3)优良。
【点评】溶液稀释过程中溶质的质量不变,求算时注意确定求算体积还是质量。
13.用久的热水瓶内胆有一层水垢【主要成分是CaCO3和Mg(OH)2】。兴趣小组为了解具体成分进行了实验。他们取样品25克放入质量为100克的锥形瓶中,置于电子天平上,往瓶内加入150克稀盐酸时,恰好完全反应(样品中的杂质不与稀盐酸反应),此时天平示数如图。对所得混合物进行过滤、洗涤、干燥、称量,得到固体4.2克。请回答下列问题:
(1)恰好完全反应时,溶液中的溶质为 CaCl2和MgCl2 (填化学式)。
(2)样品中CaCO3的质量分数是多少?
(3)反应结束时溶液中MgCl2的质量分数是多少?(精确到0.1%)。
【分析】根据质量守恒定律可知,过程中质量的减少是因为生成了二氧化碳,所以可以求算二氧化碳的质量,根据二氧化碳的质量和对应的化学方程式求算碳酸钙的质量,进而确定氢氧化镁的质量,然后结合对应的化学方程式求算氯化镁质量,进而求算其质量分数。
【解答】解:恰好完全反应时,碳酸钙转化为氯化钙,氢氧化镁转化为氯化镁,所以对应的溶质的化学式为 CaCl2和MgCl2。
根据质量守恒定律可得,生成的二氧化碳的质量为25g+100g+150g﹣268.4g=6.6g
设碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 6.6g
=
x=15g
样品中CaCO3的质量分数为×100%=60%
则样品中氢氧化镁的质量为25g﹣15g﹣4.2g=5.8g
设生成的氯化镁的质量为y
Mg(OH)2+2HCl═MgCl2+2H2O
58 95
5.8g y
=
y=9.5g
反应结束时溶液中MgCl2的质量分数为×100%=5.8%
故答案为:
(1)CaCl2和MgCl2。
(2)60%。
(3)5.8%。
【点评】根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
声明:试题解析著作权属菁优网所有,未经书面同意,不得复制发布
日期:2019/6/25 17:47:15;用户:初中校园号;邮箱:wjwl@xyh.com;学号:24424282
相关文档
- 2020年湖南省永州市中考化学试卷(wo2021-11-1210页
- 2020年浙江省舟山市中考化学试卷【2021-11-124页
- 2020年山东省济宁市中考化学试卷【2021-11-125页
- 2019年湖南省怀化市中考化学试卷2021-11-1230页
- 2019年四川省攀枝花市中考化学试卷2021-11-1224页
- 2020年四川省达州市中考化学试卷【2021-11-128页
- 2019年湖北孝感中考化学试卷(解析版2021-11-117页
- 2020年湖南省怀化市中考化学试卷【2021-11-117页
- 2019年广西贵港市中考化学试卷(WOR2021-11-1110页
- 2019年海南省中考化学试卷(word版,2021-11-1112页