- 134.00 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第15讲 溶液的浓度
一、选择题
1.(2016·广州)某温度时,将20 g KNO3溶解在100 g水中恰好饱和,关于该饱和溶液的叙述正确的是(导学号 29322109)( D )
A.m(溶质)∶m(溶剂)=20∶120
B.溶质的质量分数为20%
C.升温后,溶质的质量分数增大
D.降温后,有固体析出
2.将80 g质量分数为35%的硫酸溶液,稀释成10%的稀硫酸,需加水的质量为( C )
A.80 g B.100 g
C.200 g D.280 g
3.(2016·淄博)如图为实验室新购置的盐酸试剂瓶标签上的内容,用掉一部分盐酸后(忽略盐酸的挥发),不能再表示试剂瓶中剩余盐酸信息的是( D )
A.37% B.36.5
C.1.19 g/cm3 D.500 mL
4.(2016·福州)实验室配制一定溶质质量分数的稀硫酸并用其除铁锈,部分操作如图所示,其中正确的是( B )
5.(2016·湘潭)下列关于溶液的说法错误的是( C )
A.固体、液体、气体都可以做溶质
B.NH4NO3溶解过程中吸热,溶液温度降低
C.欲将100克KNO3溶液的质量分数由5%变成10%,可向其加入5克KNO3固体
D.25 ℃时,将某KNO3溶液蒸发10克水析出a克晶体,再蒸发10克水析出b克晶体,a与b的质量不一定相等
6.(2016·泰安)在配制一定溶质质量分数的蔗糖溶液时,导致溶液中蔗糖的质量分数偏大的可能原因有(导学号 29322110)( A )
A.用量筒量取水时俯视读数
B.用来配制溶液的烧杯刚用少量蒸馏水润洗过
C.用托盘天平称取蔗糖时,将蔗糖放在右盘,且称量时使用了游码
D.用了含少量杂质的蔗糖配制溶液
7.(2016·淄博)一定温度下,向图Ⅰ烧杯中加入一定量的水,如图Ⅱ所示,所得溶液与原溶液相比,下列判断一定正确的是(导学号 29322111)( C )
A.所得溶液是饱和溶液
B.溶质的质量分数变大
C.溶质的质量增加
D.溶质的溶解度变大
8.实验室配制50 g溶质质量分数为15%的氯化钠溶液,下列说法中错误的是(导学号 29322112)( C )
A.实验的步骤为计算、称取、量取、溶解、装瓶存放
B.溶解过程中玻璃棒的作用是搅拌,以加快氯化钠的溶解速率
C.把配制好的氯化钠溶液倒入刚用蒸馏水润洗过的试剂瓶中,并贴上标签
D.量取水时,用规格为50 mL的量筒量取42.5 mL蒸馏水
9.(2016·长沙)甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( A )
A.t1 ℃时,甲、乙两物质的溶解度相等
B.乙物质的溶解度大于甲物质的溶解度
C.t2 ℃时,乙的饱和溶液降温至t1 ℃,乙溶液变为不饱和溶液
D.t2 ℃时,甲物质的饱和溶液降温至t1 ℃,溶液中溶质质量一定不变
,第9题图) ,第10题图)
10.(2016·重庆)将质量均为30 g的甲、乙两种固体分别加入到50 g水中,充分搅拌后,剩余固体物质与温度的关系如图所示,下列说法正确的是( A )
A.甲的溶解度随温度升高而增大
B.t1 ℃时,甲、乙的溶解度均为20 g
C.温度由t2 ℃降低到t1 ℃时,甲溶液析出5 g固体
D.a、b、c三点中溶质的质量分数由大到小的顺序是c>a>b
11.(2016·福州)电解氢氧化钠稀溶液与电解水的原理均可表示为:2H2O2H2↑+O2↑。电解一定质量氢氧化钠稀溶液的过程中,下列说法正确的是(导学号 29322113)( B )
A.溶液的pH减小
B.溶液中氢元素质量分数减少
C.溶液中钠元素质量变大
D.溶液中氢、氧元素质量比不变
二、填空题
12.(2016·宜昌)甲、乙、丙三种固体物质的溶解度曲线如下图所示。据图回答问题:
(1)80 ℃时,甲物质的溶解度是__50_g__。
(2)t2 ℃时,把甲、乙、丙三种物质的饱和溶液降温到t1 ℃,溶质质量分数不变的是__丙__。
(3)t2 ℃时,把20 g乙物质加到50 g水中,充分搅拌后所得溶液的质量是__65__g;若要让乙物质从它的饱和溶液中全部结晶析出,应采取的方法是__蒸发结晶__。
,第12题图) ,第13题图)
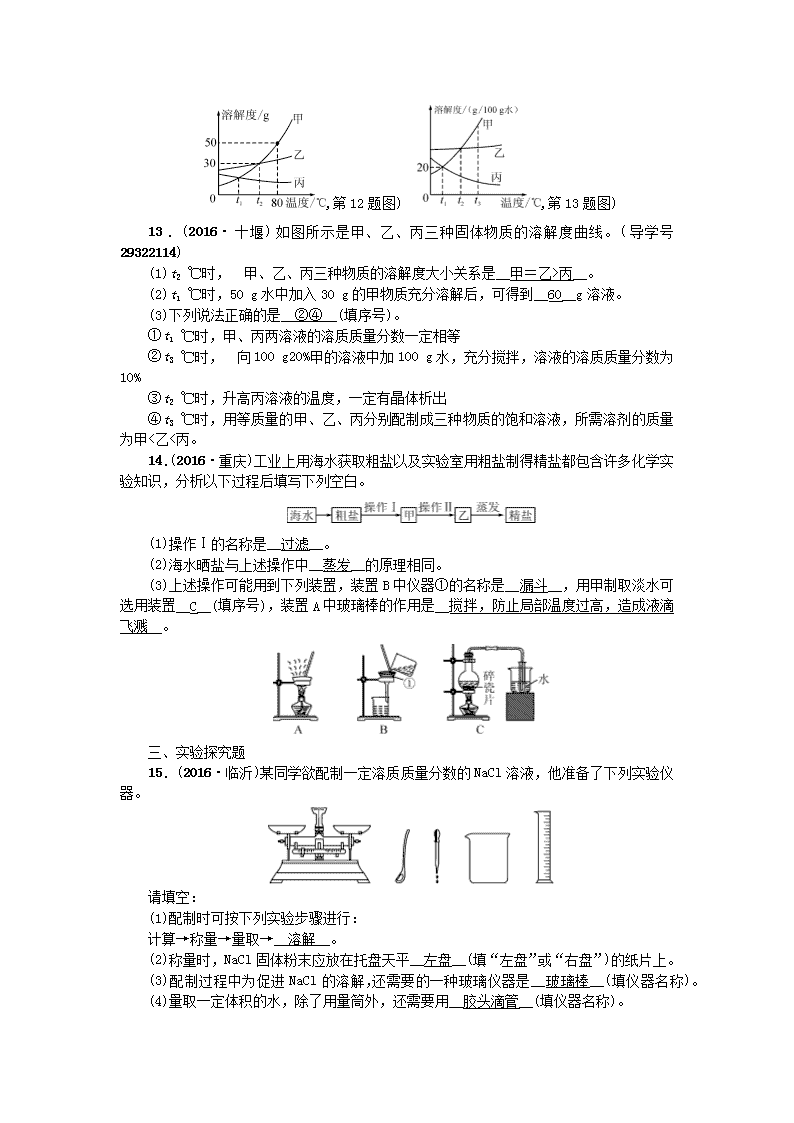
13.(2016·十堰)如图所示是甲、乙、丙三种固体物质的溶解度曲线。(导学号 29322114)
(1)t2 ℃时, 甲、乙、丙三种物质的溶解度大小关系是__甲=乙>丙__。
(2)t1 ℃时,50 g水中加入30 g的甲物质充分溶解后,可得到__60__g溶液。
(3)下列说法正确的是__②④__(填序号)。
①t1 ℃时,甲、丙两溶液的溶质质量分数一定相等
②t3 ℃时, 向100 g20%甲的溶液中加100 g水,充分搅拌,溶液的溶质质量分数为10%
③t2 ℃时,升高丙溶液的温度,一定有晶体析出
④t3 ℃时,用等质量的甲、乙、丙分别配制成三种物质的饱和溶液,所需溶剂的质量为甲<乙<丙。
14.(2016·重庆)工业上用海水获取粗盐以及实验室用粗盐制得精盐都包含许多化学实验知识,分析以下过程后填写下列空白。
(1)操作Ⅰ的名称是__过滤__。
(2)海水晒盐与上述操作中__蒸发__的原理相同。
(3)上述操作可能用到下列装置,装置B中仪器①的名称是__漏斗__,用甲制取淡水可选用装置__C__(填序号),装置A中玻璃棒的作用是__搅拌,防止局部温度过高,造成液滴飞溅__。
三、实验探究题
15.(2016·临沂)某同学欲配制一定溶质质量分数的NaCl溶液,他准备了下列实验仪器。
请填空:
(1)配制时可按下列实验步骤进行:
计算→称量→量取→__溶解__。
(2)称量时,NaCl固体粉末应放在托盘天平__左盘__(填“左盘”或“右盘”)的纸片上。
(3)配制过程中为促进NaCl的溶解,还需要的一种玻璃仪器是__玻璃棒__(填仪器名称)。
(4)量取一定体积的水,除了用量筒外,还需要用__胶头滴管__(填仪器名称)。
16.(2016·苏州)“配制一定溶质质量分数的氯化钠溶液”是初中化学的基础实验之一。请回答下列问题:
(1)现欲配制一瓶500 g溶质质量分数为0.9%的生理盐水,需氯化钠固体__4.5__g。
下列实验操作与目的分析均正确的一组是__D__(填序号)。
项目
实验操作
目的分析
A
称量时,将取出的过量氯化钠放回原瓶
节约药品
B
溶解氯化钠时用玻璃棒搅拌
增大氯化钠的溶解度
C
称取氯化钠时,在天平两边托盘上各放一张质量相等的纸
整洁美观
D
量取所需水时,视线与量筒内液体凹液面的最低处保持水平
准确读数
(2)实验室若用15%的氯化钠溶液加水稀释成5%的氯化钠溶液,此时需要用到的玻璃仪器有:烧杯、玻璃棒、量筒和__胶头滴管__。
(3)实验室若用恒温蒸发的方法将15%的氯化钠溶液变成饱和溶液,其过程如图所示。与丙烧杯中溶液溶质质量分数一定相同的是__丁__(填序号)烧杯中的溶液。
四、计算题
17.(2016·黄冈)200 g稀硫酸与13 g锌恰好完全反应,反应后所得溶液的质量是多少?
解:设生成氢气的质量为x,
Zn+H2SO4===ZnSO4+H2↑
65 2
13 g x
=
解得:x=0.4 g,则所得溶液的质量为200 g+13 g-0.4 g=212.6 g
答:反应后所得溶液的质量是212.6 g。
18.(2016·白银)某化学兴趣小组欲测定某铁粉与炭粉混合物中铁的质量分数,他们进行了如下图所示的实验。请计算:(导学号 29322115)
(1)混合物中铁的质量。
(2)反应后烧杯中稀硫酸无剩余,请计算所用稀硫酸中溶质的质量分数。
(3)欲用98%的浓硫酸配制该浓度的稀硫酸200 g需要水多少克?
解:(1)由图可知,滤渣4.4 g为碳,故铁的质量为10 g-4.4 g=5.6 g
(2)设该稀硫酸中溶质的质量为x,
Fe+H2SO4===FeSO4+H2↑
56 98
5.6 g x
=,x=9.8 g,
稀硫酸中溶质的质量分数为×100%=19.6%(其他合理解法均可)
(3)设需要浓硫酸的质量为y,则98%×y=200 g×19.6%,y=40 g,
需要水的质量:200 g-40 g=160 g。
答:(1)混合物中铁的质量为5.6 g;(2)所用稀硫酸中溶质的质量分数为19.6%;(3)需要水160 g。