- 370.50 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
中考化学专题-----空气、氧气、水
【知识梳理】
考点1 空气成分:
1、空气的组成:
空气成分
氮气
氧气
二氧化碳
稀有气体
其他气体及杂质
体积分数
2、氮气和稀有气体的主要性质及主要用途:
氮气(N2)
稀有气体(He Ne Ar Kr Xe等)
物理性质
通常状况下: 色、 味的气体, 溶于水。
通常状况下: 色、 味的气体。
化学性质
⑴ ⑴常湿下稳定。
⑵一定条件下可与氢气、氧气等物质反应。
很稳定,很难与其它物质反应,故又称 气体。
用途
①保护气;②制硝酸和氮肥等。
①保护气;②霓虹灯、航标灯等。
3、空气中氧气含量的测定
⑴实验原理及方法:红磷在密闭容器中燃烧,消耗 氧气 ,生成 黑色 固体。密闭容器内压强 ,大气压将水压入密闭容器,通过测定进入容器中的 的量来测定氧气在空气中的体积分数。
⑵实验现象:红磷 ,生成大量 ,水进入原容器,且水的体积约占原容器体积的 。
⑶实验失败的主要原因:
a、红磷的量 ;b、装置 ;c、装置未冷却到室温。
⑷实验讨论:
①不能用木炭、硫粉代替红磷做上述实验,原因是 。
②进入瓶中水的体积一般小于瓶内空间1/5的可能原因是: 。
如果大于1/5可能原因? 。
考点2氧气
①氧气的主要物理性质和用途
物理性质:氧气是一种没有颜色,没有气味的气体,密度比空气略大,不易溶于水。
用途:供给呼吸,作为助燃剂,氧化剂。
②氧气的化学性质:
氧气能与许多物质发生氧化反应 ;氧化反应:物质与氧发生的化学反应。
氧气与几种物质反应的实验现象及化学方程式:
物质
实验现象(在O2中燃烧)
化学方程式
注意
木炭
⒈发出白光
⒉放出热量
3.生成使澄清石灰水变浑浊的气体
C + O2 点燃 CO2
盛有木炭的燃烧匙应由上而下慢慢伸入瓶中
硫
⒈发出蓝紫色火焰(在空气中燃烧发出淡蓝色火焰)
⒉放出热量
⒊生成有刺激性气味的气体
S + O2 点燃 SO2
硫的用量不能过多,防止空气造成污染,用氢氧化钠溶液可以吸收生成的二氧化硫。
红磷
(暗红)
1.产生大量白烟
2.放出热量
3.生成白色固体
4P + 5O2 点燃 2P2O5
此反应生成的P2O5为白色固体,现象应描述为白烟
镁条
1.发出耀眼的白光
2.放出大量的热量
3.生成白色固体
2Mg + O2 点燃 2MgO
用石棉网承接生成物,以免烫坏实验台。
铁丝
1.剧烈燃烧,火星四射
2.生成黑色固体
3.放出大量的热量
3Fe + 2O2 点燃 Fe3O4
⒈预先放少量水或沙,防止生成物溅落瓶底,炸裂瓶底
⒉铁丝在空气中不能燃烧
氢气
1.淡蓝色火焰
2.放热
3.水珠附在烧杯内壁上
2H2 + O2 点燃 2H2O
点燃前需验纯
CO
1.蓝色火焰
2.放热
3.生成使澄清石灰水变浑浊的气体
2CO + O2 点燃 2CO2
点燃前需验纯
CH4
1.蓝色火焰
2.放热
3.水珠
4.生成使澄清石灰水变浑浊的气体
CH4 + 2O2 点燃 CO2+2H2O
点燃前需验纯
酒精
1.蓝色火焰
2.放热
3.水珠
4.生成使澄清石灰水变浑浊的气体
CH4+2O2点燃 CO2+2H2O
酒精灯不慎打翻着火用湿抹布盖灭。
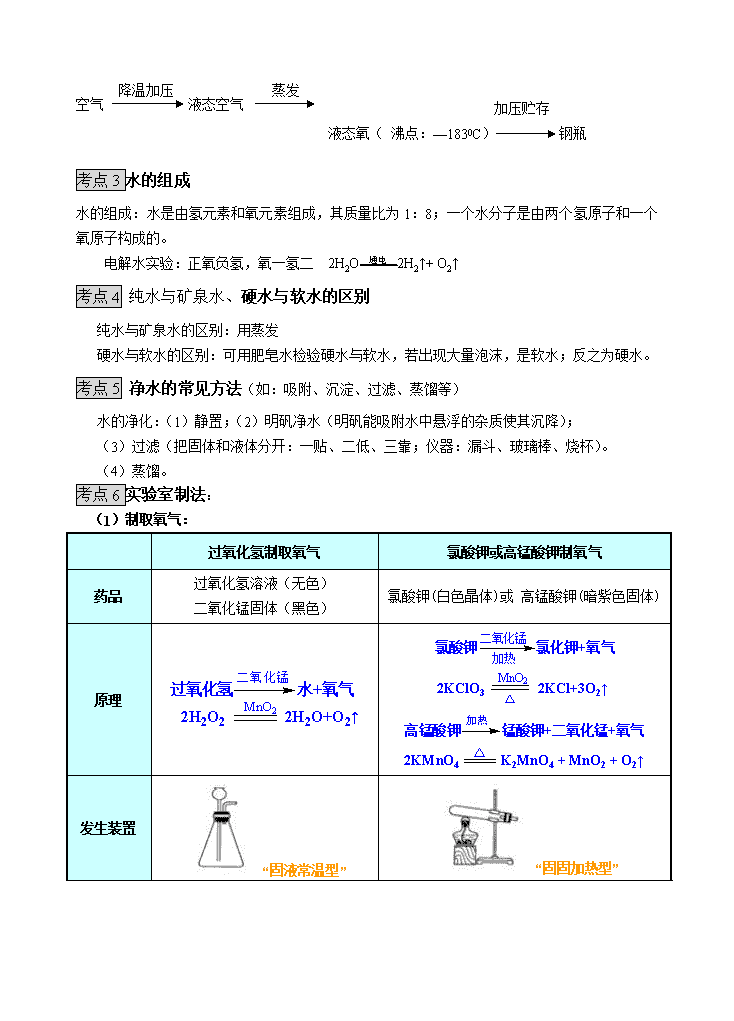
③氧气的工业制法:分离液态空气法(属于物理变化)
氮气(沸点:—196 0C)
加压贮存
空气 降温加压 液态空气 蒸发
液态氧( 沸点:—1830C) 钢瓶
考点3水的组成
水的组成:水是由氢元素和氧元素组成,其质量比为1:8;一个水分子是由两个氢原子和一个氧原子构成的。
电解水实验:正氧负氢,氧一氢二 2H2O 通电 2H2↑+ O2↑
考点4 纯水与矿泉水、硬水与软水的区别
纯水与矿泉水的区别:用蒸发
硬水与软水的区别:可用肥皂水检验硬水与软水,若出现大量泡沫,是软水;反之为硬水。
考点5 净水的常见方法(如:吸附、沉淀、过滤、蒸馏等)
水的净化:(1)静置;(2)明矾净水(明矾能吸附水中悬浮的杂质使其沉降);
(3)过滤(把固体和液体分开:一贴、二低、三靠;仪器:漏斗、玻璃棒、烧杯)。
(4)蒸馏。
考点6实验室制法:
(1)制取氧气:
过氧化氢制取氧气
氯酸钾或高锰酸钾制氧气
药品
过氧化氢溶液(无色)
二氧化锰固体(黑色)
氯酸钾(白色晶体)或 高锰酸钾(暗紫色固体)
原理
发生装置
“固液常温型”
“固固加热型”
收集方法
a.排水法----因为氧气难溶于水。
b.向上排空气法----因为氧气密度比空气略大(导气管应伸入瓶底,尽量排净空气)
整体装置
操作步骤
检查装置气密性
向试管或锥形瓶中先加入二氧化锰固体,再加入过氧化氢溶液。
用排水法或向上排空气法收集
口诀:"茶庄定点收利息"
1.查:查装置的气密性.
2.装:装药品.用单孔橡皮塞塞紧试管
3.定:固定试管在铁架台上.
4.点:点燃酒精灯,均匀加热.
5.收:收集气体.
6.离:先让导管撤离水槽.
7.熄:熄灭酒精灯.
注意事项
用长颈漏斗时,长颈漏斗末端应在液面一下,否则氧气会从长颈漏斗中逸出。
①试管口应略向下倾斜,以防止湿存水在反应过程中倒流到管底,使试管破裂.
②导管不可伸入试管太长,以利于氧气排出,防止药品堵塞导管.
③使用高锰酸钾反应时,需在试管口放一小团棉花,以防加热时高锰酸钾粉末进入导管.
④用氯酸钾和二氧化锰适合于制取较多的氧气,但要注意二氧化锰一定要纯净,二氧化如果混有炭粉,制取氧气时就很容易发生爆炸,因此,使用二氧化锰时最好烧灼一下.
⑤药品要平铺在试管底均匀受热.
⑥加热时要使试管均匀受热(预热).
⑦铁夹夹在试管中上部.
⑧停止加热,先把导管撤出,在撤离酒精灯,否则水槽内水会倒流,导致试管爆裂.
检验和验满
检验方法:把带火星的木条伸入集气瓶中,如复燃,则说明是氧气。
验满方法:把带火星的木条放在瓶口,如复燃,则已收满。
【考题精练】
1.(2013•宜宾)空气是一种宝贵的自然资源,下列有关说法中不正确的是( )
A.法国化学家拉瓦锡研究了空气的成分,并得出氧气约占空气总体积4/5的结论
B.空气是由氮气、氧气、稀有气体、二氧化碳等物质组成的混合物
C.氮气是制造硝酸和氮肥的重要原料
D.稀有气体都没有颜色、没有气味,在通电时能发出不同颜色的光
解:A、法国化学家拉瓦锡研究了空气的成分,并得出空气是由氧气和氮气组成的,其中氧气约占空气总体积1/5 的结论,A项的错误在于氧气约占空气总体积4/5,故说法不正确.
B、空气是由氮气、氧气、稀有气体、二氧化碳等物质组成的混合物,故说法正确.
C、工业上,氮气是制造硝酸和氮肥的重要原料,故说法正确.
D、稀有气体都没有颜色、没有气味,化学性质稳定,在通电时能发出不同颜色的光,故说法正确.
故选A.
2.(2013•苏州)实验室制取氧气的装置如图所示,下列有关叙述合理的是( )
A.锥形瓶里加入少量MnO2粉末,分液漏斗里盛放6%双氧水
B.锥形瓶里加入高锰酸钾固体,分液漏斗里盛放蒸馏水
C.集满氧气的集气瓶从水槽里取出后倒放在桌面上
D.当发生装置中液体与固体一接触产生了气泡即可收集
解:A、该装置是固液在常温下产生氧气,所以使用的药品是双氧水和二氧化锰,锥形瓶里加入少量MnO2粉末,分液漏斗里盛放6%双氧水,故说法正确;
B、用高锰酸钾制取氧气时,需要加热的装置,故说法错误;
C、因为氧气的密度比空气大,为了防止氧气逸散,从水槽里盖上玻璃片取出后正放在桌面上,故说法错误;
D、用排水法收集氧气的合适时机是:气泡连续均匀冒出时收集,以防收集的氧气不纯,故说法错误;
故选项为:A.
3.对下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
A
B
C
D
实
验
装
置
硫在氧气中燃烧
测定空气中氧气含量
铁丝在氧气中燃烧
探究燃烧的条件
解释
集气瓶中的水:吸收放出的热量
量筒中的水:通过水体积的变化得出O2体积
集气瓶中的水:冷却溅落融熔物,防止集气瓶炸裂
烧杯中的水:加热铜
片;隔绝空气
答案:A
4.(2013.安徽省)2013年“世界水日”和“中国水周”活动的宣传主题为“节约保护水资源,大力建设生态文明”。下列说法正确的是 ( )
A.保护水资源,禁止使用化肥、农药 B.利用沉降的方法,将硬水转化成软水
C.工业废渣的任意排放,不会污染水体 D.城市浇花,使用喷灌、滴灌技术
答案:A
5.(2013.哈尔滨)下列相关事实用微观粒子的知识解释错误的是 ( )
选项
事 实
解 释
A
墙内开花墙外可嗅到花香
分子不断运动
B
酒精溶液是混合物
由不同种分子构成
C
水结冰后体积变大
水分子体积变大
D
氢氧化钠溶液能导电
溶液中存在自由移动的Na+和OH
答案:C
6.(2013.株洲市)(12分)某校化学兴趣小组的同学根据实验室提供的仪器和药品,在老师的指导下从下图中选择装置进行了氧气的制备实验。
(1)写出仪器a的名称: 。
(2)甲同学从上图中选择B、E装置的组合制取氧气,反应的化学方程式为: ① 。在用胶皮管连接装置B和E中的玻璃导管时,应先把玻璃管口 ,然后稍稍用力把玻璃管插入胶皮管。收集气体前,应将集气瓶装满 并盖上 。收集氧气还可选用的装置是
。
(3)乙同学称取一定质量的KMnO4固体放入大试管中,将温度控制在250℃加热制取O2。实验结束时,乙同学发现用排水法收集到的O2大于理论产量。针对这一现象,同学们进行了如下探究:
[提出猜想]猜想I:反应生成的MnO2分解放出O2;
猜想II:反应生成的K2MnO4分解放出O2;
猜想III:反应生成的K2MnO4和MnO2分解都放出O2。
[实验验证]同学们分成两组,分别进行下列实验:
第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变,则猜想 错误;第二组同学取K2MnO4在250℃条件下加热,没有用测定质量的方法得出了猜想II正确的结论。该组同学选择的实验方法是 。
[拓展延伸]实验发现,KClO3固体加热制取O2的反应速率很慢,但如果将KMnO4固体与KClO3固体混合加热,则KClO3的分解速率大大加快。请说明KMnO4在KClO3的分解反应中是否作催化剂,为什么? 。
[实验反思]通过以上实验探究,你对“实验室制取氧气”还想探究的问题是 。
答案:(1)锥形瓶 (2)2H2O2 2H2O + O2↑ 用水湿润 水 玻璃片 C
(3) I 将带火星的木条伸入试管口,木条复燃 不是 因为KMnO4反应后质量和化学性质都发生了变化
7.(2013•珠海)乙醇俗称酒精,可用作医用消毒,也常作燃料.其完全燃烧的化学方程式可表示为:C2H6O+3O2点燃2CO2+3H2O.
(1)23g乙醇完全燃烧需消耗多少克氧气?
(2)乙醇不完全燃烧会产生一氧化碳,某实验测得反应前后各物质的质量如下表:
物质
乙醇
氧气
二氧化碳
水
一氧化碳
反应前质量(g)
4.6
8.8
0
0
0
反应后质量(g)
0
0
6.6
5.4
a
①表中a的值为 .
②该实验发生反应的化学方程式为:4C2H6O+11O2 点燃 CO2+ H2O+ CO.
答案: (1) 解:设生成需要氧气的质量为
C2H6O + 3O2 ====2CO2 + 3H2O
46 3 *32
23g X
46:96=23g:X X=48g 答:氧气质量为48g (2) ①1.4 ② 6 12 2