- 476.00 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2018年北京市永定门学校中考初中化学期末测试模拟题
提交
我的留言
加载中
已留言
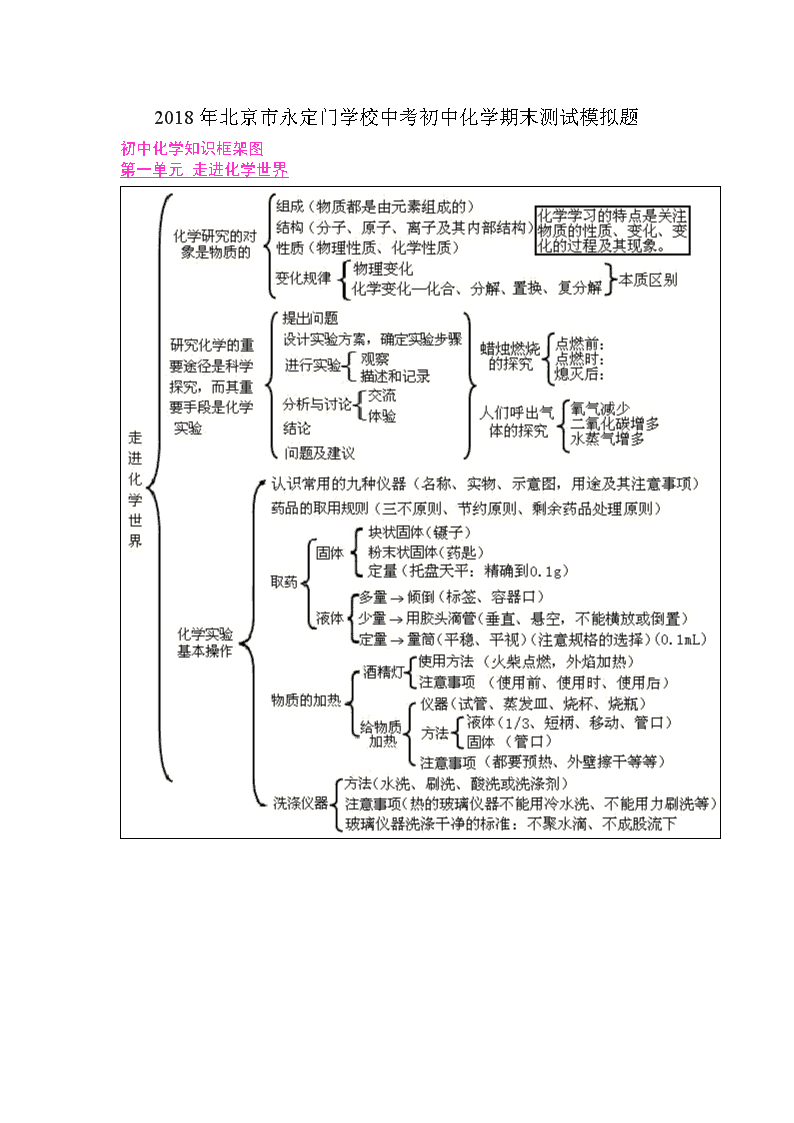
初中化学知识框架图
第一单元 走进化学世界
第二单元 我们周围的空气
第三单元 自然界的水
第四单元 物质构成的奥秘
第五单元 化学方程式
第六单元 碳和碳的氧化物
第七单元 燃料及其利用
第八单元 金属和金属材料
九、溶液
一、化学用语
1、电离方程式
2、物质的俗称和主要成分:
生石灰CaO;熟石灰、消石灰、石灰水的主要成分Ca(OH)2;石灰石、大理石CaCO3;食盐的主要成分NaCl ;纯碱、口碱Na2CO3;烧碱、火碱、苛性钠NaOH;胆矾、蓝矾CuSO4.5H2O;碳酸钠晶体Na2CO3.10H2O;氨水NH3.H2O;
二、金属活动性
1、金属活动性顺序:K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb(H)Cu>Hg>Ag>Pt>Au
2、金属活动性顺序的意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
3、金属活动性顺序的应用:
(1)排在氢前的金属能置换出酸里的氢(元素)。
(2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K、Ca、Na除外)。
四、酸、碱、盐的溶解性
1、常见盐与碱的溶解性:
钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2、八个常见的沉淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙、氢氧化镁、氢氧化铜、氢氧化铁
3、四微溶物:
Ca(OH)2(石灰水注明“澄清”的原因)、CaSO4(实验室制二氧化碳时不用稀硫酸的原因)
Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银的原因)、MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)
4、三个不存在的物质:氢氧化银、碳酸铝、碳酸铁
五、复分解反应发生的条件反应:
有气体、水或沉淀生成(即有不在溶液中存在或在水溶液中不易电离的物质)
(1)不溶性碱只能与酸性发生中和反应
(2)不溶性盐,只有碳酸盐能与酸反应(3)KNO3、NaNO3、AgNO3、BaSO4不能做复分解反应的反应物
六、溶液的酸碱性与酸碱度的测定
1、指示剂---溶液的酸碱性紫色的石蕊试液遇酸性溶液变红;遇碱性溶液变蓝
无色的酚酞试液只遇碱溶液变红 注:不溶性碱与指示剂无作用;碱性溶液不一定是碱的溶液(特例:碳酸钠的水溶液显碱性)
2、pH值---溶液的酸碱度:pH<7溶液为酸性(越小酸性越强);pH=7溶液为中性;pH>7溶液为碱性(越大碱性越强)
七、离子的检验
Cl-(在溶液中)---在被测溶液中加入硝酸银溶液,如果生成不溶于硝酸的白色沉淀,则原被测液中含氯离子。
SO42-(在溶液中)---在被测溶液中加入氯化钡(或硝酸钡、或氢氧化钡)溶液,如果生成不溶于硝酸(或盐酸)的白色沉淀,则原被测液中含硫酸根离子。
CO32-(1)(固体或溶液)---在被测物质中加入稀酸溶液,如果产生能使澄清石灰水变浑浊的气体,则原被测物质中含碳酸根离子。
(2)(在溶液中)---在被测溶液中加入氯化钡或硝酸银溶液,如果产生能溶于硝酸的白色沉淀,且同时生成能使澄清的石灰水变浑浊的气体,则原被测溶液中含碳酸根离子。
( 注:1、在鉴别Cl-和SO42-时,用氯化钡溶液,不要用硝酸银溶液,这是因为硫酸银为微溶性物质,使鉴别现象不明显;2、在一未知溶液中加入氯化钡溶液,若产生不溶于硝酸的白色沉淀,则原被测液中可能含银离子也可能含硫酸根离子。)
八、物质的颜色
1、固体(多为白色)
黑色---CuO、C粉、MnO、2Fe3O4、
紫黑色---KMnO4
红色---Cu、Fe2O3 红褐色---Fe(OH)3
蓝色---Cu(OH)2、CuSO4.5H2O 绿色---Cu2(OH)2CO3
2、溶液(多为无色):
浅绿色溶液---(亚铁盐溶液)FeCl2溶液、FeSO4;
黄色溶液--- (铁盐溶液)FeCl3溶液、Fe2(SO4)3 溶液、Fe(NO3)3
溶液蓝色溶液---(铜盐溶液)CuCl2溶液、CuSO4溶液、Cu(NO3)2
溶液蓝绿色溶液-CuCl2溶液(较浓)
九、酸、碱、盐的特性
1、浓盐酸---有挥发性、有刺激性气味、在空气中能形成酸雾。
2、浓硝酸---有挥发性、有刺激性气味、在空气中能形成酸雾,有强氧化性。
3、浓硫酸---无挥发性。粘稠的油状液体。有很强的吸水性和脱水性,溶水时能放出大量的热。有强氧化性。
4、氢氧化钙---白色粉末、微溶于水。
5、氢氧化钠---白色固体、易潮解,溶水时放大量热。能与空气中的二氧化碳反应而变质。
6、硫酸铜---白色粉末、溶于水后得蓝色溶液(从该溶液中析出的蓝色晶体为五水合硫酸铜CuSO4.5H2O)。
7、碳酸钠---白色粉末,水溶液为碱性溶液(从溶液中析出的白色晶体为碳酸钠晶体Na2CO3.10H2O)
8、氨水(NH3.H2O)---属于碱的溶液
十、酸与碱的通性和盐的性质
1、酸的通性
(1)酸溶液能使紫色的石蕊试液变红,不能使无色的酚酞试液变色。
(2)酸能与活泼金属反应生成盐和氢气
(3)酸能与碱性氧化物反应生成盐和水
(4)酸能与碱反应生成盐和水
(5)(5)酸能与某些盐反应生成新的盐和新的酸
2、碱的通性
(1)碱溶液能使紫色的石蕊试液变蓝,并能使无色的酚酞试液变红色
(2)碱能与酸性氧化物反应生成盐和水
(3)碱能与酸反应生成盐和水
(4)某些碱能与某些盐反应生成新的盐和新的碱
3、盐的性质
(1)某些盐能与较活泼的金属反应生成新的盐和金属
(2)某些盐能与酸反应生成新的盐和新的酸
(3)某些盐能与某些碱反应生成新的盐和新的碱
(4)有些不同的盐之间能反应生成两种新的盐