- 789.50 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
中考专题复习五 化学实验与图像题
一、化学实验
(一)需注意的基本操作
1.浓硫酸的稀释
浓硫酸容易溶于水,同时放出大量热,它的密度又大于水。若将水注入酸中,水会浮在硫酸上面,溶解时放出的热会使水沸腾,使硫酸向四周飞溅,发生事故。因此稀释浓硫酸时,一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,使产生的热量迅速地扩散。
2.气体的溶解
根据气体在水或吸收剂里的溶解性不同,可采用不同的方法来吸收气体使之溶解。在水中极易溶解的气体如氨、氯化氢、溴化氢等应采用B法,装置特点是导气管连接了一个倒扣的漏斗,漏斗边缘浸入水中约1mm~2mm。它的优点是可防止水倒流入气体发生装置,又可增大吸收面积,利于气体充分溶解。它有自动调节气体发生装置内外压力趋于平衡的作用。即有自控倒吸作用。如气体的溶解度不太大,如氯气、硫化氢等应采取A法。
3.量取一定体积的液体
读数时量筒必须放平稳,视线与量筒内液体凹底保持水平。 量筒的0刻度在下,读数时 俯视——数值偏高(大)
仰视——数值偏低(小)
先将液体倾倒入量筒至接近刻度时,用滴管逐滴滴入至刻度值。
(二)综合实验操作
1. 制取气体的操作顺序
要制取气体需要经过仪器连接、气密性检查、装入药品、仪器拆洗等步骤。
2. 气体制取的仪器组合顺序
制备纯净干燥气体的步骤是:实验仪器组装:气体发生装置—除杂质装置—干燥装置—气体收集装置→尾气处理
①制气装置的选择:A 所需药品的状态;B 反应条件
②集气装置的选择:A 气体的溶解性;B 气体的密度
③除杂质的试剂和干燥剂的选择:实验室制取的气体常常有酸雾或水分。
酸雾可用水、氢氧化钠溶液、澄清的石灰水或饱和碳酸钠(碳酸氢钠)溶液除去,水分可用干燥剂如:浓硫酸(酸性)、碱石灰(碱性)、固体氢氧化钠(碱性)、氧化钙(碱性)、五氧化二磷(酸性)、无水氯化钙(中性)、无水硫酸铜(中性)等除去。
a.酸性干燥剂(浓硫酸)不能干燥碱性气体如氨气;
b.碱性干燥剂(NaOH )不能干燥酸性气体如二氧化硫、二氧化碳、、氯化氢等
【注意】(1)气体除杂的原则:不减少被净化气体的质量,不引进新的杂质。(2)气体除杂的注意事项:a.选择除杂试剂:一般只能跟杂质起反应,而不能与被净化的气体反应。b.除杂务尽:选择除杂试剂要注意反应进行的程度。(如除去CO2
时用氢氧化钠溶液比用澄清石灰水要好。因为氢氧化钠的溶解度比氢氧化钙要大很多,因此其溶质质量分数较大。)c.有许多杂质要除去时,要注意除杂的顺序。一般来说,杂质中有许多酸性杂质时,先除酸性较强的杂质;而水蒸气要放在最后除去。d.除去杂质和干燥的装置一般用洗气瓶或干燥管。在洗气瓶中导气管一般是长进短出,在干燥管中一般是大进小出。除杂和干燥一般是先除杂后干燥。
④处理装置:一般有三种,一是用溶液吸收;二是点燃尾气;三是回收。
3.物质的分离和提纯
(1)分离:根据混合物中各成分的性质差异,采用适当的物理或化学方法将它们从混合物中—一分开,得到几种纯净物的过程。
(2)提纯(除杂):利用物质和杂质的性质不同,选择适当实验方法除去该物质中的少量杂质而得到纯净物的过程。提纯时只保留混合物的提纯成分,除去的杂质不保留。
【注意】提纯的原则:①“不增”:除杂时不能引人新杂质,加人的过量除杂剂也应最后除去。②“不变”:选择的除杂剂一般只与杂质反应,不能使被提纯物质的性质改变。③“易分”:要选择简单易分离、现象明显、所得物质纯度高的除杂方法。
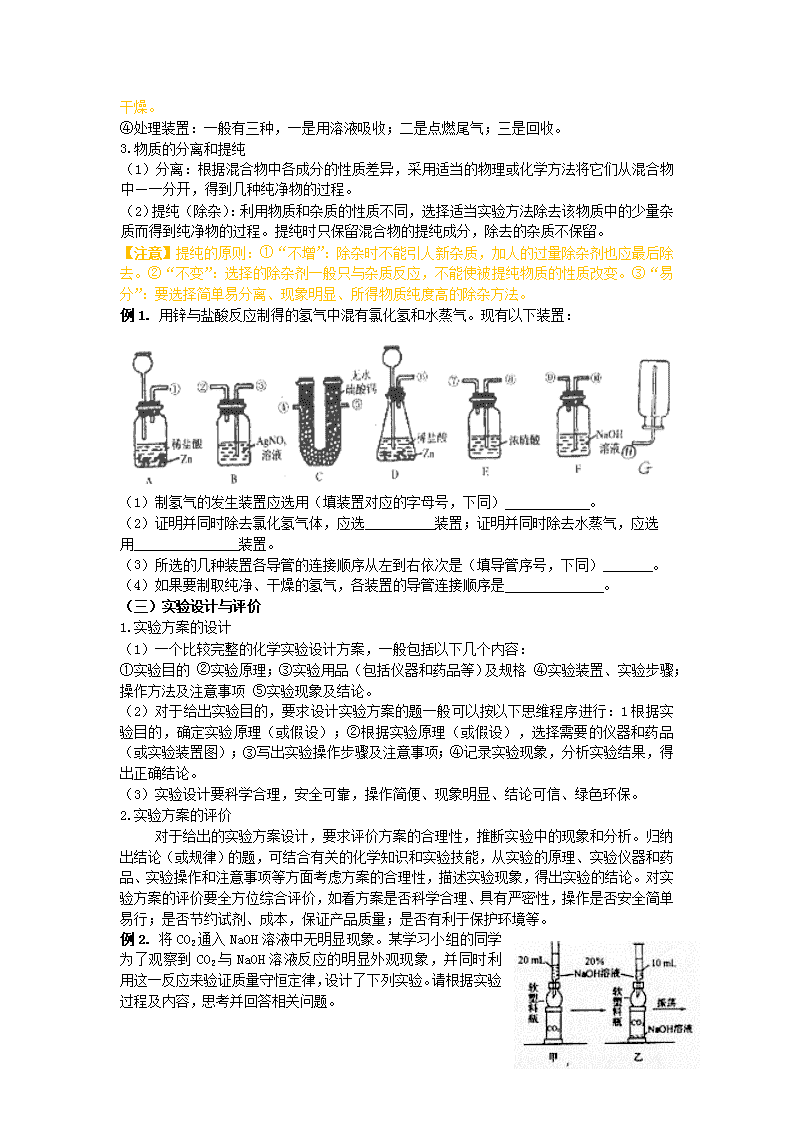
例1. 用锌与盐酸反应制得的氢气中混有氯化氢和水蒸气。现有以下装置:
(1)制氢气的发生装置应选用(填装置对应的字母号,下同) 。
(2)证明并同时除去氯化氢气体,应选 装置;证明并同时除去水蒸气,应选
用 装置。
(3)所选的几种装置各导管的连接顺序从左到右依次是(填导管序号,下同) 。
(4)如果要制取纯净、干燥的氢气,各装置的导管连接顺序是 。
(三)实验设计与评价
1.实验方案的设计
(1)一个比较完整的化学实验设计方案,一般包括以下几个内容:
①实验目的 ②实验原理;③实验用品(包括仪器和药品等)及规格 ④实验装置、实验步骤;操作方法及注意事项 ⑤实验现象及结论。
(2)对于给出实验目的,要求设计实验方案的题一般可以按以下思维程序进行:1根据实验目的,确定实验原理(或假设);②根据实验原理(或假设),选择需要的仪器和药品(或实验装置图);③写出实验操作步骤及注意事项;④记录实验现象,分析实验结果,得出正确结论。
(3)实验设计要科学合理,安全可靠,操作简便、现象明显、结论可信、绿色环保。
2.实验方案的评价
对于给出的实验方案设计,要求评价方案的合理性,推断实验中的现象和分析。归纳出结论(或规律)的题,可结合有关的化学知识和实验技能,从实验的原理、实验仪器和药品、实验操作和注意事项等方面考虑方案的合理性,描述实验现象,得出实验的结论。对实验方案的评价要全方位综合评价,如看方案是否科学合理、具有严密性,操作是否安全简单易行;是否节约试剂、成本,保证产品质量;是否有利于保护环境等。
例2. 将CO2通入NaOH溶液中无明显现象。某学习小组的同学为了观察到CO2与NaOH溶液反应的明显外观现象,并同时利用这一反应来验证质量守恒定律,设计了下列实验。请根据实验过程及内容,思考并回答相关问题。
(1)实验装置如图甲所示。将整套装置(包括CO2及NaOH溶液)放在天平上称量,测得质量为78.2g。
(2)用力推压注射器活塞向密闭的软塑料瓶中注入10mLNaOH溶液(装置如图乙所示),振荡后观察到的现象有__________________________________。
(3)静置片刻后,将整套装置再次放在天平上称量,测得其质量仍为78.2g,你对这一结果的解析是______________________________________________。
(4)通过上述探究实验,你得到的启示是:
①若采用有气体参加或生成的反应来验证质量守恒定律,应让化学反应在____________中进行。
②为进一步证明CO2与NaOH溶液确已发生了化学反应,你还能想到的方法是_____________。
例3. 某兴趣小组对氢氧化钠固体暴露在空气中的变质情况进行了研究。把一小块固体氢氧化钠放在表面皿里,长时间暴露在空气中,发现其固体表面逐渐湿润,部分溶化成液体后又逐渐形成晶体,最终变成粉末。请回答兴趣小组产生的下列问题:
(1)实验室中,氢氧化钠固体应怎样保存? _________ 。
(2)氢氧化钠固体暴露在空气中,表面容易变湿,主要原因是什么? ________ 。
(3)氢氧化钠固体长期暴露在空气中,最终产物主要是什么 _______ 。
(4)用酚酞试液 ______ (填“能”或“不能”)检验氢氧化钠变质。为什么 _____ 。
(5)除加酸以外,怎样用其他方法检验氢氧化钠固体已经变质? ________ 。
(6)为了检验氢氧化钠是否已经全部变质,兴趣小组中小薇同学设计了如下实验方案:
准确称取一定质量的变质固体样品,放在右图所示装置中,
然后从分液漏斗中加入足量的盐酸,用排水法收集产生的二氧
化碳,根据二氧化碳的体积和密度计算变质产物的质量,确定
是否全部变质。
①你认为这个方案 _______ (填“行”或“不行”)。理由是什么? __________ 。
②请你另外设计一个方案,并简要说明实验方法和结论。 ________ ,________ 。
二、图像题
用函数图像表示一些化学(物理)现象发生的过程具有形象、直观、简洁的特点。通过对图像试题的分析,能较好地考查学生抽象、概括、分析判断能力,培养良好的思维品质。图像题是中考及化学竞赛中必不可少的一类题,涉及的内容主要包括质量守恒定律的应用;pH的变化;导电情况的分析;沉淀量与气体量关系计算;跨学科知识应用;溶液有关问题等等。以用直角坐标系表示的曲线变化图形式出现的最多。
【方法点拨】解答曲线题关键要抓住曲线的起点、转折点、终点,由图像表示的意义与学科知识结合起来,并从中发现变化规律和趋势,把握了事物变化的规律就找到了解决问题的突破口。
(一)固体物质的溶解度图像
例1.现有A、B、C三种物质的溶解度曲线如图1所示。
已知在20℃~30℃间,A与B有相同的溶解度;
在70℃时A、C溶解度相同。
(1)请在溶解度曲线中标出物质的标号;
(2)在10℃时,三种物质的溶解度由大到小的顺序为_____;
(3)在50℃时,三种物质的质量均为85g,分别放入100g水中形成溶液,其中__的溶液为饱和溶液,___的溶液为不饱和溶液;
(4)要从A和B的混合物中提纯A,可采用____方法。
【规律小结】通过观察溶解度曲线可获得以下信息:①同种物质在不同温度下的溶解度;②不同种物质在同一温度下的溶解度;③同种物质的溶解度如何受温度变化的影响;④两种物质溶解度曲线相交点的意义。
变式1. (2011· 无锡市)右图是A、B、C三种物质的溶解度曲线。下列叙述错误的是 ( )
A.t1℃时,三种物质的溶解度大小顺序为A