- 235.50 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第十讲 酸和碱
【学习目标】
1.了解常见酸和碱的特性
2.掌握酸的化学性质
3.掌握碱的化学性质
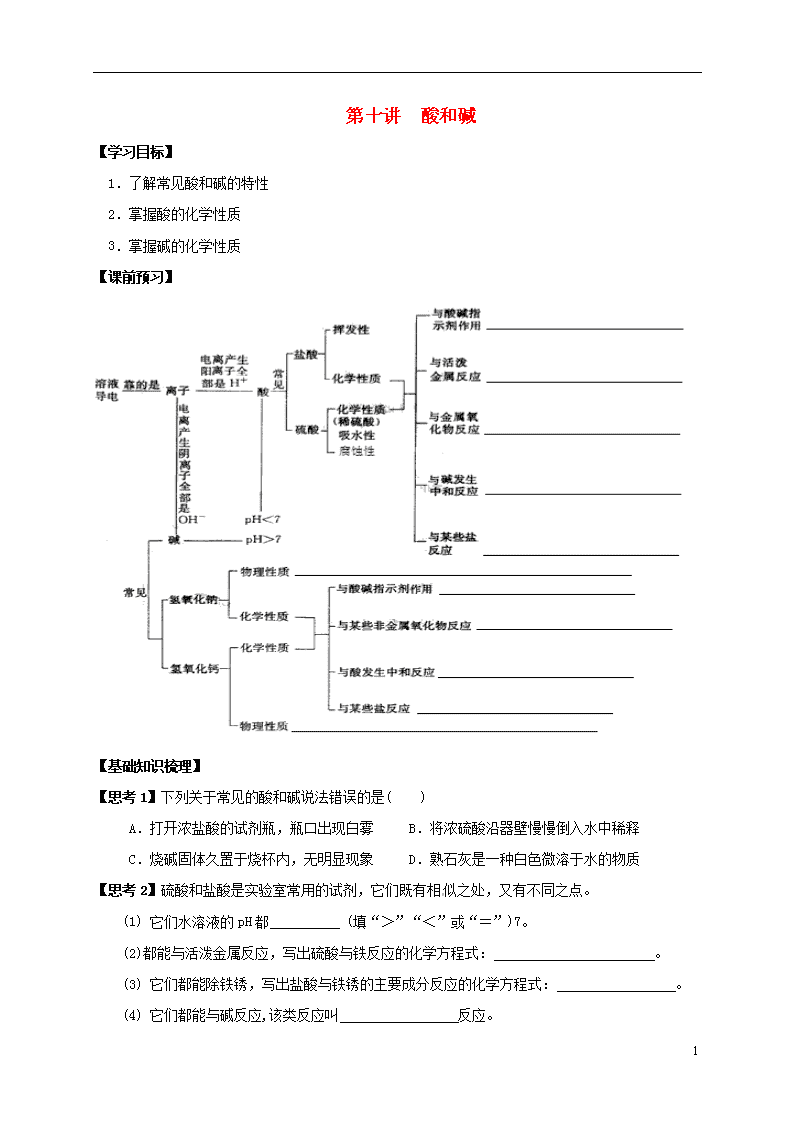
【课前预习】
【基础知识梳理】
【思考1】下列关于常见的酸和碱说法错误的是( )
A.打开浓盐酸的试剂瓶,瓶口出现白雾 B.将浓硫酸沿器壁慢慢倒入水中稀释
C.烧碱固体久置于烧杯内,无明显现象 D.熟石灰是一种白色微溶于水的物质
【思考2】硫酸和盐酸是实验室常用的试剂,它们既有相似之处,又有不同之点。
(1) 它们水溶液的pH都 (填“>”“<”或“=”)7。
(2)都能与活泼金属反应,写出硫酸与铁反应的化学方程式: 。
(3) 它们都能除铁锈,写出盐酸与铁锈的主要成分反应的化学方程式: 。
(4) 它们都能与碱反应,该类反应叫 反应。
6
(5) 写出把硫酸转化为盐酸的化学方程式: 。
【思考3】根据学习碱的化学性质,完成下列问题。
(1) 碱溶液能使无色酚酞溶液变 。
(2) 氢氧化钠暴露在空气中变质的化学方程式为 ,
所以氢氧化钠必须 保存。
(3) 向烧杯中的硫酸铜溶液中滴加氢氧化钠溶液,反应的现象是 。
(4) 碱溶液有相似的化学性质,是因为碱溶液中都含有 。
【典型问题分析】
例1:如图是物质之间发生化学反应的颜色变化。
(1)请你在编号②、③处各填入一种物质,
②是 ;③是 ;
(2)根据上图总结出稀硫酸的五个化学性质,
请写出编号①稀硫酸的化学性质 ;
(3)若编号④的物质是碱,请你写出符合编号
④的一个化学方程式: 。
例2:为验证CO2与NaOH能够发生反应,某同学按图组装实验装置,并进行实验。
(1)观察到的现象是“气球先膨胀,后变瘪”,则加入试剂的顺序应该是 。
A.先加盐酸,再加氢氧化钠溶液
B.先加氢氧化钠溶液,再加盐酸
(2)请解释气球“先膨胀”的原因:
_____________________________________________。
(3)写出气球“后变瘪”的化学方程式:
______________________________________________。
例3:利用数字化传感器测得硫酸和氢氧化钾溶液反应时烧杯中溶液pH的变化图像如图。下列说法正确的是( )
A.图中c点所示溶液呈碱性
B.图中a点所示溶液中,含有的溶质是K2SO4和H2SO4
C.由b点到c点的变化过程中没有发生化学反应
D.该实验是将氢氧化钾溶液逐滴入盛有硫酸的烧杯中
6
【课堂小结】
【课后作业】
1.物质存放在烧杯中一段时间后,质量变大且变质的是( )
① 浓盐酸 ② 浓硫酸 ③ 烧碱 ④ 生石灰 ⑤ 澄清石灰水
A.③④⑤ B.②③④⑤ C.①②③④⑤ D.④⑤
2.下列物质常用于改良酸性土壤的是( )
A.熟石灰 B.烧碱 C.食盐 D.大理石
3.向一定质量的甲中逐渐加入乙至过量,此过程中溶液的溶质总质量与加入乙的质量之间的关系,能用如图曲线表示的是( )
选 项
甲
乙
A
稀硫酸
氢氧化钠溶液
B
稀盐酸
碳酸钙粉末
C
稀盐酸
锌 粒
D
硝酸银溶液
铜 粉
4.下列食物的近似pH如下,其中酸性最强的是( )
A.柠檬汁:2.2~2.4 B.番茄汁:4.0~4.4 C.牛奶:6.3~6.6 D.鸡蛋清:7.6~8.0
5.厕所清洁剂的主要成分是盐酸,炉具清洁剂的主要成分是氢氧化钠。关于这两种清洁剂的叙述正确的是( )
A.测得厕所清洁剂的pH=13 B.测得炉具清洁剂的pH=1
C.厕所清洁剂能使紫色石蕊溶液变蓝 D.炉具清洁剂能使无色酚酞溶液变红
6.硫酸是工农业生产中使用非常广泛的一种试剂,实验室用质量分数为 98%的浓硫酸(密度为 1.84 g/cm3)配制49 g质量分数为 20%的硫酸。
(1)经计算,所用水的质量为________g,所需 98%的浓硫酸的体积约为________mL。
6
(2) 量取上述体积的浓硫酸所选用的仪器为________(填选项)。
A.10 mL 量筒 B.100 mL 烧杯 C.100 mL 量筒 D.胶头滴管
(3) 稀释浓硫酸时,将浓硫酸沿烧杯壁缓慢地注入盛有水的烧杯里,并___________________。
(4) 如果不慎将浓硫酸沾到皮肤上,应立即_______________,然后涂上 3%的小苏打溶液。
7.化学课上,小亮与老师一起演示了如图所示的实验:
请回答下列问题。
(1) 甲中铜加热时因生成了氧化铜而变黑,该变化属于________(填“物理”或“化学”)变化。
(2) 小亮将变黑的铜丝a伸入试管内的稀硫酸中,再取出时,铜丝表面又变红了,试管内发生反应的化学方程式是 ,该反应属于基本反应类型中的________反应。
(3) 老师将加热变黑的铜丝b趁热迅速伸入试管内的活性炭中,再取出时,铜丝表面也变红了,则试管内活性炭的质量一定会________(填“增大”或“减小”)。
8.氧化钙俗名生石灰,某同学针对氧化钙设计了如下实验方案:
(1) A中发生反应的化学方程式为 。分离B中难溶物的操作Ⅰ叫________。
(2) 如果要用实验证明C中不是水而是一种溶液,可以选择下列________(填序号)进行实验。
① 稀盐酸 ② 酚酞溶液 ③ 二氧化碳 ④ 氯化钠溶液
(3) 操作Ⅱ是加入某种物质使无色澄清液出现白色固体,如果加入的是饱和碳酸钠溶液,白色固体的化学式是________;如果加入的是固体氢氧化钠(全部溶解),白色固体的化学式是 。
9.某植物的花瓣汁液(以下简称X汁液)呈紫色,X汁液分别滴加到盛有下列液体的试管中有如下现象:
液体名称
白醋
稀盐酸
氯化钠溶液
蒸馏水
石灰水
氢氧化钾溶液
6
X汁液
红色
红色
紫色
紫色
绿色
绿色
(1) 据上表推测,X汁液________(填“能”或“不能”)做酸碱指示剂。
(2) 将X汁液滴入肥皂水中溶液呈绿色,则肥皂水显________(填“酸”“碱”或“中”)性,pH_____(填“>”“<”或“=”)7。
(3) 粗略测定雨水的酸碱度可使用________。
10.室温下,将稀盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,利用温度计测出烧杯中溶液的温度,溶液温度随加入盐酸的质量变化的曲线如图所示:
(1) 由图可知,盐酸与氢氧化钠溶液的中和反应是________(填
“吸热”“放热”或“无热量变化”)反应。
(2) 在A处溶液中加入石蕊,溶液呈________色。
(3) B处溶液的溶质是________(填化学式)。
(4) B到C的过程中溶液的pH逐渐_______(填“增大”“减小”或“无变化”)。
(5) 在C点溶液中加入碳酸钙,现象为_____________,化学方程式为____________________。
11.在学习酸的化学性质后,同学们做了如图所示的两个实验。
(1) A试管中发生反应的化学方程式:__________________________。
向B试管中加入足量的稀硫酸,观察到的现象是_______________。
(2) 实验结束后,小红将A、B两试管中的废液倒入同一洁净的烧杯中,
片刻后发现烧杯中出现了红褐色沉淀,经分析,红褐色沉淀是氢氧化
铁。小红将烧杯中物质进行过滤得到无色滤液,滤液中含有什么溶质?
小红、小军对此进行探究。
【实验讨论】
① 小红分析了反应物和生成物之后,认为滤液中不可能有H2SO4,因为__________________。
② 小军认为滤液中不可能有Fe2(SO4)3,理由是______________________________________。
【提出猜想】 猜想Ⅰ:Na2SO4、NaOH;猜想Ⅱ:________________。
【设计实验】
实验操作
实验现象
结 论
取少量滤液于试管中,向其中滴加酚酞溶液
猜想Ⅰ成立
6
1.B;2.A;3.D;4.A;5.D;
6.39g 5.4mL AD 用玻璃棒不断搅拌 用大量水冲洗
7.化学 CuO+H2SO4===CuSO4+H2O 复分解 减小
8.CaO+H2O===Ca(OH)2 过滤 ②③ CaCO3 Ca(OH)2
9.能 碱 > pH试纸
10.放热 蓝色 NaCl 减小 有气泡产生 CaCO3+2HCl===CaCl2+H2O+CO2↑
11.2NaOH+H2SO4===Na2SO4+2H2O
红棕色固体逐渐溶解至消失,溶液由无色变为黄色
烧杯中生成的氢氧化铁沉淀不能与硫酸共存
过滤得到无色滤液,而Fe2(SO4)3溶液呈黄色
Na2SO4 酚酞溶液由无色变为红色
6