- 320.50 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第八、九单元测试题
(满分:100分 时间:45分钟)
相对原子质量:H—1 C—12 O—16 Mg—24 S—32 Cl—35.5
一、选择题(每小题3分,共45分)
1.(2016·重庆)下列物质中,属于溶液的是( A )
A.苏打水 B.冰水 C.石灰乳 D.液氧
2.(2016·咸宁)下列比较中,符合实际的是( A )
A.黄铜片比纯铜片的硬度大 B.地壳中硅的含量比氧多
C.铁门窗比铝合金门窗更耐腐蚀 D.食盐水比食醋的pH小
3.生铁和足量的稀盐酸充分反应后,总会有一些残渣剩余,残渣的成分主要是( D )
A.铁 B.氯化铁 C.氯化亚铁 D.碳
4.(2016·长沙)判断金属Zn、Fe、Ag的金属活动性强弱有很多种方法,下列能作为判断依据的是( C )
A.根据金属导电性强弱判断
B.根据金属导热性快慢判断
C.根据锌能把铁从硫酸亚铁溶液中置换出来,铁能把银从硝酸银溶液中置换出来判断
D.根据金属的密度大小判断
5.(2016·成都)在金属表面覆盖保护膜是普遍采用的金属防锈措施之一。下列自行车的防锈措施中,不属于覆盖保护膜的是( A )
A.擦拭保持洁净与干燥 B.链条上油 C.轮圈镀铬 D.车架喷漆
6.(2016·枣庄)X、Y、Z为三种金属,已知①X+H2SO4===XSO4+H2↑ ②Y+2ZNO3===Y(NO3 )2+2Z ③Y与稀硫酸不反应,则下列符合要求的X、Y、Z分别是( A )
A.Fe Cu Ag B.Cu Hg Ag C.Mg Zn Fe D.Fe Ag Cu
7.溶液是一种重要的混合物。下列有关溶液的说法正确的是( B )
A.溶液具有均一性和稳定性,因为溶液中的各种粒子保持静止不动
B.饱和溶液是一定温度下不能再溶解该物质的溶液
C.不饱和溶液通过降低温度一定能变成饱和溶液
D.一种物质分散到另一种物质里一定能形成溶液
8.右图是甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是( D )
A.t1℃时,三种固体物质的溶解度关系为乙>甲>丙
B.t2℃100 g甲物质饱和溶液中含有60 g甲
C.将丙物质饱和溶液变为不饱和溶液,可采用升温的方法
D.t2℃时,分别用100 g水配制甲、乙的饱和溶液,再降温到t1℃,析出固体的质量:甲>乙
9.(2016·临沂)下列四个实验中只需要完成三个就可以证明Zn、Cu、Ag三种金属的活动性顺序,其中不必进行的实验是( D )
A.将锌片放入稀硫酸 B.将铜片放入稀硫酸
C.将铜片放入硝酸银溶液 D.将锌片放入硝酸银溶液
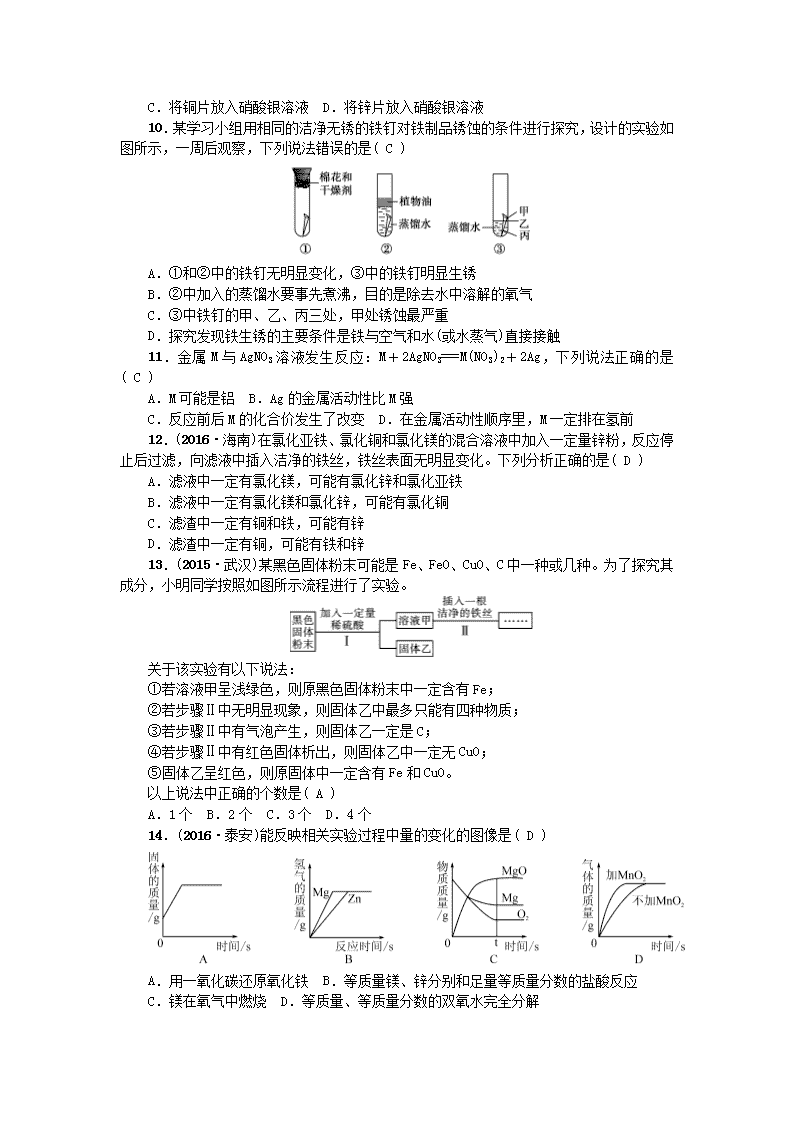
10.某学习小组用相同的洁净无锈的铁钉对铁制品锈蚀的条件进行探究,设计的实验如图所示,一周后观察,下列说法错误的是( C )
A.①和②中的铁钉无明显变化,③中的铁钉明显生锈
B.②中加入的蒸馏水要事先煮沸,目的是除去水中溶解的氧气
C.③中铁钉的甲、乙、丙三处,甲处锈蚀最严重
D.探究发现铁生锈的主要条件是铁与空气和水(或水蒸气)直接接触
11.金属M与AgNO3溶液发生反应:M+2AgNO3===M(NO3)2+2Ag,下列说法正确的是( C )
A.M可能是铝 B.Ag的金属活动性比M强
C.反应前后M的化合价发生了改变 D.在金属活动性顺序里,M一定排在氢前
12.(2016·海南)在氯化亚铁、氯化铜和氯化镁的混合溶液中加入一定量锌粉,反应停止后过滤,向滤液中插入洁净的铁丝,铁丝表面无明显变化。下列分析正确的是( D )
A.滤液中一定有氯化镁,可能有氯化锌和氯化亚铁
B.滤液中一定有氯化镁和氯化锌,可能有氯化铜
C.滤渣中一定有铜和铁,可能有锌
D.滤渣中一定有铜,可能有铁和锌
13.(2015·武汉)某黑色固体粉末可能是Fe、FeO、CuO、C中一种或几种。为了探究其成分,小明同学按照如图所示流程进行了实验。
关于该实验有以下说法:
①若溶液甲呈浅绿色,则原黑色固体粉末中一定含有Fe;
②若步骤Ⅱ中无明显现象,则固体乙中最多只能有四种物质;
③若步骤Ⅱ中有气泡产生,则固体乙一定是C;
④若步骤Ⅱ中有红色固体析出,则固体乙中一定无CuO;
⑤固体乙呈红色,则原固体中一定含有Fe和CuO。
以上说法中正确的个数是( A )
A.1个 B.2个 C.3个 D.4个
14.(2016·泰安)能反映相关实验过程中量的变化的图像是( D )
A.用一氧化碳还原氧化铁 B.等质量镁、锌分别和足量等质量分数的盐酸反应
C.镁在氧气中燃烧 D.等质量、等质量分数的双氧水完全分解
15.烧杯中有一定质量的MgO和MgCO3的混合物,向其中加入150 g稀盐酸,恰好完全反应。一定温度下,得到156 g不饱和溶液。下列数据中,与该溶液的溶质质量分数最接近的是( D )
A.16.6% B.6.1% C.12.2% D.9.1%
二、填空题(共33分)
16.(3分)(2016·遂宁)结合下列初中常见的实验仪器图回答后面的问题:
(1)写出指定仪器的名称:C__酒精灯__。
(2)在粗盐提纯实验中,在进行__过滤__操作(填操作名称)时要用到仪器B。
(3)配制一定质量分数的氢氧化钠溶液时,要用到如图中所给的__AD__(填序号)仪器。
17.(8分)(2016·聊城)下表为氯化钠和氯化铵在不同温度时的溶解度,请回答下列问题:
温度/℃
0
10
20
30
40
50
NH4Cl溶解度/g
29.4
33.3
37.2
41.4
45.8
49.6
NaCl溶解度/g
35.7
35.8
36.0
36.3
36.6
37.0
(1)由表中数据可知,溶解度随温度变化较大的物质是__氯化铵(或NH4Cl)__。
(2)20 ℃时,100 g水最多能溶解NaCl__36.0__g。
(3)向烧杯中加入100 g水和49.0 g氯化铵配成50 ℃的溶液,此时溶液为__不饱和__溶液(填“饱和”或“不饱和”),再冷却到20 ℃,烧杯中析出固体的质量为__11.8__g。
18.(8分)(2016·泰安)人类文明进步与金属材料的发展关系十分密切,金属在生活生产中有着非常广泛的应用。请回答下列问题:
(1)根据下图金属应用实验推断,金属具有的物理性质有__导电性、导热性、延展性__(至少答两点)。
(2)生铁和钢都是铁的合金,二者性能不同的原因是__含碳量不同__。
(3)厨房中的下列物品所使用的主要材料属于金属材料的是__BD__。
A.陶瓷碗 B.不锈钢炊具 C.橡胶手套 D.铜质水龙头
(4)微型化录音录像的高性能带中磁粉主要材料之一是化学组成相当于CoFe2O4的化合物,又知钴(Co)和铁都有+2、+3价,且在上述化合物中每种元素只具有一种化合价,则铁元素的化合价为__+3__。
(5)某实验室废液中含有稀硫酸、硫酸亚铁和硫酸铜,若向其中加入一定量的锌,充分反应后过滤,向滤渣中加入盐酸,有气泡产生。则滤液中一定不含有的物质是__硫酸、硫酸铜(或H2SO4、CuSO4)。
19.(8分)甲和乙两种固态物质的饱和溶液中溶质质量分数(ω)与温度(T)的关系如图所示。
(1)甲和乙两种物质的溶解度随温度的升高而__增大__(填“增大”或“减小”)。
(2)下列对P点的含义叙述正确的是__A__(填标号)。
A.t1℃时,甲和乙两种物质的溶解度相等
B.t1℃时,甲和乙两种物质溶液的溶质质量分数相等
C.t1℃时,甲和乙两种物质的饱和溶液中溶质的质量相等
(3)25 g乙物质完全溶于100 g水中所需的最低温度是__t1__℃。
(4)t2℃时,若从甲和乙两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是__乙__(填“甲”或“乙”)物质饱和溶液。
20.(6分)(2016·宜宾)白铜(Cu、Ni合金)因为光泽好、耐腐蚀、容易加工等优点,常代替银做饰品。下图所示是某实验室分离废弃白铜饰品成分的流程(部分反应产物在图中已略去)。
已知溶液B中含有一种二价金属硫酸盐,溶液D中只有一种溶质。分析该流程,回答下列问题:
(1)固体A的化学式为__Cu__,过程Ⅱ中的实验操作名称是__过滤__。
(2)过程Ⅰ中反应的化学方程式为__Ni+H2SO4===NiSO4+H2↑__。
(3)Cu、Ni、Zn的金属活动性由强到弱的顺序是__Zn>Ni>Cu__。
三、实验探究题(共13分)
21.(4分)(2016·永州)现有A、B两种银白色的金属,某同学想要探究这两种金属的活动性。
【设计实验】取大小相同的两块金属,用砂纸打磨光亮,分别放入两支试管中再加入等量的同种稀盐酸,操作与现象如下:
实验
试管1
试管2
操作
现象
金属表面产生气泡较慢
金属表面产生气泡较快
【思考结论】(1)通过上述实验,判断出两种金属的活动性顺序是A__<__(填“>”或“<”)B。
(2)假设其中的一种金属是铁,除观察到铁的表面有气泡产生外,还能观察到反应后的溶液呈__浅绿色__(填“浅绿色”或“黄色”)。
(3)实验前用砂纸打磨金属片的目的是__除去表面的氧化膜__。
(4)如果两种金属是镁和铁,还可以用镁和一种化合物的溶液来证明两者的金属活动性强弱,你认为该化合物可以是__FeSO4__(填化学式)。
22.(9分)(2016·德阳)某校化学兴趣小组的同学在查阅资料时发现,H2和CO都具有还原性,工业上常用于冶炼金属。该小组的同学为了探究H2的还原性,他们设计了如下装置进行实验探究。
请你帮助该小组回答下列有关问题:
(1)装置a的名称是__长颈漏斗__。
(2)A是一种实验室制取气体的发生装置,下列条件下,能够用A作发生装置的是__③__(填编号)。
①液、液加热反应制气体 ②固、固加热反应制气体
③固、液不加热反应制气体 ④固、液加热反应制气体
(3)该小组的同学用盐酸和锌粒来制取氢气,则从A中出来的气体常含有氯化氢气体和水蒸气,在探究氢气的还原性时必须除去这两种气体,以防对实验结果造成干扰,则装置B中盛放的是__硝酸银溶液__,C中盛放的是__浓硫酸__。
(4)在实验过程中若观察到装置D中红色的固体粉末逐渐变成黑色,E装置中浓硫酸增重,则D中发生反应的化学方程式为__3H2+Fe2O3Fe+3H2O__。
四、计算题(共9分)
23.(9分)(2016·十堰)实验室用含杂质的锌与稀硫酸反应制取氢气,取8 g含杂质的锌粒于烧杯中(所含杂质不溶于水,也不与酸反应), 向其中加入74.2 g稀硫酸,恰好完全反应后烧杯内剩余物质的质量为82 g,计算:
(1)杂质的质量______g。
(2)反应后所得溶液的溶质质量分数(请写出计算过程)。
解:生成氢气的质量为:8 g+74.2 g-82 g=0.2 g
设锌的质量为x,生成ZnSO4的质量为y
Zn+H2SO4===ZnSO4+H2↑
65 161 2
x y 0.2 g
65∶2=x∶0.2 g x=6.5 g
杂质的质量=8 g-6.5 g=1.5 g
= y=16.1 g
反应后所得溶液的溶质质量分数为:×100%=20%。
答:(1)杂质的质量为1.5 g;(2)反应后所得溶液的溶质质量分数为20%。