- 122.50 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第16讲 溶液 溶解度
1.调味剂是重要的食品添加剂,将下列调味剂加入水中,不能形成溶液的是( )。
A.食盐 B.蔗糖 C.味精 D.芝麻油
2.(2012年山东聊城)洗涤是生产生活中不可缺少的操作过程,下列洗涤方法错误的是( )。
A.用汽油洗涤手上的油污
B.用氢氧化钠溶液洗涤手上的油污
C.用稀盐酸洗去铁制品表面的铁銹
D.用洗洁精清洗油腻的餐具
3.(2012年山东烟台)溶液对人类的生产生活都有很重要的意义。下列关于溶液的说法正确的是( )。
A.均一、稳定的液体都是溶液
B.溶液组成中一定含有水
C.饱和溶液就是不能再溶解任何物质的溶液
D.融雪剂的作用原理是利用某些物质水溶液的凝固点低于0 ℃
4.(2012年湖北黄冈)下列有关溶液的说法,不正确的是( )。
A.蔗糖溶液是均一、稳定的混合物
B.硝酸钾在20 ℃时溶解度是31.6 g,则100 g 硝酸钾溶液中含有硝酸钾31.6 g
C.在鱼池中设立水泵,把水喷向空中可以增加水中氧气的溶解量
D.冷却或蒸发溶剂都能使接近饱和的氯化钠溶液达到饱和
5.(2012年四川泸州)固体硝酸钾的溶解度曲线如下图所示,下列说法正确的是( )。
A.70 ℃时,硝酸钾的溶解度为114
B.70 ℃时,C点为硝酸钾的不饱和溶液
C.70 ℃时,B点为硝酸钾的饱和溶液
D.A、C两点对应溶液的溶质质量分数相同
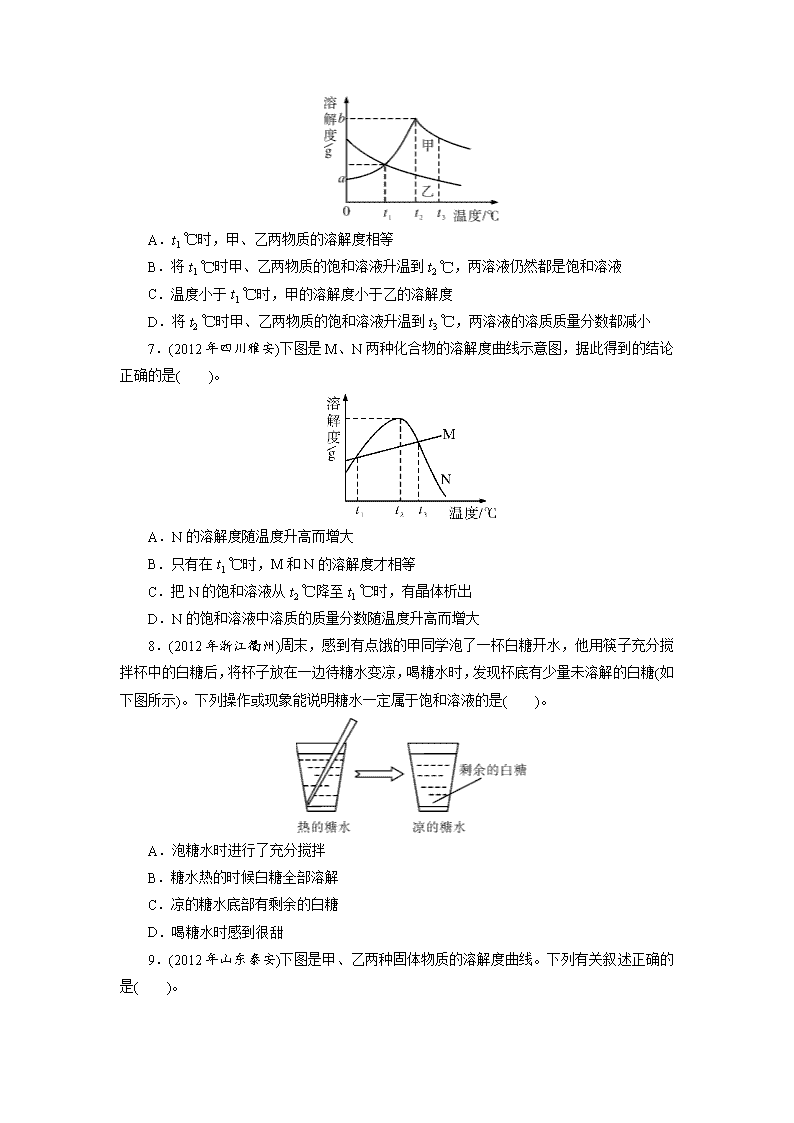
6.(2012年湖南株洲)下图是甲、乙两物质的溶解度曲线图,下列说法错误的是( )。
A.t1 ℃时,甲、乙两物质的溶解度相等
B.将t1 ℃时甲、乙两物质的饱和溶液升温到t2 ℃,两溶液仍然都是饱和溶液
C.温度小于t1 ℃时,甲的溶解度小于乙的溶解度
D.将t2 ℃时甲、乙两物质的饱和溶液升温到t3 ℃,两溶液的溶质质量分数都减小
7.(2012年四川雅安)下图是M、N两种化合物的溶解度曲线示意图,据此得到的结论正确的是( )。
A.N的溶解度随温度升高而增大
B.只有在t1 ℃时,M和N的溶解度才相等
C.把N的饱和溶液从t2 ℃降至t1 ℃时,有晶体析出
D.N的饱和溶液中溶质的质量分数随温度升高而增大
8.(2012年浙江衢州)周末,感到有点饿的甲同学泡了一杯白糖开水,他用筷子充分搅拌杯中的白糖后,将杯子放在一边待糖水变凉,喝糖水时,发现杯底有少量未溶解的白糖(如下图所示)。下列操作或现象能说明糖水一定属于饱和溶液的是( )。
A.泡糖水时进行了充分搅拌
B.糖水热的时候白糖全部溶解
C.凉的糖水底部有剩余的白糖
D.喝糖水时感到很甜
9.(2012年山东泰安)下图是甲、乙两种固体物质的溶解度曲线。下列有关叙述正确的是( )。
A.0 ℃时,甲物质的溶解度为40 g
B.10 ℃时,甲、乙两种物质的溶解度相等
C.30 ℃时,甲物质饱和溶液的质量分数为60%
D.除去甲物质中少量乙物质可采取蒸发的方法
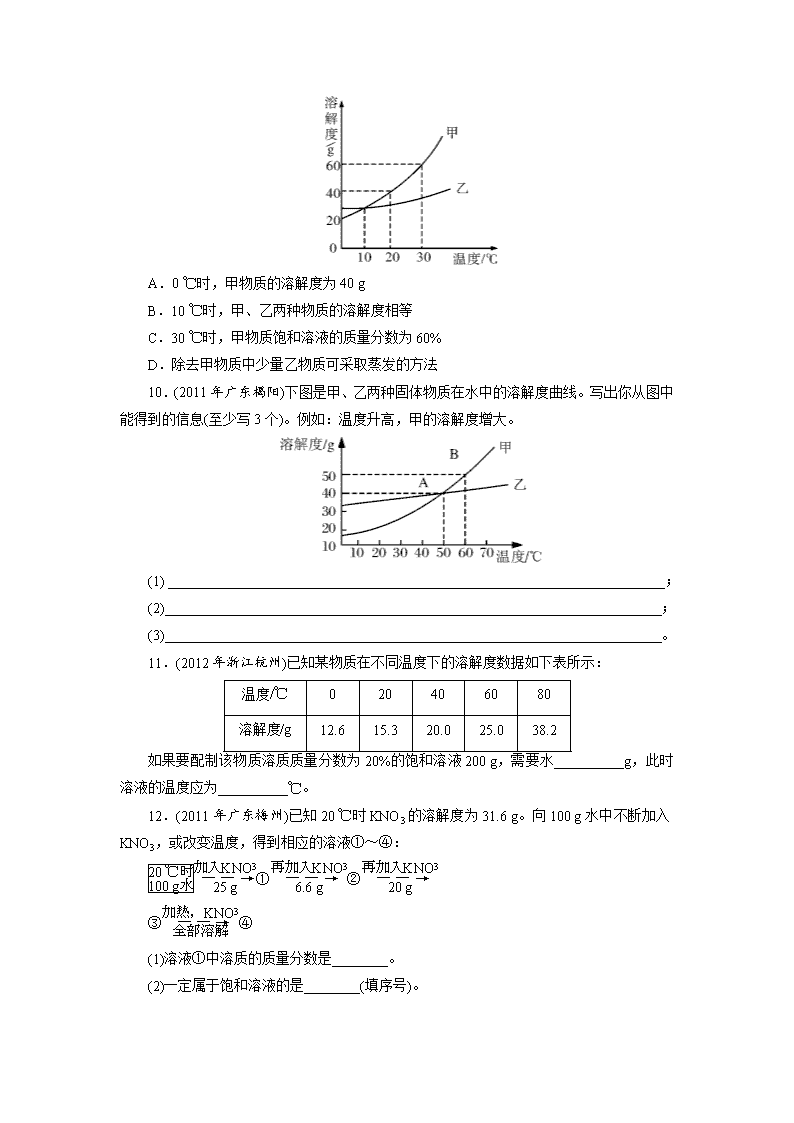
10.(2011年广东揭阳)下图是甲、乙两种固体物质在水中的溶解度曲线。写出你从图中能得到的信息(至少写3个)。例如:温度升高,甲的溶解度增大。
(1) _______________________________________________________________________;
(2)_______________________________________________________________________;
(3)_______________________________________________________________________。
11.(2012年浙江杭州)已知某物质在不同温度下的溶解度数据如下表所示:
温度/℃
0
20
40
60
80
溶解度/g
12.6
15.3
20.0
25.0
38.2
如果要配制该物质溶质质量分数为20%的饱和溶液200 g,需要水__________g,此时溶液的温度应为__________℃。
12.(2011年广东梅州)已知20 ℃时KNO3的溶解度为31.6 g。向100 g水中不断加入KNO3,或改变温度,得到相应的溶液①~④:
①②
③④
(1)溶液①中溶质的质量分数是________。
(2)一定属于饱和溶液的是________(填序号)。
13.(2012年广西贵港)在室温下,甲、乙、丙三种固体分别溶于两支试管和一个烧杯的水中,现象如下图所示,甲、丙还有剩余固体,乙固体全部溶解。升温到80 ℃时,发现甲固体全部溶解,乙固体析出,丙固体没有明显变化。
(1)室温时,________(选填“甲”、“乙”或“丙”)溶液可能是不饱和溶液。
(2)上图中能表示甲物质的溶解度曲线的是______(填“a”、“b”或“c”,下同),能表示乙物质的溶解度曲线的是________。
(3)t2 ℃时,甲、乙、丙三种物质的饱和溶液溶质质量分数由大到小的顺序是________________________________________________________________________。
(4)在温度________时,丙物质的饱和溶液一定比甲物质的饱和溶液溶质质量分数大。
14.(2011年广东清远)根据下面的溶解度表与溶解度曲线回答下列问题。
温度/℃
溶解度
/g
物质
0
20
40
60
80
KNO3
13.3
31.6
63.9
110
169
NaCl
35.7
36.0
36.6
37.3
38.4
Ca(OH)2
0.173
0.165
0.121
0.116
0.094
(1)B是________的溶解度曲线。
(2)40 ℃时,氯化钠的溶解度________(填“大于”、“小于”或“等于”)硝酸钾的溶解度。
(3)硝酸钾中混有少量的氯化钠,想要得到纯净的硝酸钾的方法是________。
(4)欲使硝酸钾的不饱和溶液转化为饱和溶液,可以采取的方法之一是________________。
(5)如右图所示,烧杯A中是饱和的氢氧化钙溶液,向烧杯B中加入生石灰后,烧杯A中变浑浊,可能的原因是______(填字母)。
A.反应消耗水,氢氧化钙析出
B.反应放热,温度升高,氢氧化钙溶解度降低
C.生石灰与水反应生成的氢氧化钙不再溶解
15.(2012年安徽合肥)下列各项中,前者一定大于后者的是( )。
A.20 ℃时KNO3的溶解度、80 ℃时KNO3的溶解度
B.30 ℃时NaCl不饱和溶液的质量分数、30 ℃时NaCl饱和溶液的质量分数
C.碳酸镁中碳元素的质量分数、碳酸氢钠中碳元素的质量分数
D.相同条件下,NaOH溶于水后溶液的温度、NH4NO3溶于水后溶液的温度
16.(2012年山东烟台)a、b、c三种物质的溶解度曲线如右图所示。下列说法正确的是( )。
A.t1 ℃时,a、b、c三种物质的溶解度由大到小的顺序是b>a>c
B.t2 ℃时,30 g a物质加入到50 g水中不断搅拌,所得溶液溶质质量分数为37.5%
C.t2 ℃时,将相同质量的a、b、c三种物质的饱和溶液降温到t1 ℃,析出晶体最多的是a
D.将t1 ℃时c的饱和溶液升温到t2 ℃,变为不饱和溶液
17.(2012年湖北武汉)下图是甲、乙两种固体物质的溶解度曲线。
(1)________℃时,甲、乙两种物质的溶解度相等。
(2)t2 ℃时,将等质量的甲、乙两种物质加水溶解配制成饱和溶液,所得溶液质量的大小关系:甲______乙(填 “>”、“<”或“=”)。
(3)把甲物质的不饱和溶液变为饱和溶液,下列有关说法正确的是________(填序号,下同)。
A.溶剂的质量一定变小
B.溶质的质量可能不变
C.溶质的质量分数一定变大
D.溶液的质量一定变大
E.该饱和溶液还可以溶解其他物质
(4)通常情况下,在实验室用固体甲配制一定溶质质量分数的甲溶液,需用到的仪器有托盘天平(带砝码盒)、烧杯和____________。
A.酒精灯 B.药匙 C.玻璃棒 D.漏斗
E.铁架台 F.量筒 G.胶头滴管
18.(2012年四川宜宾)某化工厂用氨碱法生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%。为测定该产品中含碳酸钠的质量分数,进行了以下实验:取12 g纯碱样品放入烧杯中,称得烧杯及纯碱样品的总质量为158 g,再把100 g稀盐酸平均分成四份,依次加入到样品中,每次均充分反应。实验数据记录如下:
所加盐酸的次数
第一次
第二次
第三次
第四次
盐酸的质量/g
25
25
25
25
烧杯及所盛物质
总质量/g
181.2
204.4
228.6
253.6
请计算:(要求计算过程)
(1)第一次加入稀盐酸充分反应后,生成二氧化碳的质量。
(2)该产品中碳酸钠的质量分数是否合格?
第16讲 溶液 溶解度
【中考演练】答案
1.D 2.B 3.D 4.B
5.D 解析:曲线上及曲线上面区域的点对应的是饱和溶液;曲线以下的点对应的是不饱和溶液。
6.B 7.C 8.C 9.B
10.(1)50 ℃时,甲、乙的溶解度相同
(2)甲比乙的溶解度受温度变化影响大
(3)50 ℃以下时,甲比乙的溶解度更小(合理即可)
11.160 60
解析:=,解得:S=25 g,所以此时溶液的温度是60 ℃。
12.(1)20% (2)②③
13.(1)乙 (2)a c (3)甲>丙>乙 (4)小于t1℃
14.(1)NaCl (2)小于 (3)(重)结晶
(4)加KNO3(固体)(或蒸发水分,或降低温度)
(5)B
15.D 16.C
17.(1)t1 (2)< (3)BE (4)BCFG
18.解:(1)生成二氧化碳的质量=158 g+25 g-181.2 g=1.8 g
(2)算出样品完全反应时,产生CO2的质量为4.4 g
设生成4.4 g CO2,需碳酸钠的质量为x。
Na2CO3+2HCl===2NaCl+H2O+CO2↑
106 44
x 4.4 g
= g
解得:x=10.6 g
w(Na2CO3)=×100%=88.3%
∵96%>88.3%
∴该产品中Na2CO3的质量分数不合格。
答:略。