- 363.50 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
厦门市2009年初中毕业及高中阶段各类学校招生考试
化 学 试 题
(试卷满分:100分;考试时间:90分钟)
准考证号______________ 姓名________________ 座位号_____________
考生注意:1.本学科有两张试卷,一是答题卡,另一是本试题(共6页25题)。请将全部答案填在答题卡的相应答题栏内,否则不能得分。
2.可能用到的相对原子质量:
H一1 C一12 N—l4 O一16 Na—23 Si—28 C1—35.5 Ca-40
一、选择题(本题l5小题,共30分,每小题只有一个选项符合题目要求,请在答题卡选择题栏内用2B铅笔将该选项的序号涂黑)
题记:化学就在我们身边,化学与我们息息相关
1A 2A 3B 4D 5D 6B 7C 8C 9D 10B 11B 12C 13B 14B 15
1.广泛用于制造日常生活用品,且地壳中含量最多的金属元素是
A.铝 B.镁 C.硅 D.铁
2.医生建议小明多吃蔬菜,则小明需要补充的营养素主要是
A.维生素 B.油脂 C.蛋白质 D.无机盐
3.下列做法易使金属被腐蚀的是
A.用过的菜刀擦干B.铝锅盛放酸菜 C.铁护栏涂上油漆 D.自行车钢圈镀铬
4.根据下表判断,肉类变质过程中酸碱性的变化趋势是
名称
新鲜肉
次鲜肉
变质肉
pH
5.8~6.2
6.3~6.6
>6.7
A.酸性变弱 B.酸性变强 C.酸性不变 D.碱性变弱
5.我市在节能减排方面走在全国前列,下列做法不利于节能或减少二氧化碳排放的是
A.使用节能的LED路灯,以减少电能的消耗
B.发展BRT快速公交,以减少汽油的消耗
C.提高现有火电厂煤的利用率,增加单位质量煤的发电量
D.多建燃烧煤或天然气的火电厂,以保证电力的供应
题记:化学是二十一世纪最有用,最有创造力的中心学科
6.科学家发现由C60制取的化合物M有抑制艾滋病毒的作用,下列叙述不正确的是
A.厦大化学家制得了C50,它与C60都是单质
B.某物质含有C50分子和C60分子,该物质是化合物
C.由C60制取化合物M的过程,发生了化学变化
D.C60在空气中燃烧生成二氧化碳的反应是化合反应
7.下列是我市要打造的百亿产业群项目,其中不属于化学研究范畴的是
A.化学纤维的合成与加工 B.钨的冶炼与加工
C.软件的开发与应用 D.橡胶的合成与加工
8.科学发展观要求在经济建设中保护生态环境,则下列做法错误的是
A.设计绿色化学工艺,使原料中的原子100%转移到产物中
B.将垃圾分类回收后用于发电,并将尾气无害化处理后排放
C.将污染较大的企业全部迁到无人海岛,以减少对城市的污染
D.提高工业污水和生活污水的处理标准,减少污染物排放总量
9.科学家用单个分子制成了“纳米车”(如右图),它能在人工操纵下运输药物分子到病源处释放以杀死癌细胞。下列有关“纳米车”的说法正确的是
A.“纳米车”的研制成功说明分子要在人为外力作用下才能运动
B.“纳米车”分子不是由原子构成的
C.“纳米车”运输药物分子的过程是肉眼可以直接看见的
D.“纳米车”研制成功说明在一定条件下人可以控制分子运动
10.下列关于耐高温新型陶瓷——氮化硅(Si3N4)的叙述,正确的是
A.氮化硅中Si、N两种元素的质量比为4:3
B.氮化硅中氮元素的质量分数为60%
C.14g氮化硅中含硅8.4g
D.氮化硅的相对分子质量为l44
题记:创新是民族发展的根本,在活动中学习是创新的起源
11.下列化学实验操作,正确的是
A.点燃酒精灯 B.检查气密性 C.读取液体体积 D.加热液体
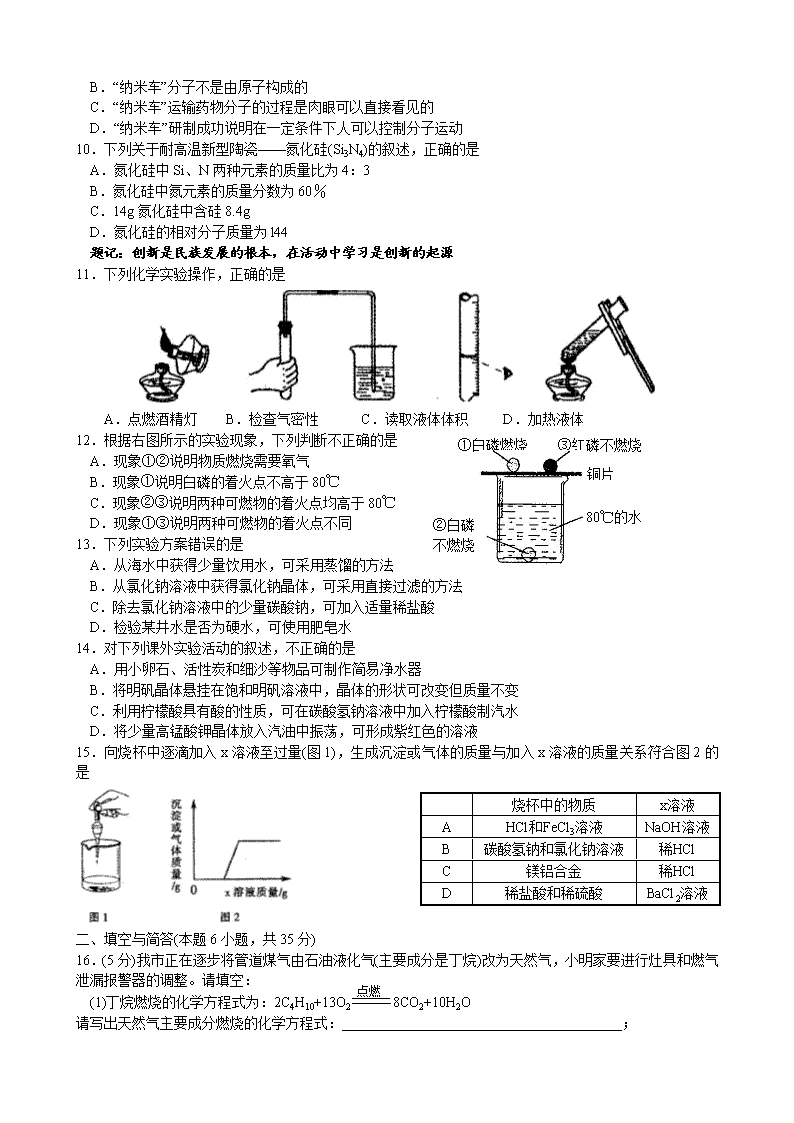
①白磷燃烧
③红磷不燃烧
②白磷
不燃烧
铜片
80℃的水
12.根据右图所示的实验现象,下列判断不正确的是
A.现象①②说明物质燃烧需要氧气
B.现象①说明白磷的着火点不高于80℃
C.现象②③说明两种可燃物的着火点均高于80℃
D.现象①③说明两种可燃物的着火点不同
13.下列实验方案错误的是
A.从海水中获得少量饮用水,可采用蒸馏的方法
B.从氯化钠溶液中获得氯化钠晶体,可采用直接过滤的方法
C.除去氯化钠溶液中的少量碳酸钠,可加入适量稀盐酸
D.检验某井水是否为硬水,可使用肥皂水
14.对下列课外实验活动的叙述,不正确的是
A.用小卵石、活性炭和细沙等物品可制作简易净水器
B.将明矾晶体悬挂在饱和明矾溶液中,晶体的形状可改变但质量不变
C.利用柠檬酸具有酸的性质,可在碳酸氢钠溶液中加入柠檬酸制汽水
D.将少量高锰酸钾晶体放入汽油中振荡,可形成紫红色的溶液
15.向烧杯中逐滴加入x溶液至过量(图1),生成沉淀或气体的质量与加入x溶液的质量关系符合图2的是
烧杯中的物质
x溶液
A
HCl和FeCl3溶液
NaOH溶液
B
碳酸氢钠和氯化钠溶液
稀HCl
C
镁铝合金
稀HCl
D
稀盐酸和稀硫酸
BaCl2溶液
二、填空与简答(本题6小题,共35分)
16.(5分)我市正在逐步将管道煤气由石油液化气(主要成分是丁烷)改为天然气,小明家要进行灶具和燃气泄漏报警器的调整。请填空:
点燃
(1)丁烷燃烧的化学方程式为:2C4H10+13O2 8CO2+10H2O
请写出天然气主要成分燃烧的化学方程式:________________________________________;
(2)若相同条件下,气体体积比等于分子数比。改为天然气后,同体积燃料燃烧消耗空气的体积将____________(填“增大”或“减小”),则灶具的调整方法是减小________(填“燃料”或“空气”)的进气量;
(3)燃气泄漏报警器的位置要从低于灶具的地方移到高于灶具的地方,其原因是__________。
17.(7分)右图是自然界碳循环简图,请回答
(I)含碳单质矿物燃烧的化学方程式为_________________________;
(2)海水吸收二氧化碳时,发生反应的化学方程式为_____________;
(3)植物光合作用时,二氧化碳和水在光的作用下生成葡萄糖
(C6H12O6)和氧气,其化学方程式为___________________________;
(4)人类降低空气中二氧化碳含量的研究有两个方向:一是减少二氧化碳的排放,另一是_____________________________________。
甲
乙
丙
丁
18.(6分)甲、乙、丙、丁是初中化学的常见物质,它们有右图的转化关系:
(1)若丙是最轻的气体,是公认的最清洁燃料,写出符合此转化关系的
一个化学方程式:_________________________;
(2)若甲是极易与血红蛋白结合的有毒气体,乙是一种氧化物,丙是我国早在春秋战国时期就开始生产和使用的一种金属单质,写出符合此转化关系的一个化学方程式:______________________________;
(3)若甲是由淀粉发酵而得的一种液态可再生能源,丙是能使澄清石灰水变浑浊的气体,写出符合此转化关系的一个化学方程式:___________________________。
19.(5分)在CuSO4和ZnSO4的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,没有气泡产生,则滤出的固体是________(填名称),滤液中一定含有的溶质为________、________ (填化学式),有关反应的化学方程式为______________________。
20.(6分)请按右图所示的硫酸知识网络填空(图中“—”表示相连的两种物质能发生反应,“→”表示一种物质能转化成另一种物质):
(1)写出两个属于复分解反应的化学方程式:
①__________________; ②_____________________;
(2)总结出酸的两条化学性质的反应规律:
①__________________; ②_____________________。
21.(6分)根据下图填空:
图1水蒸发实验 图2电解水实验 图3家用电解水器
(1)图2实验的化学方程式为___________________________________;
(2)比较图1和图2两个实验中水的变化,用分子原子的观点分析其不同点:
________________________________________________________________;
pH
水的应用
10.0
浸泡蔬菜
9.5
日常饮用
9.0
烹饪
6.0
洗头发
5.5
洗涤器皿
(3)在图2实验通电时,a试管中液体呈碱性、b试管中液体呈酸性,利用此原理设计的家用电解水器(图3),可得酸碱性不同的水,且各有其用途(见右表)。
①右表中用于“日常饮用”的水遇紫色石蕊试液显_________色;
②家用电解水器生成的碱性水可除去水中有害的重金属离子,生成
小分子团水,因而对健康有益。请用化学符号表示含5个水分子
的水分子团:______________;
③图2装置电解实验完毕,测定剩余水的pH,结果与实验前相同。请对此现象可能的原因提出一个合理的猜想:_________________
___________________________________________________________________________。
三、实验与探究(本题2小题,共l5分)
22.(7分)某兴趣小组要测定高锰酸钾样品的纯度(假设杂质受热不反应),请根据下列装置填空:
(1)组成D装置的两种主要玻璃仪器的名称是______________和____________;
(2)高锰酸钾样品在A装置中反应的化学方程式为______________________________;
(3)A装置试管口要略向下倾斜的原因是___________________________;
(4)要完成测定任务,需选用的装置有___________(填字母),需测量的数据有__________。
23.(8分)NaNO2是—种致癌物质。某兴趣小组为研究水中NaNO2的含量和消除污染的方法,进行了如下目视比色法实验(比较溶液颜色深浅以测定物质浓度的方法),请你参与实验,并填空:
(1)测定方法的研究
配制质量分数为0.07%的NaNO2标准溶液,分别取0、2、4、6、8、10 mL标准溶液于6支试管,加蒸馏水至总体积均为l0mL,分别加入约0.30gM粉未(M是氨基苯磺酸),振荡后制成颜色深浅不同的标准色阶。测定时取10 mL水样,加入约0.30gM粉末,振荡后与标准色阶比较,得出颜色相同的色阶所含标准溶液的毫升数,再按稀释比例计算出水样中NaNO2的质量分数(水和稀溶液的密度均按l g·cm-3计算)。
①配制质量分数为0.07%的NaNO2溶液l000 mL,所需NaNO2的质量是_________g;
②用上述方法测定某水样,其与含2 mL标准溶液的色阶颜色相同,此水样中NaNO2的质量分数为___________;
(2)研究某水样在不同煮沸时间后NaNO2含量的变化
将另一水样用右图装置煮沸,测定不同煮沸时间NaNO2的质量分数,结果为:
煮沸时间(小时)
0
2
4
8
12
NaNO2的质量分数
0
0
0.014%
0.028%
0.056%
①兴趣小组设计的右图实验装置用到了蒸气回流装置,其作用是_______________;
②根据上述数据,可见此水样随煮沸时问的延长NaNO2的质量分数会逐渐_________;
{3)寻找能降低水中NaNO2含量的物质,研究消除污染的有效方法
查阅资料可知,加入醋酸或双氧水可降低水中NaNO2的质量分数,请设计实验证明少量醋酸是否有降低水中NaNO2质量分数的作用,填写下列实验报告:
实验步骤
可能的实验现象
根据可能的实验现象得出的结论
四、信息与分析(本题l小题,共l0分)
13 Al
铝
26.98
14 Si
硅
28.09
类铝
类硅
24.阅读材料,回答问题:
材料一:l869年,俄国化学家门捷列夫对已发现的元素进行研究,制作了
元素周期表(右表是其片断),并在他的元素周期表中留下了许多空
位代表尚未发现的新元素,其中就预言了“类铝”这种新元素。
材料二:l875年,法国化学家布瓦博德朗公布了他发现的新元素镓(元素符号为Ga)的性质:镓是银白色金属,密度4.7g·cm-3,能与沸水剧烈反应生成氢气和氢氧化镓。不久,他收到门捷列夫的来信称:镓就是我预言的“类铝”,其密度应在5.9-6.0 g·cm-3之间。
+X
2
8
18
3
材料三:l876年,布瓦博德朗将金属镓提纯后测得镓的密度为5.94g·cm-3,
从而验证了元素周期表的正确性。随后科学家根据元素周期表的空位,按图
索骥,发现了许多新元素。目前金属镓广泛用于制造半导体材料。镓的原子
结构示意图如右,常见化合价为+3。
(1)镓元素的质子数为__________,其原子最外层电子数为_____________;
(2)请根据上述材料,总结金属镓的有关知识:
物理性质:_____________________________________________;
化学性质(请用化学方程式表示):_____________________________________;
用途:____________________________________;
(3)氢氧化镓与氢氧化钠都具有碱的性质,则氢氧化镓与稀硫酸反应生成盐的化学式为_____________;
(4)请从上述周期表片断中查出硅元素的一种数据,并指出其含义:_________________;
(5)上述材料中,化学家所使用的研究方法及其关系是________________________________。
XX牌
轻质碳酸钙
含量:含钙>40%
质量:25kg
XX化工厂出品
五、计算与应用(本题l小题,共l0分)
25.小明购得用于食用菌种植的轻质碳酸钙,标签如右。为测定
其含钙量小明进行的实验是:
①称取样品5g;
②加入足量7.3%的盐酸充分反应,反应的化学方程式为:
CaCO3+2HCl=CaCl2+H2O+CO2↑
③将所生成的全部气体除杂干燥后,通入l00g氢氧化钠浓
溶液,反应后此溶液总质量为l02.2g。
请计算,并回答下列有关问题:
(1)样品中碳酸钙的质量分数是多少?
(2)标签标示的含钙量是否正确,若不正确应如何改正?
[友情提醒:试题结束,请认真检查!]
厦门市2009年初中毕业及高中阶段各类学校招生考试
化学试题参考答案及评分标准
注:化学方程式评分要求:每个化学方程式2分,所有化学式都正确l分,其他都完整正确l分。另外本卷答案多有开放性,只要学生的答案合理就给分。
一、选择题(每小题只有一个正确选项,每小题2分,共30分)
题号
1
2
3
4
5
6
7
8
9
10
1l
12
13
14
15
答案
A
A
B
A
D
B
C
C
D
C
B
C
B
D
A
点燃
二、填空与简答(6小题,共35分)
16.(5分)(1)CH4+2O2 CO2+2H2O(2分)
点燃
(2)减小(1分),空气(1分) (3)甲烷密度比空气小,而丁烷比空气大(1分)
光
叶绿体
17.(7分)(1)C+O2 CO2(2分) (2)CO2+H2O=H2CO3(2分)
(3)6CO2+6H2O C6H12O6+6O2(2分) (4)增加空气中二氧化碳的消耗(1分)
点燃
高温
18.(6分)(1)Zn+2HCl=ZnCl2+H2↑ (2分,其他正确答案参照给分)
(2)3CO+Fe2O3 2Fe+3CO2 (2分)(3)C2H5OH+3O2 2CO2+3H2O(2分)
19.(5分)铜(1分);ZnSO4、FeSO4(各1分,共2分)
Fe+CuSO4=FeSO4+Cu (2分)
20.(6分)本题有多种可能的正确答案,请注意参照评分。
(1)①Fe2O3+3H2SO4===Fe2(SO4)3+3H2O(2分);
②BaCl2+H2SO4=BaSO4↓+2HCl(2分)
通电
(2)①酸和碱反应生成盐和水;②金属和酸反应生成盐和氢气(各1分,共2分)
21.(6分)(1)2H2O 2H2↑+O2↑ (2分)
(2)图1实验中水分子没有变化,而图2实验中水分子变成了氢分子和氧分子(1分)
(3)①蓝(1分) ②5H2O或(H2O)5 (1分)
③本小题是开放性问题,只要是学生针对本题情况的合理猜想均给1分。如:
两电极产生的酸和碱,在电解完毕后恰好完成中和
三、实验与探究(2小题,共l5分)
△
22.(7分)(1)水槽或导管(1分) 量筒(1分)
(2)2KMnO4 K2MnO4+MnO2 +O2↑(2分)
(3)防止药品中的湿存水加热后,产生的水流回试管底部,使试管破裂(1分)
(4)本小题有多种可能答案,请参照评分(前后各1分,共2分),如:
Ⅰ.A;高锰酸钾样品质量和反应前后A中试管及所盛固体物质的总质量
Ⅱ.AD;高锰酸钾样品质量和测定产生气体的体积
Ⅲ.AB或ABC;高锰酸钾样品质量和反应前后装置B中玻璃管(含铜丝)的总质量
23.(8分)①0.7(1分) ②0.014%(1分)
(2)①保持水的总量不变(1分) ②增多(1分)
(3)(4分,其他合理答案参照给分)
实验步骤
可能的实验现象
可能的结论
取10 mL NaNO2标准溶液于试管,加
入数滴醋酸后振荡,再加入0.3gM粉
末,振荡后与标准色阶比较(2分)
溶液颜色比10 mLNaNO2标准色阶的颜色浅(1分)
少量醋酸有降低NaNO2的作用(1分)
四、信息与分析(1小题,共l0分)
24.(1)31,3(各1分,共2分)
(2)物理性质:银白色金属,密度为5.94g·cm-3(1分)
化学性质:2Ga+6H2O=Ga(OH)3+3H2↑(2分)
用途:制造半导体材料(1分)
(3)Ga2(SO4)3(1分)
(4)相对原子质量(原子量)为28.09或质子数(原子序数、核电荷数)为14(1分)
(5)考生能从两种以上化学研究方法进行说明得2分,如
化学研究方法有理论研究和实验研究
化学理论研究要得到实验研究的验证
化学实验研究为理论研究提供依据
化学理论研究为化学实验研究提供了方向
考生能从一种化学方法或具体方法进行说明得l分,如
化学研究可以使用理论和推理的方法
化学研究可以使用实验的方法
元素周期表研究使用了理论(模型、猜想)的研究方法
镓元素的发现应用了实验研究方法
五、计算与应用(1小题,共l0分)
25.(I)设样品中碳酸钙的质量为x
CaCO3+2HCl===CaCl2+H2O+CO2↑
100 44 ………………(2分)
x 102.2g-100g………………………(2分)
100:x=44:2.2g ……………………(2 分)
x=5g …………………………(1分)
样品中碳酸钙的质量分数为l00% (1分)
(2)碳酸钙中含钙元素的质量分数为
×100%=40%(1分)
标签中“含钙>40%”应该改为“含钙≤40%”(1分)
答:样品中碳酸钙的含量为l00%,标签中“含钙>40%”应该改为“含钙≤40%”。