- 1.51 MB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1
我们身边的物质
(2018•遵义) 某火力发电厂用石灰石吸收废气中的 SO2,部分流程如图。下列说法错误的是
( )
A. 该流程能减少酸
雨的形成
B. 饱和食盐水中的
NaCl 没有参与反应
C. 用 CO2 制取
NaHCO3,符合低碳
理念
D. 用 CaSO4 和煤灰制水泥,
实现废物再利用
(2018•无锡) MgSO4•7H2O 是一种重要的化工原料,某工厂以一种镁矿石(主要成分为 SiO2
和 MgCO3,还含有少量 FeCO3)为原料制备 MgSO4•7H2O 的主要流程如图:
已知:SiO2 既不溶于水也不溶于稀硫酸。请回答下列问题:
(1)“操作 a”的名称是
。
(2)“废渣 Y”中含有少量的 FeOOH,其中铁元素的化合价是
。
(3)MgCO3 溶于稀硫酸的化学方程式为
。
(4)“溶液 A”中加入 H2O2 溶液会生成 Fe2(SO4)3,该反应的化学方程式为
。
(5)选用 MgO 调节 pH 使 Fe3+转化为沉淀,而不选用 NaOH 的原因是
2
3 3
3
。
(18 乌鲁木齐)10.含硫煤燃烧会产生大气污染。为防治该污染,某工厂设计的新的治污方
法不仅吸收了 SO2, 同时还得到了某种化工产品。该工艺流程如图所示,下列叙述
不正确的是
A. 该 流 程 中 可 得 到 化 工 产 品
H2SO4
B. 图中 FeSO4 → Fe2(SO4)3 的反应类型是复分
解反应 C. 该流程中化合价发生改变的元素为 Fe、
S 和 O
D. 图中吸收 SO2 的化学反应方程式为:Fe2(SO4)3 + SO2 + 2H2O == 2FeSO4
+ 2H2SO4
(18 北京)17、炼铁的主要原料是赤铁矿(主要成分是 Fe2O3)、焦炭、空气等,转化过程如下:
(1)②中,反应为 CO2+C 高温 2CO,其中化合价发生改变的元素是 。
(2)③中,CO 与 Fe2O3 反应的化学方程式为 。
(18 北京)18、为保护绿水青山,可将工业残留的钡渣(主要成分为碳酸钡(BaCO3))进行无
害化处理,制取化工原料;硫酸钡(BaSO4)。主要流程如下:
已知:BaSO4 难溶于水,氯化钡(BaCl2)可溶于水。
(1)粉碎钡渣的目的是 。
(2)反应釜 1 中的气体 X 为 。
(3)放反应釜 2 中发生复分解反应的化学方程式为 。
3
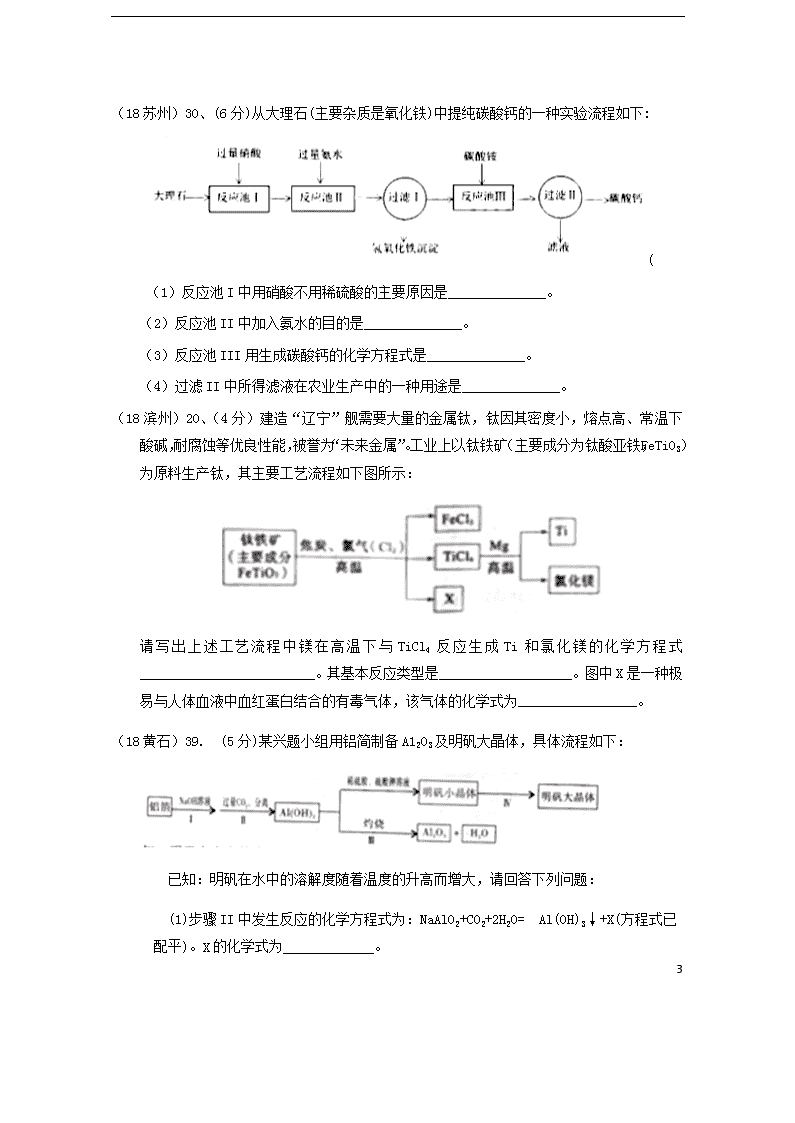
(18 苏州)30、(6 分)从大理石(主要杂质是氧化铁)中提纯碳酸钙的一种实验流程如下:
(
(1)反应池 I 中用硝酸不用稀硫酸的主要原因是______________。
(2)反应池 II 中加入氨水的目的是______________。
(3)反应池 III 用生成碳酸钙的化学方程式是______________。
(4)过滤 II 中所得滤液在农业生产中的一种用途是______________。
(18 滨州)20、(4 分)建造“辽宁”舰需要大量的金属钛,钛因其密度小,熔点高、常温下
酸碱,耐腐蚀等优良性能,被誉为“未来金属”。工业上以钛铁矿(主要成分为钛酸亚铁,FeTiO3)
为原料生产钛,其主要工艺流程如下图所示:
请 写 出 上 述 工 艺 流 程 中 镁 在 高 温 下 与 TiCl4 反 应 生 成 Ti 和 氯 化 镁 的 化 学 方 程 式
_________________________。其基本反应类型是___________________。图中 X 是一种极
易与人体血液中血红蛋白结合的有毒气体,该气体的化学式为_________________。
(18 黄石)39. (5 分)某兴题小组用铝简制备 A12O3 及明矾大晶体,具体流程如下:
已知:明矾在水中的溶解度随着温度的升高而增大,请回答下列问题:
(1)步骤 II 中发生反应的化学方程式为:NaAlO2+CO2+2H2O= Al(OH)3↓+X(方程式已
配平)。X 的化学式为_____________。
4
(2)少骤 III 中发生的反应,其基本反应类型为__________。
(3)写出 Al(OH)3 与硫酸反应的化学方程式____________。
(4)在培养明矾大晶体的过程中,其操作的先后顺序为__________。
A. 自然冷却至室温
B. 选规则明矾小晶体,并用一根细线悬挂在溶液中央
C. 配制 45℃的明矾饱和溶液
(5)写出明矾的一种用途__________。
(8 黄冈)23、金属钨(W)可做白炽灯泡的灯丝。用黑钨矿[主要含有 FeWO4(钨酸亚铁)]
制得金属钨(W)的工艺流程如下图所示:
其主要反应原理如下:
①4FeWO4+4Na2CO3+O2 4Na2WO4+2Fe2O3+4CO2
②Na2WO4+2HCl(热浓)=H2WO4+2NaCl
③H2WO4 H2O+WO3 ④3H2+WO3 W+3H2O
下列说法不正确的是
A.反应③属于分解反应 B.反应①②③④的产物都有氧化物
C.反应①④中有元素的化合价发生改变 D.为加快反应的速率,可将黑钨矿石碾成粉末
(18 呼和浩特)8.黄铁矿的主要成分为二硫化亚铁(FeS2),工业上可利用黄铁矿煅烧的产物
冶炼铁和生产浓硫酸,其工业流程如下:
5
下列说法错误的是
A.反应②不是置换反应,反应③④为化合反应
B.反应①中各元素的化合价均发生了改变
C.该工业生产过程产生的废气中的 SO2 可以用熟石灰溶液吸收
D.向制得的 100 克 98%的浓硫酸中加入 100 克蒸馏水,配制 49%的稀硫酸
(18 娄底)20.(4 分)2018 年 5 月 23 日至 25 日,第九届中国卫星导航年会在哈尔滨拉开帷
幕,中海达、华大北斗等一批国内企业先后发布了自主研发的北斗芯片产品。芯片的主要成分
是硅,如图是工业上以石英砂(SiO2)为主要原料制取纯硅的种方法,请回答以下问题。
(1)地壳中硅元素的含量仅次于 元 素;
(2)写出反应①的化学方程 ;
(3)反应②的基本反应类型是 ;
(4)尾气氯化氢必须收集处理,不能排放到空气中,请简要说明原因 。
(18 潍坊)25.(8 分)(8 分)某课外研究小组,用废弃的黄铜(铜锌合金),通过两种途径制
取硫酸铜晶体。实验流程如图所示:
6
(1)操作 a 为 ,该操作中用到的玻璃仪器有烧杯、 、玻璃棒。
(2)浓硫酸是化学实验室里一种常见的酸。
①实验室稀释浓硫酸的操作是:将 ,并用玻璃棒不断搅拌。
②化学实验应高度关注安全问题。若不慎将少量浓硫酸沾到皮肤上,应先用大量水冲洗,再涂
溶液。
(3)如图 2 是实验室用过氧化氢溶液和二氧化锰制取氧气的装置。
①主要实验操作步骤有:
a.收集气体 b.检查装置气密性 c.将二氧化锰放入锥形瓶中 d.从长颈漏斗中注入过氧化氢
溶液
正确的操作顺序是 (写字母序号)。
②在实验过程中,某同学因加入的药品量不足,致使集气瓶内剩余少量水。若想集满这瓶氧气,
在不拆卸装置和不添加药品的前提下,请帮他想出种解决的方法 。
(4)操作 b 的顺序为蒸发浓缩、 过滤、干燥。
(5)下列测定稀硫酸 pH 的操作正确的是 (写字母序号)。
A.将 pH 试纸直接插入稀硫酸中
7
B.先将 pH 试纸用蒸馏水润湿
C.用玻璃梓蘸取少量稀硫酸,滴在 pH 试纸上
D.根据试纸显示的颜色估算出溶液的 pH
(18 广东)21.(8 分)孔雀石主要成分为 Cu2(OH)2CO3(难溶于水),还含有少量 SiO2(难溶于水、
不与稀硫酸反应)、Fe2O3 等杂质。现以孔雀石为原料制取胆矾(CuSO4·5H2O)的部分工艺
流程如“题 21 图”。
请回答:
(1)滤渣 b 的化学式为______。
(2)溶液 c 中的溶质有(写化学式):H2SO4、______、_______。
(3)盐溶液 d 的颜色为_______;实验室蒸发溶液时用到的玻璃仪器有_____(写 1 种)。
(4)在气体 a 生成 CaCO3 的过程中,发生反应:CO2+CaCl2+NH3+H2O=CaCO3↓+2X,X 的名称为
_______;孔雀石与稀硫酸反应生成气体 a 的化学方程式为________。
(18 温州)32.工业生产常用“苛化法”制取氢氧化钠其原料为碳酸钠、石灰乳[由 Ca(OH)2 和
水组成的混合物],大致流程如下。
科学兴趣小组模拟上述流程,在实验室中制备氢氧化钠。
8
(1)实验室进行“操作 1”时,需要用到下列器材中的_______(可多选).
(2)制备氢氧化钠的化学方程式为,Na2CO3+Ca(OH)2=2NaOH+CaCO3↓.将 53 克溶质质量分数
为 20%的碳酸钠溶液与 17 克石灰乳混合,若二者恰好完全反应出计算所得氢氧化钠溶液的
溶质质量分数。(写出计算过程,计算结果精确到 0.1%)
(18 江西)19、(5 分)分子筛(又称为沸石,主要成分为水和硅铝酸钠)可作为催化剂或吸附剂
等,以高岭土[主要成分为 Al2(Si2O5] (OH)4]。烧碱等为主要原料生产分子筛的工艺流程
如下:
(1)步骤①所得烧渣中主要含有两种固体氧化物,分别为 SiO2 和_____(写化学式)
(2)步骤②加入 NaOH 溶液前需将烧渣粉碎,其目的是________________________。
(3)步骤③发生的反应之一是 Na2SiO3 溶液和通入的 CO2 气体生成偏硅酸(H2SiO3)沉淀和碳
酸氢钠,该反应的化学方程式为___________________。
(4)上述流程中可以循环利用的物质(水除外)是_____________________。
(18 杭州)23.(4 分)某化工厂利用含有 1% -2%BaCO3 的废料制取 BaCl2(废料中其他物质不溶
于水和稀盐酸、且不与稀盐酸反应)。其部分流程如下:
9
滤渣必须经过充分洗涤,确保其中 Ba2+含最达到规定标准才能作为固体度弃物处理,检验 Ba2+
的试剂可用______,洗涤滤渣的主要目的是________。
(18 扬州)25、(13 分)某工厂产生的废渣主要成分是含钙的化合物(杂质为 Fe2O3)。用该废
渣制取 CaCl2 晶体(CaCl2·xH2O)并进行组成测定,其制取的流程如下图所示:
已知:NH4Cl 溶液显酸性,且浓度越高酸性越强
(1)XRD 图谱可用于判断某固态物质是否存在。右图为煅烧前后废渣的 XRD 图谱。写出煅
烧时发生的化学反应方程式________________________________。
(2)浸取时需连续搅拌,其目的是_________________;生成的 NH3 能使湿润的红色石蕊
试纸变____________色。
(3)在其它条件相同的情况下,CaCl2 的产率随浸取温度的变化如下图所示。则宜选择的
浸取温度为____________℃左右。
10
(4)若使用过量浓度较高的 NH4Cl 溶液,则所得 CaCl2 溶液中会含有 NH4Cl、_______(填
化学式)等杂质。
(5)过滤得到的 Fe2O3 在高温下可与 CO 反应,写出该反应的化学方程式
____________________________。
96 测定晶体(CaCl2·xH2O)的组成:
a.称取 14.7000g CaCl2 晶体于锥形瓶内,加入适量蒸馏水.使其全部溶解。
b.再向其中加入足量的 Na2CO3 溶液,静置。
C.过滤、洗涤、干燥、称量,得到 10.0000g 固体。
①通过计算,确定 x 的值(写出计算过程)。______________________。
②判断步骤 b 中沉淀完全的方法是:静置,向上层清液中滴加__________,则说明已沉淀
完全;若沉淀不完全,则测得的 x 值比实际值______(填“偏大”、“偏小”或“ 不变”。
(18 德阳)30.(8 分)氢氧化镁是一种重要的化工原料,某矿石由 MgO、Fe2O3、CuO 和 SiO2
组成。用它制备氢氧化镁的流程示意图如下:
部分金属阳离子以氢氧化物形成沉淀时溶液的 pH 见下表:
沉淀物 Fe(OH)3 Cu(OH)2 Mg(OH)2
开始沉淀 1.9 4.2 9.1
完全沉淀 3.2 6.7 11.1
(1)熟石灰主要成分的化学式是 。
(2)溶液 A 中的阳离子是 (填离子符号)。
(3)沉淀 C 的成分是 。
(4)溶液 B 与熟石灰反应的化学方程式是 。
11
(18 泸州)46.工业上用闪锌矿(主要含 ZnS,还含 PbS 等杂质)制备锌的流程如下(部分产物略
去):
(1)X 的化学式是_______, 图中用过量空气的目的是_________ 。
(2)①~④中属于化合反应的是______。
(3)Zn______(填“能”或“不能 )与 PbCl2 溶液反应。
(4)写出反应③中生成 ZnO 的化学方程式_________。
(5)结合下表数据设计:从粗锌中分离出纯锌的方案是_________。
物质 Zn Pb C
沸点℃ 907 1749 4827
(6)反应②中固体质量随反应时间的变化图示如右图,计算产生 Y 的质量。(写出必要的计
算过程)
(18 成都)18.(9 分)某同学设计的工业制备氢氧化钠的流程如下图。
资料:
12
2NaCl+2H2O 2NaOH+H2↑+Cl2↑,两电极,一端得到 NaOH 和 H2,另一端得到 Cl2。(1)晾
晒海水得到粗盐的原理是
(2)实验室蒸发用到的仪器有铁架台(带铁圈)、堆埚钳、石棉网、酒精灯、玻璃棒和
(3)工业生产中应选择途径 (“①”或“②”),理由是
(4)Cl2 可用于生产 84 消毒液(有效成分 NaClO),反应原理为:
Cl2+2NaOH=NaCl+NaClO+H2O,反应前后氯元素的化合价有_ 种。
(5)图 1 实验测定水的组成,不能加入 NaCl 增强水的导电性的理由是 。电解水的化学方
程式为
(6)图 2 实验获得 84 消毒液,直流电源正极应与 (填 a 或 b)连接,才能使 NaClO 的含量更
高。
(18 重庆 A)20、(4 分)某工厂的废水中含有 MgSO4 和 FeCl3,技术人员逐渐加入 NaOH 溶液调
节废水的 pH,先后分离出两种沉淀,并通过系列处理得到有价值的产品。操作流程如下图
所示。
13
(1)固体 A 与某酸反应的化学方程式为______________________________________。操
作②时,当______________即可停止加热。
(2)固体 B 加热的产物是两种常见氧化物,则另一种氧化物的化学式为
__________________。
(3)溶液 a 除了可能含有 NaOH 外,还一定含有的溶质是_____________(填化学式)。
(18 重庆 B)20.(5 分)老师要求用规定量的 BaCl2 溶液与适量的 Na2SO4 溶液制备 BaSO4。完成
操作Ⅰ后。丁丁发现自己错把 Na2CO3 溶液当成 Na2SO4 溶液,而此时 BaCl2 溶液已完全清耗。
老师启发他,可用生成物和其他试剂完成制备 BaSO4 的实验。整个实验流程如下图所示:
(1)反应②的化学方程式为 ,溶液 b 中的溶质有 。
(2)反应③的基本反应类型为
(3)操作Ⅱ的名称为
(4)从理论上讲,该实验过程最终得到的 BaSO4 质量与原方案得到的 BaSO4 质量是否相等?
(填“是”或“否”)。
(18 连云港)38. (10 分)过氧化钙( CaO2)是用途广泛的优良供氧剂。以电石渣[主要成分
为 Ca(OH)2,含少量 CaCO3 为原料制备 CaO2 的一种工艺流程如下:
14
【查阅资料】I. Ca(OH)2+2NH4Cl=CaCl2+2NH3·H2O
Ⅱ.CaCl2+2NH3·H2O+H2O2 +6H2O= CaO2·8H2O↓+ 2NH4Cl
Ⅲ. CaO2·8H2O 在水中不太稳定,会缓慢分解。
(1)“提取 Ca(OH)2”时反应的基本类型是_______;Ca(OH)2 的俗名为_______;“过滤 1”
所得滤渣的主要成分是_______。
(2)在实验室进行过滤操作时,要遵循“一贴、二低、三靠”原则。其中“二低”指的是:
滤纸边缘略低于漏斗口、_______。生产过程中为了精确测定溶液的 pH,常使用_______ (填
仪器名称)。
(3)在其他条件不变的情况下,制备 CaO2·8H2O 的反应时间(t)对其产率(w)的影响如图所
示。
①平均反应速率最快的时间段为:_______ (填字母)。
a. 0~10min b. 10~20min c. 20~30min d.30~40min
②30min 后,w 开始下降的主要原因是_______。
(4) 为了测定加入的 NH4Cl 溶液中溶质的质量分数,取 30.00g NH4Cl 溶液于烧杯中,加入稍
过量的 AgNO3 溶液,完全反应后过滤、洗涤、干燥、称量,得到 14.35g 白色固体。通过计算
确定该溶液中 NH4Cl 的质量分数(精确到 0.1%)____。
15
(18 临沂)27. 某工厂附近海水中含有较多 Na2CO3 等物质。该工厂采用海水脱硫技术吸收燃
煤烟气中的 SO2,其主要设备及流程如下:
(1)海水脱硫设备中,排出的海水呈碱性的是______(填字母序号)。
A.海水泵 B.吸收塔 C.曝气池① D.曝气池②
(2)向曝气池①内通入空气后,主要有两个化合反应发生,写出其中一个反应的化学方程
式____________。
(3)曝气池②排放的海水中不含 H2SO4 的原因是__________ (用化学方程式表示)。
(18 广州)25.(7 分)氧化锌(ZnO)可作为紫外线吸收剂应用于化妆品中,其一种生产工艺如下
(1)推测草酸的化学式是 ;
(2)“沉锌”过程中发生复分解反应,反应的化学方程式是
(3) “操作 A”的名称是 实验室常用的研磨仪器是 ;
(4)“高温灼烧”时草酸锌分解,反应的化学方程式是 。
(18 长沙)44.我市教育主管部门为了让同学们过好传统佳节一一端午节,特意将中考提前一
天。化学兴趣小组的同学们为庆祝端午佳节,决定自己动手制作传统食品一一皮蛋.制作皮
蛋料泥的原料主要有:生石灰、纯碱、草木灰(含 K2CO3)等.将他们按一定比例混合加入适
量水得到皮蛋料泥.料泥的主要成分是什么呢?同学们进行了如图所示的探究:
16
(1)步骤②的操作所需的玻璃仪器有:烧杯、玻璃棒、____________________;
(2)步骤③的现象说明滤渣中一定含有的物质为:____________________;
(3)由上述实验现象推断,滤液中的溶质一定含有:____________________;
(18 乌鲁木齐)
13. 6 分)CaCl2 应用广泛,以石灰石(杂质主要是 Fe2O3、MgSO4)为原料生产 CaCl2 的流程如
下:
17
(1)氧化铁和盐酸反应的化学方程式为 。
(2)过滤操作中用到的玻璃仪器有烧杯、玻璃棒和 。
(3)滤液 1 中的溶质有 HCl、FeCl3、MgSO4 和 。
(4)写出滤液 1 中加入 BaCl2 发生的化学反应方程式 。
(5)滤液 2 中加入 Ca(OH)2 可以除去 HCl、MgCl2 和 。
(6)滤液 3 呈碱性,为使溶液 pH 降低,可加入适量的 。
26.(2018 广西省玉林市,题号 26,分值 6)利用某工业废弃固体(成分为 Cu2S 和 FeS2)制
备硫酸铜溶液和硫酸亚铁晶体,流程如下图所示。
(已知:①固体 B 含有氧化铜、氧化铁 ②铁能与硫酸铁反应,生成硫酸亚铁)
(1)操作 I 是______,为了提高废弃固体的反应速率,除将固体粉碎、提高温度外,还可以
采取的具体措施有______(写一条)。
(2)写出 FeS2 在空气中灼烧的化学方程式______。
(3)溶液 C 中的溶质有______(用化学式表示)。
(4)试剂 y 的作用是______。
【思路分析】根据题意可知,固体 B 中有氧化铜和氧化铁,氧化铜和硫酸反应生成硫酸铜和
水;氧化铁和硫酸反应生成硫酸铁和水。又因为硫酸是过量的,所以溶液 C 中的溶质有硫酸
铜、硫酸铁、硫酸。往溶液 C 中加入过量 x,得到固体 D 和溶液 E,所以操作Ⅰ是过滤;溶
液 E 经过一系列操作变成了硫酸亚铁晶体,推出溶液 E 是硫酸亚铁溶液。根据铁和硫酸铁反
应生成硫酸亚铁,推出 x 是过量的铁;铁和硫酸铜反应生成硫酸亚铁和铜,所以固体 D 是铜
和铁;固体 D 和过量 y 反应生成硫酸亚铁,说明 y 是硫酸,因为硫酸和铁反应生成硫酸亚铁
和氢气,据此分析即可。
【解题过程】根据题意可知,固体 B 中有氧化铜和氧化铁,氧化铜和硫酸反应生成硫酸铜和
水;氧化铁和硫酸反应生成硫酸铁和水。又因为硫酸是过量的,所以溶液 C 中的溶质有硫酸
铜、硫酸铁、硫酸。往溶液 C 中加入过量 x,得到固体 D 和溶液 E,所以操作Ⅰ是过滤;溶
液 E 经过一系列操作变成了硫酸亚铁晶体,推出溶液 E 是硫酸亚铁溶液。根据铁和硫酸铁反
18
应生成硫酸亚铁,推出 x 是过量的铁;铁和硫酸铜反应生成硫酸亚铁和铜,所以固体 D 是铜
和铁;固体 D 和过量 y 反应生成硫酸亚铁,说明 y 是硫酸,因为硫酸和铁反应生成硫酸亚铁
和氢气。
(1)根据以上分析可知,操作 I 是过滤,为了提高废弃固体的反应速率,还可以采取的具体
措施有搅拌使其充分反应(合理即可)。
(2) FeS2 和氧气点燃生成氧化铁和二氧化硫,其化学方程式为
。
(3)溶液 C 中的溶质有硫酸铜、硫酸铁和硫酸,化学式为 ;
(4)试剂 y 是硫酸,硫酸和铁反应,但不和铜反应,它的作用是除去固体中的铁。
【知识点】过滤;增大反应速率的措施;书写化学方程式;溶质的确定;硫酸的化学性质
(18 南宁)27.碳酸钡是一种重要的化工产品,某厂用含二氧化硅杂质的碳酸钡原料生产
碳酸钡产品,采用了以下的工艺流程:
(1)为节约成本,过程中的生成物可直接应用于流程的是 ,加入过量的盐酸的目的
是
(2)向氯化钡溶液中加入过量的氢氧化钾并通入二氧化碳,其中能生成碳酸钡的方程式
是 。
(3)溶液 A 中溶质的成分,可能的组合有 。
(4)操作 3 包括的两个操作是 。
(18 烟台)17.(6 分)2017 年 12 月 28 日,全球首段承载式太阳能光伏发电公路试验段在
我省建成通车。高纯硅是光伏发电的重要材料,生产高纯硅的流程图如图:
2 2 2 3 24FeS 11 2Fe 8O O SO+ = +点燃
( )2 4 2 43CuO Fe SO H SO、 、
19
(1)生产高纯硅需要对普通石英砂(含有少量 Fe2O3 杂质)进行提纯,其中酸洗是一个重
要的步骤。请写出用盐酸除去 Fe2O3 的化学方程式 。
(2)整个生产过程中必须控制无氧、无水。在 HSiCl3 与 H2 反应过程中若混入 O2,可能引
起的后果是 。HSiCl3 遇水能剧烈反应生成 H2SiO3、H2 与 HCl,该反应的化学方程式
是 。
(3)为了节约资源,上述生产流程中可循环利用的物质是 (填化学式)。
(18 昆明)25.(6 分)金属钛被用于航空航天工业、化工、医疗等领域。用钛铁矿(主要
成份为 FeTiO3)制取钛并获得副产品 A 的主要工艺流程如下:
(1)反应①的化学方程式为 。
(2)TiO2 与焦炭(C)和 Cl2 在高温下反应,该反应中 C 和 Cl2 按质量比为 12:71 的比例参
加反应,相应的化学方程式为 。
(3)反应②的产物除红色固体 A 外,还有两种组成元素相同且相对分子质量相差 16 的气体。
则该反应的化学方程式为 。