- 215.50 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
中考专题特训(二十) 质量守恒定律化学方程式及其计算
(时间:45分钟分值: 00分)
班级 姓名 学号
本卷可能用到的相对原子质量:H:1 C:12 N:14 0:16 S:32 C1:35.5
Ca:40 Na:23 Cu:64
一、选择题(每小题4分,共36分)
1. (2011·荆门)根据化学方程式不能获得的信息是( )
A. 反应中的反应物和生成物
B. 各反应物、生成物之间的质量比
C. 化学反应速率的快慢程度
D. 反应发生所需要的条件
2. (2011·苏州)下列观点符合质量守恒定律的是 ( )
A.煤燃烧后剩余残渣的质量减轻了
B.一定条件下,S02和02生成S03,反应前后分子总数不变
C.8gCH4完全燃烧生成8gC02
D.某有机物在空气中燃烧只生成C02和H。O,则该有机物一定含有碳、氢、氧元素
3. (2010-陕西)下列实验能够直接用于验证质量守恒定律的是 ( )
4. (2010·河南)下列各组物质充分反应后,溶液质量比反应前的溶液质量减小的是
( )
A. 铁片浸入稀硫酸中
B. 铁片浸入硫酸铜溶液中
C. 氧化铁粉末加入稀盐酸中
D. 碳酸氢钠粉末加入稀盐酸中
5. (2011·徐州)科学研究表明,氨气在常压下就可液化为液氨,液氨可用作汽车的清洁燃
料,其燃烧时的主要反应为4NH3+3O2===2X+6H2O0下列说法中不正确的是( )
A. 氨气在常压下液化是物理变化
B. X的化学式为N2
C. 液氨具有可燃性属于化学性质
D. 液氨属于混合物
6. (2011·南充)下列化学方程式符合事实且书写正确的是 ( )
A. 向氯化钙溶液中通入少量的C02:CaCl2+C02+H2O===CaC03↓+2HCl
B. 用稀硫酸洗去附着在试管壁上的铜:Cu+H2S04===CuS04+H2↑
C. 铁丝在氧气中燃烧的反应:4Fe+3022Fe203
D. 高温煅烧石灰石制取生石灰:CaCO3CaO+C02↑
7. (2009·黔东南)下列叙述完全符合质量守恒定律的是 ( )
A. 水结成冰前后,质量保持不变
B. 50毫升水和50毫升乙醇混合后总体积小于l00毫升
C. 在100克过氧化氢溶液中,含有30克过氧化氢和70克水
D. 1.2克碳与3.2克氧气恰好完全反应可生成4.4克二氧化碳
8. (2011·无锡)将一定量的丙醇(C3H8O)和氧气置于一个封闭的容器中引燃。测得反应
前后各物质的质量如下表:
物质
丙醇
氧气
水
二氧化碳
X
反应前质量/g
6.0
12.8
O
0
O
反应后质量/g
0
O
7.2
8.8
a
下列判断正确的是 ( )
A. 表中a的值为2.8
B. X一定是该反应的催化剂
C. X可能含有氢元素
D. 若起始时氧气的质量是14.4g。则生成X更多
9. (2012·预测)相同质量、等质量分数的三份稀盐酸,分别与:①CaO,②Ca(OH)2,③CaC03
恰好完全反应得无色澄清溶液,则所得溶液中CaCl2的质量分数大小关系的比较下列正确的是 ( )
A.①=③>② B.①>②>③
C.③>②>① D.①=②=③
二、填空简答题(每空3分,共45分)
10.(2010·义乌)某物质在氧气中燃烧产生无色无味的气体,把产生的气体依次通过澄清石
灰水和无水硫酸铜粉末,发现澄清石灰水变浑浊、无水硫酸铜粉末变蓝色。由此可知,该物质中肯定含有 元素。
11.(2011·内江)往盛有氯气(C12)的集气瓶中,不断通入氨气,首先发生置换反应生成一
种空气中含量最多的气体,随后出现大量白烟,该白烟是由一种铵盐的固体小颗粒形成的。试写出上述过程中发生反应的化学方程式: 。
12.(2010·泸州)在天平两端各放等质量的两个锥形瓶(瓶口用单孔塞和导管连接起来.气
球中装有等质量的大理石),如图所示。左盘锥形瓶中
盛有M克水,右盘锥形瓶中盛有M克稀盐酸,天平平衡。
(1) 实验开始时,将气球中的大理石倒入锥形瓶中,
观察到的现象是 ,天平
的指针 (填“偏左”、“偏右”或“在
标尺中央”,下同)。
(2) 待上述实验的反应完成后,将锥形瓶瓶口上的单孔塞、导管和气球去掉,天平的指
针 ;原因是 。
13.(2012·预测)硅与我们的生活密切相关,除电子产品的材料中含有硅外.建造房屋的水
泥,日常使用的碗碟等,也都是南含硅物质制造出来的。请回答:
(1) 硅元索是自然界中分布很广的一种元素,它属于 (填“金属”或“非金
属”)元素.在地壳里的含量居第 位。
(2) 太阳镜的玻璃镜片的主要成分是si02,其中Si元素的化合价为 。
(3) 氮化硅是一种耐高温陶瓷材料,工业上制得氮化硅的化学方程式为:3Si+2N2
X(X为氮化硅),则氮化硅的化学式为 ,你推断的理由是 。
14.(2011·南昌)如图所示A~G是初中化学常见的物质。
图中“→”表示转化关系,“-”表示相互能反应。已知A是人体胃液中含有的酸,G是最轻的气体,B、C、D、E、F都是氧化物。请回答:
(1) G的化学式为 ,E与F发生化学反应的基 本类型是 .写出物质B的一种用途 。
(2) C、D发生反应的化学方程式可能为 。
三、实验探究题(每空3分.共9分)
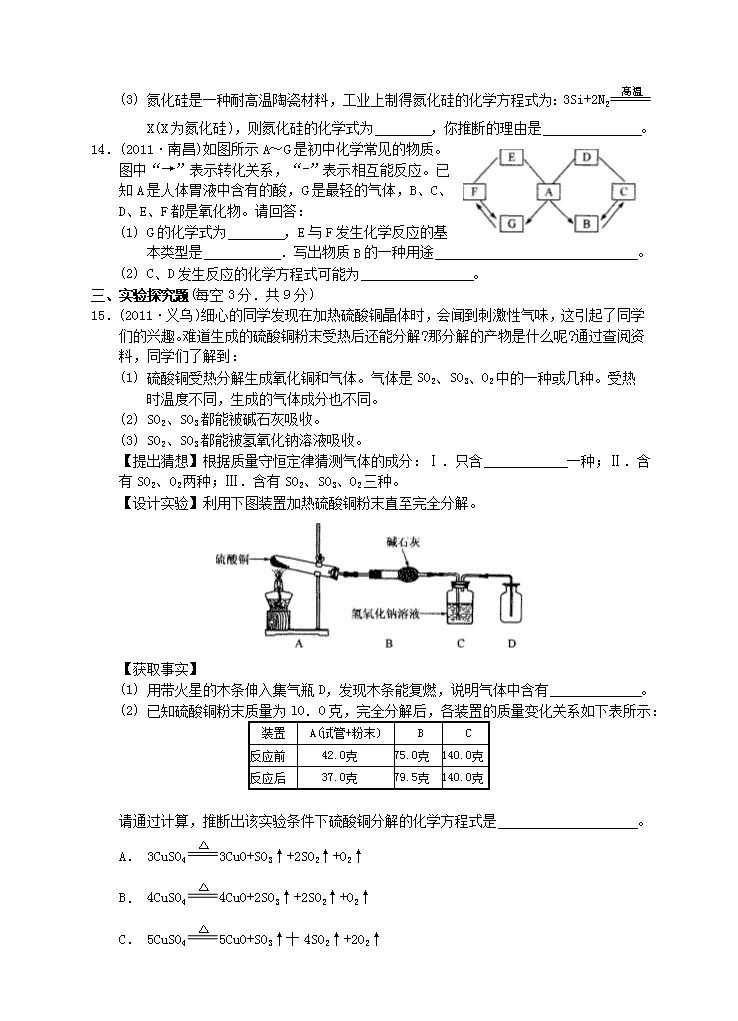
15.(2011·义乌)细心的同学发现在加热硫酸铜晶体时,会闻到刺激性气味,这引起了同学
们的兴趣。难道生成的硫酸铜粉末受热后还能分解?那分解的产物是什么呢?通过查阅资料,同学们了解到:
(1) 硫酸铜受热分解生成氧化铜和气体。气体是S02、S03、02中的一种或几种。受热
时温度不同,生成的气体成分也不同。
(2) SO2、S03都能被碱石灰吸收。
(3) S02、S03都能被氢氧化钠溶液吸收。
【提出猜想】根据质量守恒定律猜测气体的成分:Ⅰ.只含 一种;Ⅱ.含有S02、02两种;Ⅲ.含有S02、SO3、02三种。
【设计实验】利用下图装置加热硫酸铜粉末直至完全分解。
【获取事实】
(1) 用带火星的木条伸入集气瓶D,发现木条能复燃,说明气体中含有 。
(2) 已知硫酸铜粉末质量为l0.0克,完全分解后,各装置的质量变化关系如下表所示:
装置
A(试管+粉末)
B
C
反应前
42.0克
75.0克
140.0克
反应后
37.0克
79.5克
140.0克
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是 。
A. 3CuSO43Cu0+SO3↑+2SO2↑+O2↑
B. 4CuS044CuO+2SO3↑+2S02↑+02↑
C. 5CuS045CuO+SO3↑十4S02↑+202↑
D. 6CuSO46CuO+4SO3↑+2SO2↑+02↑
四、分析计算题(10分)
16.(2010·桂林)课外活动小组的同学在测定由NaCl和Na2CO3形成的固体混合物组成时,
进行了以下实验:取40g固体混合物配成溶液。平均分为四份,然后分别加人一定质量分数的CaCl2溶液,实验数据见下表:
实验一
实验二
实验三
实验四
原固体混合物质量
10g
10g
10g
10g
加入CaCl2溶液质量
10g
20g
30g
40g
生成的沉淀的质量
2g
m
5g
5g
请分析表中数据回答并计算[(4)要求写计算过程]。
(1) 生成的沉淀是(填写化学式) 。
(2) 10g原固体混合物配成的溶液和足量CaCl2溶液反应,最多生成沉淀质量为 g。
(3) m= g。
(4) 原固体混合物中Na2CO3的质量分数是多少?