- 181.00 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
要题加练三 金属的活动性顺序
姓名:________ 班级:________ 限时:______分钟
1.利用盐酸和硝酸银探究铁、铜、银的金属活动顺序,下列实验可以不需要进行的是( )
A.铁+稀盐酸 B.铜+稀盐酸
C.银+稀盐酸 D.铜+硝酸银溶液
2.下列事实能说明铝的金属活动性比铁或铜强的是( )
A.铝在地壳中含量比铁高
B.铝的熔点低于铜的熔点
C.空气中铁比铝更容易被腐蚀
D.铝丝在硫酸铜溶液中能形成“铜树”
3.金属活动性顺序表在化学学习中有重要作用。下列说法正确的是( )
A.Zn不能置换出稀硫酸中的氢
B.Ag能将硝酸铜溶液中的铜置换出来
C.在Al、Mg、Fe中金属活动性最强的是Al
D.“真金不怕火炼”说明金在高温时也不与氧气反应
4.用置换反应验证铁的金属活动性比铜强,下列各组药品能达到目的的是( )
A.Ag、FeSO4溶液、CuSO4溶液
B.Fe、Cu、稀H2SO4溶液
C.Fe、Cu、ZnSO4
D.Fe、Cu、AgNO3溶液
5.金属R放入稀硫酸中,没有气泡产生,放入硫酸铜溶液中,表面有红色物质析出。下列关于R的金属活动性判断不正确的是( )
A.R>Cu B.R>Fe
C.Zn>R D.R>Ag
6.化学趣味小组在学习了金属的化学性质后,对金属R的活动性进行探究发现:将金属R放入稀盐酸中,观察到有气泡产生(该反应的化学方程式可表示为R+2HCl===RCl2+H2↑),将R放入ZnSO4溶液中无任何变化。下列化学方程式书写错误的是( )
A.R+MgSO4===RSO4+Mg
B.R+CuSO4===RSO4+Cu
C.R+H2SO4===RSO4+H2↑
6
D.2Al+3RSO4===Al2(SO4)3+3R
7. 分别把X、Y、Z三种金属加入稀盐酸中,只有Z表面无现象,Y加入X的硝酸盐溶液中,有X析出,则三种金属的活动性顺序是( )
A.Y>X>Z B.X>Y>Z
C.X>Z>Y D.Z>Y>X
8.现有a、b、c三种金属,a、b分别与稀硫酸、c的硝酸盐溶液作用的现象如表所示:
金属
a
b
与稀硫酸作用
无反应
溶解并放出气体
与c的硝酸盐溶液作用
表面上析出c
表面上析出c
根据表中所给的实验结果,判断这三种金属活动性由强到弱的顺序正确的是( )
A.c、b、a B.a、b、c C.b、a、c D.a、c、b
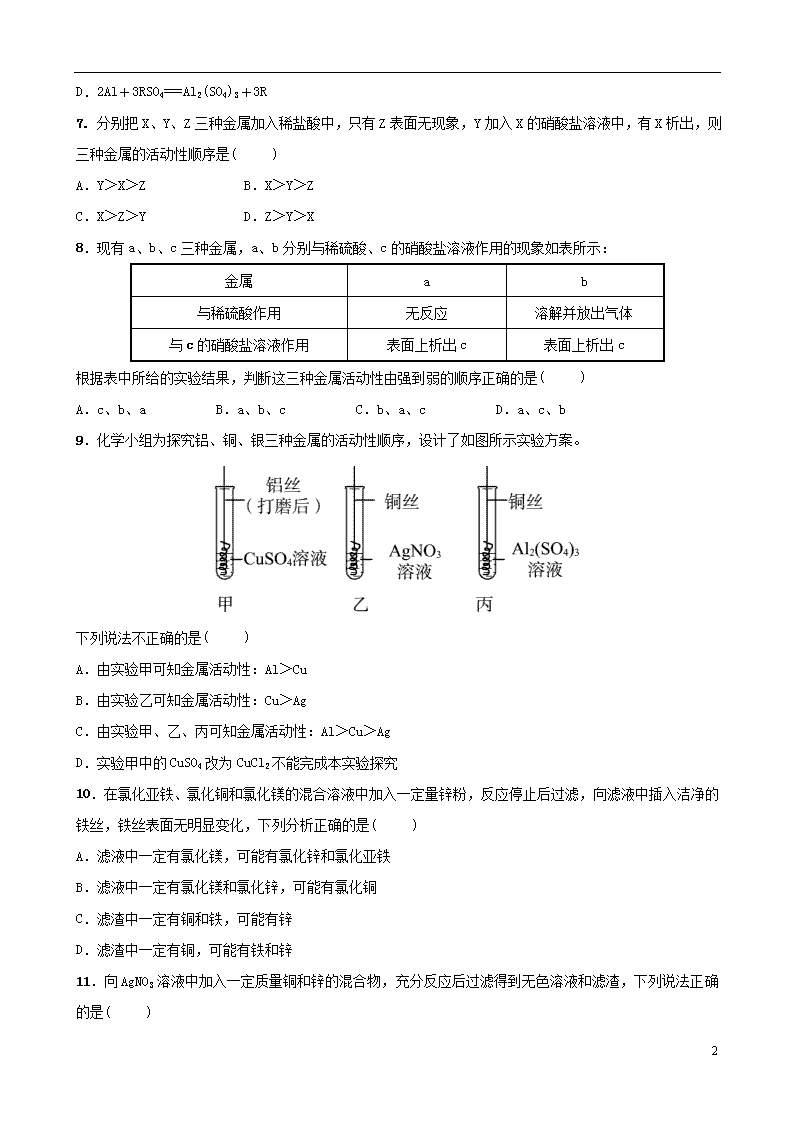
9.化学小组为探究铝、铜、银三种金属的活动性顺序,设计了如图所示实验方案。
下列说法不正确的是( )
A.由实验甲可知金属活动性:Al>Cu
B.由实验乙可知金属活动性:Cu>Ag
C.由实验甲、乙、丙可知金属活动性:Al>Cu>Ag
D.实验甲中的CuSO4改为CuCl2不能完成本实验探究
10.在氯化亚铁、氯化铜和氯化镁的混合溶液中加入一定量锌粉,反应停止后过滤,向滤液中插入洁净的铁丝,铁丝表面无明显变化,下列分析正确的是( )
A.滤液中一定有氯化镁,可能有氯化锌和氯化亚铁
B.滤液中一定有氯化镁和氯化锌,可能有氯化铜
C.滤渣中一定有铜和铁,可能有锌
D.滤渣中一定有铜,可能有铁和锌
11.向AgNO3溶液中加入一定质量铜和锌的混合物,充分反应后过滤得到无色溶液和滤渣,下列说法正确的是( )
6
A.反应后所得的溶液中一定含有Zn(NO3)2,一定不含Cu(NO3)2和AgNO3
B.反应后所得的溶液中一定含有Zn(NO3)2,可能含有Cu(NO3)2和AgNO3
C.反应后所得的滤渣中一定含有Ag,一定不含Cu和Zn
D.反应后所得的滤渣中一定含有Cu,可能含有Zn和Ag
12.活泼金属能将不活泼金属从其盐的水溶液中置换出来。与此类似,碳在高温下,能将不活泼金属从其氧化物中置换出来,但活泼金属形成的氧化物不与碳发生反应。如碳在高温下,能置换出氧化铁中的铁,但与氧化铝不反应。
(1)判断C、Fe、Al的活动性顺序由强到弱为__________________。
(2)结合所学知识,下列各组物质能发生置换反应的是________。
A.碳与氧化铜 B.锌与稀硫酸
C.碳与氧化钙 D.银与硫酸铜
13.如图为某小组探究金属化学性质的两组实验。
实验Ⅰ
实验Ⅱ
(1)实验Ⅰ中以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是________________。
(2)写出实验Ⅱ中C试管内反应的化学方程式_________________________
_________________________________________。
(3)实验Ⅱ中要验证Cu、Fe、Ag的金属活动性顺序,至少要做的实验是__________(填字母序号)。
14.将一定量的金属M(M是Mg、Al、Zn、Fe中的一种)粉末放入AgNO3和Cu(NO3)2的混合溶液中,充分反应后过滤,得到滤渣和无色滤液。向滤渣和滤液中分别滴加稀盐酸均无明显现象产生。
(1)金属M不可能是______(填名称)。
(2)滤渣中一定含有的金属是__________;无色滤液中含有的阴离子是________(填符号)。
15.金属是重要的资源,在日常生活中已得到越来越广泛的应用。
(1)铜常用于制作导线,因为其具有良好的__________。
(2)将纯铝和铝合金相互刻画,纯铝上留下明显的划痕,说明_________________________________________________________________。
6
(3)对汽车的部分钢铁部件进行喷漆可以防止其生锈,原因是__________________________________________________________________。
(4)如图,向一定量AgNO3溶液中加入铜和锌的混合粉末,充分反应后过滤,得溶液甲和固体乙。
①若乙中含有锌、铜、银三种固体,则溶液甲中所含的金属离子符号为____________;此时向固体乙中加入稀盐酸,发生反应的化学方程式为__________________________________________,该反应类型为________反应;
②若溶液甲显蓝色,是因为___________________________________________
__________________________(用化学反应方程式表示),此时固体乙中一定含有的物质是_______________________________________________________。
16.现有FeCl3和CuCl2的混合溶液195.2 g,向其中加入铁粉,反应的先后顺序为2FeCl3+Fe===3FeCl2,CuCl2+Fe===FeCl2+Cu。加入铁粉质量与反应后溶液中剩余固体质量的关系如图所示。
(1)m(剩余固体)>6.4 g时,剩余固体的成分是______________(填化学式),此剩余固体加入盐酸,发生反应的化学方程式为_____________________________
______________________。
(2)原FeCl3和CuCl2的混合溶液中FeCl3的质量为____________g。
(3)求当加入11.2 g铁粉时,反应后所得溶液中FeCl2的质量分数(写出计算过程)。
6
参考答案
1.C 2.D 3.D 4.B 5.B 6.A 7.A 8.C 9.D 10.D 11.A
12.(1)Al>C>Fe (2)AB
13.(1)酸的种类不同 (2)Cu+2AgNO3===Cu(NO3)2+2Ag (3)CD
14.(1)铁 (2)银、铜 NO
15.(1)导电性 (2)铝合金的硬度比纯铝大 (3)隔绝空气 (4)①Zn2+ Zn+2HCl===ZnCl2+H2↑ 置换 ②Cu+2AgNO3===Cu(NO3)2+2Ag Ag
16.(1)Cu和Fe Fe+2HCl===FeCl2+H2↑ (2)32.5
(3)解:设FeCl3与Fe反应生成FeCl2的质量为x,CuCl2与Fe反应生成FeCl2的质量为y,生成Cu的质量为z。
CuCl2与Fe反应中消耗Fe的质量为
11.2 g-5.6 g=5.6 g。
2FeCl3+Fe===3FeCl2
56 381
5.6 g x
=
x=38.1 g
CuCl2+Fe===FeCl2+Cu
56 127 64
5.6 g y z
6
=
y=12.7 g
=
z=6.4 g
则FeCl2的质量为38.1 g+12.7 g=50.8 g
溶液的质量为195.2 g+11.2 g-6.4 g=200 g
FeCl2的质量分数为×100%=25.4%
答:反应后所得溶液中FeCl2的质量分数为25.4%。
6