- 1.14 MB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2011北京市高级中等学校招生考试
化学试卷
一、选择题(每小题只有1个选项符合题意。共25个小题,每小题1分,共25分)
1. 下列变化中,属于化学变化的是( )
A. 矿石粉碎 B. 纸张燃烧 C. 酒精挥发 D. 冰雪融化
2. 空气成分中,体积分数约占78%的是( )
A. 氮气 B. 氧气 C. 二氧化碳 D. 稀有气体
3. 决定元素各类的是( )
A. 中子数 B. 质子数 C. 核外电子数 D. 最外层电子数
4. 下列物质中,属于纯净物的是( )
5. 下列金属中,活动性最强的是( )
A. 镁 B. 铜 C. 锌 D. 铝
6. 每年5月31日为世界无烟日,吸烟有害健康,烟气中的一种有毒气体是( )
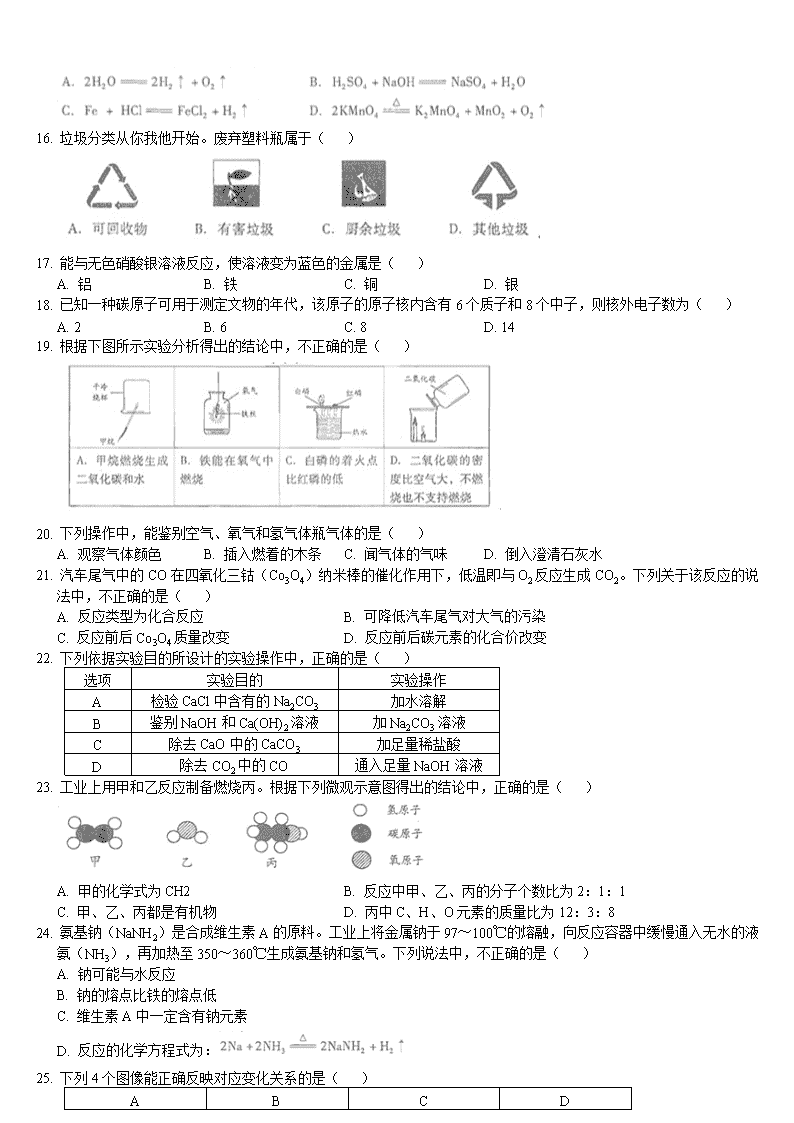
A. O2 B. N2 C. CO D. CO2
7. 氢氧化钠是重要的化工原料,其俗称是( )
A. 纯碱 B. 烧碱 C. 小苏打 D. 熟石灰
8. 下列物质中,能用作钾肥的是( )
A. K2SO4 B. CO(NH2)2 C. NH4NO3 D. Ca(H2PO4)2
9. 下列物质敞口放置,质量会减轻的是( )
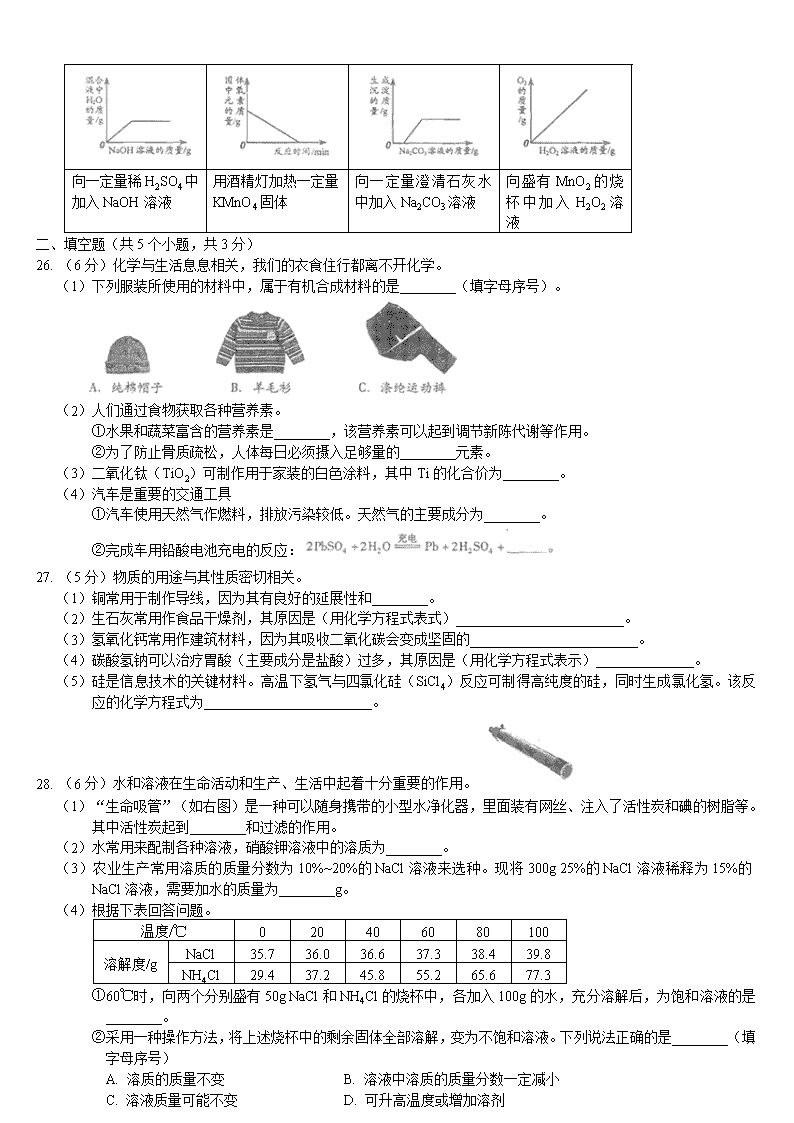
A. 氢氧化钠 B. 浓硫酸 C. 浓盐酸 D. 碳酸钙
10. 下列做法中,不利于保护水资源的是( )
A. 使用节水型马桶 B. 合理使用农药和化肥
C. 生活污水任意排放 D. 工业废水处理达标后排放
11. 小刚测定了下列4种日用品的pH,其中呈酸性的是( )
日用品
A. 洁厕灵
B. 洗涤灵
C. 洗发水
D. 消毒液
pH
1
7
9
12
12. 下列物质性质的表述中,属于化学性质的是( )
A. 氧气无色无味 B. 铝呈银白色 C. 蔗糖易溶于水 D. 碳酸易分解
13. 下列物质中,含有氧分子的是( )
A. O2 B. H2O C. CO2 D. H2O2
14. 下列实验操作中,正确的是( )
15. 下列化学方程式中,书写正确的是( )
16. 垃圾分类从你我他开始。废弃塑料瓶属于( )
17. 能与无色硝酸银溶液反应,使溶液变为蓝色的金属是( )
A. 铝 B. 铁 C. 铜 D. 银
18. 已知一种碳原子可用于测定文物的年代,该原子的原子核内含有6个质子和8个中子,则核外电子数为( )
A. 2 B. 6 C. 8 D. 14
19. 根据下图所示实验分析得出的结论中,不正确的是( )
20. 下列操作中,能鉴别空气、氧气和氢气体瓶气体的是( )
A. 观察气体颜色 B. 插入燃着的木条 C. 闻气体的气味 D. 倒入澄清石灰水
21. 汽车尾气中的CO在四氧化三钴(Co3O4)纳米棒的催化作用下,低温即与O2反应生成CO2。下列关于该反应的说法中,不正确的是( )
A. 反应类型为化合反应 B. 可降低汽车尾气对大气的污染
C. 反应前后Co3O4质量改变 D. 反应前后碳元素的化合价改变
22. 下列依据实验目的所设计的实验操作中,正确的是( )
选项
实验目的
实验操作
A
检验CaCl中含有的Na2CO3
加水溶解
B
鉴别NaOH和Ca(OH)2溶液
加Na2CO3溶液
C
除去CaO中的CaCO3
加足量稀盐酸
D
除去CO2中的CO
通入足量NaOH溶液
23. 工业上用甲和乙反应制备燃烧丙。根据下列微观示意图得出的结论中,正确的是( )
A. 甲的化学式为CH2 B. 反应中甲、乙、丙的分子个数比为2:1:1
C. 甲、乙、丙都是有机物 D. 丙中C、H、O元素的质量比为12:3:8
24. 氨基钠(NaNH2)是合成维生素A的原料。工业上将金属钠于97~100℃的熔融,向反应容器中缓慢通入无水的液氨(NH3),再加热至350~360℃生成氨基钠和氢气。下列说法中,不正确的是( )
A. 钠可能与水反应
B. 钠的熔点比铁的熔点低
C. 维生素A中一定含有钠元素
D. 反应的化学方程式为:
25. 下列4个图像能正确反映对应变化关系的是( )
A
B
C
D
向一定量稀H2SO4中加入NaOH溶液
用酒精灯加热一定量KMnO4固体
向一定量澄清石灰水中加入Na2CO3溶液
向盛有MnO2的烧杯中加入H2O2溶液
二、填空题(共5个小题,共3分)
26. (6分)化学与生活息息相关,我们的衣食住行都离不开化学。
(1)下列服装所使用的材料中,属于有机合成材料的是________(填字母序号)。
(2)人们通过食物获取各种营养素。
①水果和蔬菜富含的营养素是________,该营养素可以起到调节新陈代谢等作用。
②为了防止骨质疏松,人体每日必须摄入足够量的________元素。
(3)二氧化钛(TiO2)可制作用于家装的白色涂料,其中Ti的化合价为________。
(4)汽车是重要的交通工具
①汽车使用天然气作燃料,排放污染较低。天然气的主要成分为________。
②完成车用铅酸电池充电的反应:
27. (5分)物质的用途与其性质密切相关。
(1)铜常用于制作导线,因为其有良好的延展性和________。
(2)生石灰常用作食品干燥剂,其原因是(用化学方程式表式)________________________。
(3)氢氧化钙常用作建筑材料,因为其吸收二氧化碳会变成坚固的________________________。
(4)碳酸氢钠可以治疗胃酸(主要成分是盐酸)过多,其原因是(用化学方程式表示)______________。
(5)硅是信息技术的关键材料。高温下氢气与四氯化硅(SiCl4)反应可制得高纯度的硅,同时生成氯化氢。该反应的化学方程式为________________________。
28. (6分)水和溶液在生命活动和生产、生活中起着十分重要的作用。
(1)“生命吸管”(如右图)是一种可以随身携带的小型水净化器,里面装有网丝、注入了活性炭和碘的树脂等。其中活性炭起到________和过滤的作用。
(2)水常用来配制各种溶液,硝酸钾溶液中的溶质为________。
(3)农业生产常用溶质的质量分数为10%~20%的NaCl溶液来选种。现将300g 25%的NaCl溶液稀释为15%的NaCl溶液,需要加水的质量为________g。
(4)根据下表回答问题。
温度/℃
0
20
40
60
80
100
溶解度/g
NaCl
35.7
36.0
36.6
37.3
38.4
39.8
NH4Cl
29.4
37.2
45.8
55.2
65.6
77.3
①60℃时,向两个分别盛有50g NaCl和NH4Cl的烧杯中,各加入100g的水,充分溶解后,为饱和溶液的是________。
②采用一种操作方法,将上述烧杯中的剩余固体全部溶解,变为不饱和溶液。下列说法正确的是________(填字母序号)
A. 溶质的质量不变 B. 溶液中溶质的质量分数一定减小
C. 溶液质量可能不变 D. 可升高温度或增加溶剂
29. (6分)人类的生产和生活都离不开金属。
(1)金属元素在自然界中分布很广,地壳中含量最多的金属元素是________。金属以矿物质形式存在,下列矿石的主要成分属于氧化物的是________(填化学式)。
(2)铁是应用最广泛的金属。
①工业常用赤铁矿和一氧化碳在高温条件下炼铁,该反应的化学方程式为_________________。
②使用过的菜刀、铁锅等铁制品,清洗后需要及时擦干放置,可以减少__________________对铁锈蚀的影响。
(3)将一定量的锌加入稀硫酸、硫酸亚铁和硫酸铜的混合溶液中,充分反应后过滤,向滤渣中加入盐酸,有气泡产生。滤渣和滤液中一定有的物质是________。
30. (7分)实验小组研究盐酸、氢氧化钙两种物质的化学性质,做了如下图所示8个实验。
(1)实验后某试管中为黄色溶液,该试管中发生反应的化学方程式为________________________。
(2)实验后某试管中为红色溶液,向其中加入足量的________,溶液变为无色。由此推断,该试管中最初盛有的物质是________。
(3)实验后某试管的底部有白色固体,过滤后向滤液中滴加稀盐酸,一段时间后有气泡出现。由此推断,该试管中最初发生反应的化学方程式为________________________。
(4)实验后某试管中只得到无色溶液,向其中加入跑题的Na2CO3溶液,无明显现象。由此推断,该试管中最初发生反应的化学方程式为________________________,原无色溶液中的溶质是________(写出所有可能)。
三、实验题(共3个小题,共19分)
31. (6分)实验室制取气体所需的装置如下图所示。
请回答以下问题。
(1)实验仪器a的名称是________。
(2)用过氧化氢溶液和二氧化锰抽取氧气的化学方程式为________________。用高锰酸钾制取氧气时,所选用的发生装置为________(填字母序号)。
(3)用大理石和衡稀盐酸制取二氧化碳的化学方程式为________________。用装置________(填字母序号)收集一瓶二氧化碳,将燃着的木条放在瓶口,若观察到________,说明瓶中已充满二氧化碳。
32. (5分)下图装置可以完成多个简单实验,具有药品用量少、实验现象明显、尾气不外逸等优点。
(1)若甲中吸有浓氨水,乙中吸有无色酚酞溶液,将甲、乙中的液体同时挤出,一段时间后,观察到无色酚酞溶液变红,说明分子具有的性质是________。
(2)若甲中吸有水,乙中吸有稀硫酸,烧杯①中盛有用石蕊溶液染成紫色的干燥纸花,烧杯②中盛有碳酸钠粉末。为了验证使石蕊变色的物质是碳酸而不是二氧化碳,应采取的实验操作是________。
(3)若先将甲中的液体挤出,观察到气球明显鼓起,一段时间后恢复原状;再将乙中的液体挤出,气球又明显鼓起。请将下表中的试剂补充完整。
滴管甲
烧杯①
滴管乙
烧杯②
试剂
H2O
Mg
气球鼓起是因为装置内气压增大,两次气压增大的原因依次是________。
33. (8分)化学课上,同学们做了人体呼出的气体使澄清石灰水变浑浊的实验后,对呼出的气体中主要成分及含量非常好奇,设计实验进行探究。
【提出问题】呼出的气体中有哪些主要成分,它们的含量是多少?
【查阅资料】①呼出的气体中仍含有O2。
②CO2在饱和NaHCO3溶液中的溶解度非常小。
【猜想与实验】
猜想:呼出的气体中主要成分是N2、O2、CO2、水蒸气等。
实验I:验证呼出的气体中含有水蒸气。
(1)实验操作如右图所示。
(2)观察到的现象为________,根据该现象可以判断呼出的气体中含有水蒸气。
实验II:验证呼出的气体中含有N2、O2、CO2,并测定其含量。
同学们在老师的指导下设计了如下图所示装置(B是带刻度的量气装置)。
(1)实验记录
实验操作
主要实验现象
实验结论及解释
①
检查装置的气密性。
向装置中加入药品。
关闭止水夹a~f。
装置的气密性良好。
②
打开b、c、d,向B中吹入一定量气体后关闭d,并冷却到室温。
B中液体进入到A中,B中液体减少500mL。
收集500mL气体。
③
关闭b,打开a、e、f,用打气筒向A中缓缓充气,直到B中气体刚好全部排出。
________,D中液体为475mL。
反应的化学方程式________________。
④
关闭e、f,用凸透镜聚光引燃白磷。
白磷燃烧,产生大量白烟,放出大量热。
呼出的气体中含有O2。
⑤
待白磷熄灭并冷却到室温,打开f。
________,D中剩余液化为400mL。
呼出的气体中含有N2。
(2)数据处理
呼出的气体中主要成分的含量________________
C. 无色无味的气体 D. 不能燃烧,也不支持燃烧
(2)实验II操作⑤中,若C中气体未完全冷却就打开f并读数,则所测O2的体积分数________(填“偏小”、“不变”或“偏大”)
四、计算题(共2个小题,共6分)
34. (3分)氢化锂(LiH)为玻璃状无色透明固体,军事上用作氢气发生来源,反应的化学方程式为:。计算80g氢化锂与中量的水反应成氢气的质量。
35. (3分)请根据下图所示的实验过程和提供的数据,计算样品中钠元素的质量。
N2
O2
CO2
体积/mL
体积分数/%
同学们经过3次重复实验,确认了呼出气体中的主要成分及其含量。
【实验反思】
(1)该实验设计依据的N2性质有________(填字母序号)。