- 161.50 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
中考总复习:二氧化碳的性质、用途和制取归纳(基础)
【考纲要求】
1.掌握二氧化碳的化学性质和物理性质;了解二氧化碳的用途以及温室效应。
2.掌握实验室制取二氧化碳的原理、装置和操作要点。
【知识网络】
无色无味的气体
物理性质 密度比空气大
能溶于水
①一般情况下不能燃烧,也不支持燃烧,不能供给呼吸
②与水反应生成碳酸:CO2+H2O=H2CO3 碳酸能使紫色石蕊试液变红
二氧化碳 化学性质 ③能使澄清的石灰水变浑浊:CO2+Ca(OH)2=CaCO3↓+H2O
④与灼热的碳反应: C + CO22CO
①药品:大理石或石灰石和稀盐酸
②反应原理:CaCO3+2HCl=CaCl2+H2O+CO2↑
实验室制法 ③装置:固液不加热型
④收集方法:向上排空气法
⑤验满方法:用燃烧的木条放在瓶口,木条熄灭则满
⑥检验方法:通入澄清石灰水,石灰水变浑浊
工业制法:煅烧石灰石 CaCO3 CaO+CO2↑
用途:灭火,光合作用,化工原料,制冷剂
【考点梳理】
考点一、二氧化碳的性质和用途
1.物理性质:无色、无味的气体,密度比空气大,能溶于水,固态二氧化碳叫做干冰。
2.化学性质:
(1)一般情况下,二氧化碳不能燃烧,也不支持燃烧,不能供给呼吸。
(2)与水反应生成碳酸: CO2+H2O=H2CO3
碳酸不稳定,易分解:H2CO3 = H2O+ CO2↑
(3)能使澄清的石灰水变浑浊:CO2+Ca(OH)2=CaCO3↓+H2O 该反应用于检验二氧化碳;这也是久置装石灰水的试剂瓶壁有一层白膜的原因。
(4)与灼热的碳反应: C + CO22CO (吸热反应,既是化合反应又是氧化还原反应,CO2是氧化剂,C是还原剂)
3.用途:
(1)灭火(灭火器原理:Na2CO3+2HCl=2NaCl+H2O+CO2↑)既利用其物理性质(密度比空气大),又利用其
化学性质(不能燃烧,也不支持燃烧)。
(2)干冰用于人工降雨、制冷剂(利用干冰升华时要吸收大量的热)。
(3)气体肥料。
(4)光合作用。
(5)化工产品的原料。
4.二氧化碳对环境的影响:
⑴过多排放引起温室效应。
①造成温室效应的主要原因:人类消耗的化石能源急剧增加,森林遭到破坏等。
②减轻温室效应的措施:减少化石燃料的燃烧;植树造林;使用清洁能源等。
⑵由于二氧化碳不能供给呼吸,因此在人群密集的地方要注意通风换气。
要点诠释:
1.不要将“干冰”和“冰”混为一谈。在一定的条件下(加压降温),二氧化碳气体会变成固体,固态的二氧化碳叫“干冰”,“冰”是液态水在一定条件下变成的固态物质。
2.二氧化碳溶于水和二氧化碳与水反应在本质上是不同的,前者是二氧化碳以分子的形式存在于水中,后者是二氧化碳与水反应生成具有酸性的物质碳酸,前者是物理变化,后者是化学变化。
3.一般情况下,二氧化碳不能支持普通的物质燃烧,特殊情况下也能支持某物质燃烧,如镁等活泼金属在点燃的条件下,也能在二氧化碳中继续燃烧下去。
4.人在二氧化碳含量较高的环境中感到不适甚至死亡,不是因为二氧化碳有毒,而是因为二氧化碳不能供给呼吸。当空气中二氧化碳的含量超过正常含量时,会对人体健康产生影响,达到10%会使人窒息而死亡。
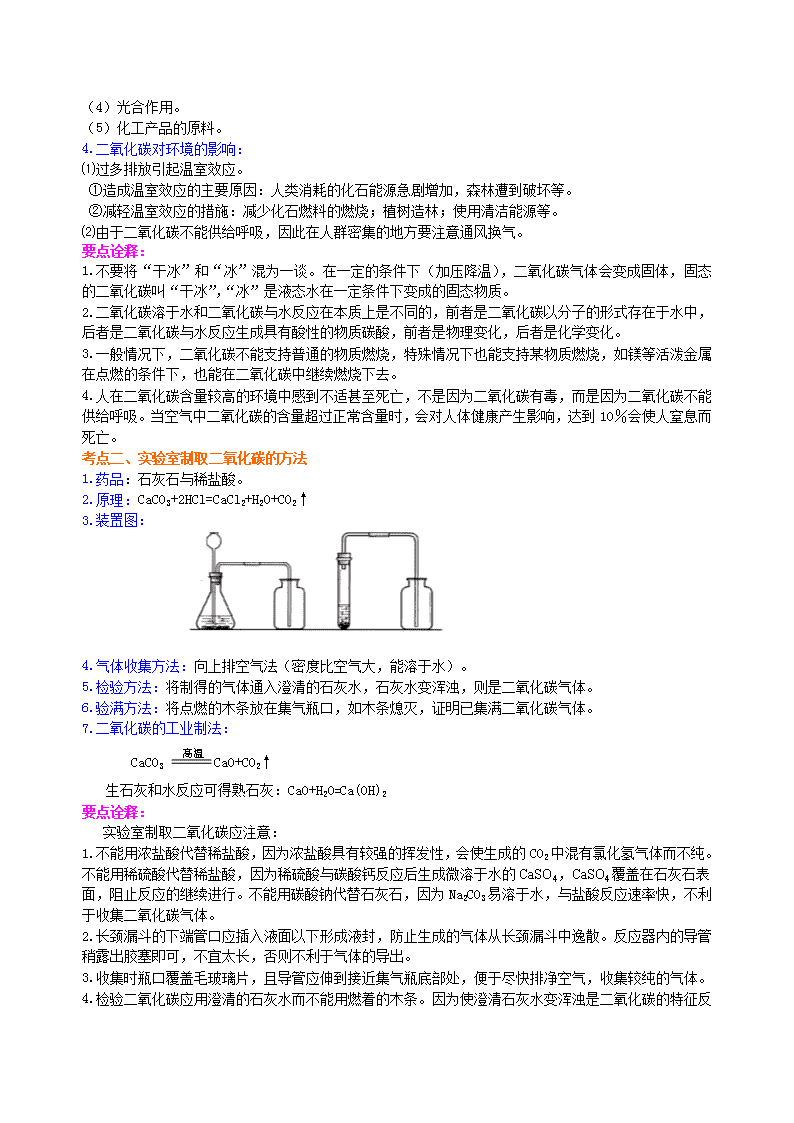
考点二、实验室制取二氧化碳的方法
1.药品:石灰石与稀盐酸。
2.原理:CaCO3+2HCl=CaCl2+H2O+CO2↑
3.装置图:
4.气体收集方法:向上排空气法(密度比空气大,能溶于水)。
5.检验方法:将制得的气体通入澄清的石灰水,石灰水变浑浊,则是二氧化碳气体。
6.验满方法:将点燃的木条放在集气瓶口,如木条熄灭,证明已集满二氧化碳气体。
7.二氧化碳的工业制法:
CaCO3 CaO+CO2↑
生石灰和水反应可得熟石灰:CaO+H2O=Ca(OH)2
要点诠释:
实验室制取二氧化碳应注意:
1.不能用浓盐酸代替稀盐酸,因为浓盐酸具有较强的挥发性,会使生成的CO2中混有氯化氢气体而不纯。
不能用稀硫酸代替稀盐酸,因为稀硫酸与碳酸钙反应后生成微溶于水的CaSO4,CaSO4覆盖在石灰石表面,阻止反应的继续进行。不能用碳酸钠代替石灰石,因为Na2CO3易溶于水,与盐酸反应速率快,不利于收集二氧化碳气体。
2.长颈漏斗的下端管口应插入液面以下形成液封,防止生成的气体从长颈漏斗中逸散。反应器内的导管稍露出胶塞即可,不宜太长,否则不利于气体的导出。
3.收集时瓶口覆盖毛玻璃片,且导管应伸到接近集气瓶底部处,便于尽快排净空气,收集较纯的气体。
4.检验二氧化碳应用澄清的石灰水而不能用燃着的木条。
因为使澄清石灰水变浑浊是二氧化碳的特征反应,而使燃着的木条熄灭的气体除了二氧化碳之外,还有氮气、稀有气体等。
【典型例题】
类型一、考查二氧化碳的性质和用途
1. 下列关于一氧化碳和二氧化碳的说法正确的是( )
A.都比空气重 B.都可以用碳和氧气反应得到
C.都有还原性 D.都能和澄清石灰水发生反应
【思路点拨】知道一氧化碳和二氧化碳的性质。
【答案】B
【解析】二氧化碳密度比空气大,一氧化碳密度比空气小;二氧化碳没有还原性,一氧化碳有还原性;二氧化碳能与澄清水灰水反应,一氧化碳不与澄清石灰水反应。ABC都不正确,只有B选项是正确的。
【总结升华】本题是考查学生对一氧化碳和二氧化碳的性质的理解与区别。如果同学们能对它们的性质理解得非常好,就可以顺利解题。
2.(2012江苏)下列有关鉴别二氧化碳、氧气的方法错误的是( )
A.观察气体颜色 B.用澄清石灰水
C.用带火星的木条 D.用紫色石蕊试液
【思路点拨】物质的鉴别要选择两种物质的典型性质的差异来进行。CO2和O2都是无色无味的气体,通过观察颜色不能将两者区别开来。
【答案】A
【解析】二氧化碳能使澄清的石灰水变浑浊,氧气不能使澄清的石灰水变浑浊;氧气能使带火星的小木条复燃,二氧化碳不能使带火星的小木条复燃;二氧化碳能使紫色石蕊试液变红,氧气不能使紫色石蕊
试液变红。故BCD都是正确的。
【总结升华】二氧化碳、氧气的性质、用途和制法是中考的重要考点,可采用对比的方法理解和记忆。
3.(2012江苏)下列关于二氧化碳的说法错误的是( )
A.二氧化碳可用于制碳酸类饮料
B.干冰(固体二氧化碳)可用于人工降雨
C.常温下二氧化碳是一种有刺激性气味的有毒气体
D.大气中二氧化碳的消耗途径主要是植物的光合作用
【思路点拨】本题考查了CO2的用途及相关性质的掌握情况。建议大家按“性质决定用途,用途反映性质”的规律梳理并识记CO2的性质和用途。
【答案】C
【解析】二氧化碳与水反应生成碳酸,碳酸具有酸性,所以二氧化碳可用于制碳酸类饮料。固体CO2叫做“干冰”,其升华时会吸收大量的热,因而具有很多重要的用途;而“冰”是水的固体,二者要注意区分。常温下二氧化碳是一种无色无味的气体,二氧化碳浓度过高会导致人窒息死亡,但二氧化碳本身是无毒的气体。
【总结升华】CO2的性质和用途是近年新课标中考中考查的一个热点问题,而且经常结合生活实际中遇到的实际问题出题。在今后的学习中,要注意怎样更好的将所学的化学知识应用到生活中,解决遇到的问题。
举一反三:
【变式1】自然界中存在氧循环和碳循环,其中能将二氧化碳转化为氧气的是( )
A.水的吸收 B.动植物的呼吸
C.光合作用 D.燃料的燃烧
【答案】C
【变式2】“雪碧”是一种无色的碳酸饮料,将少量“雪碧”滴入紫色石蕊试液中,然后再加热,溶液的颜色变化情况是( )
A.先变红后变紫 B.变红后颜色不再改变
C.先变无色后变红 D.先变蓝后变紫
【答案】A
类型二、考查二氧化碳的实验室制法
4.实验室制取二氧化碳可以选用的发生装置是( )
A B C D
【思路点拨】本题考查了气体制取装置的选择。弄懂整套装置的设计原理是解题的基础。
【答案】B
【解析】二氧化碳的实验室制法是固-液常温型。所以选择B的发生装置,A是固-固加热型,C是固-液加热型,D反应装置有错误。
【总结升华】本题考查实验室制取二氧化碳发生装置的选择,只要掌握发生装置的选择原则就能解决此题。选择气体发生装置时要根据反应物的状态和反应条件。
5.实验室制备二氧化碳气体的常用方法是( )
A.煅烧石灰石 B.点燃木炭
C.用石灰石与稀盐酸反应 D.碳酸分解
【思路点拨】本题考查实验室制取二氧化碳气体这一基本考点。熟悉实验装置、原理等是解题的关键。
【答案】C
【解析】煅烧石灰石,需要高温,条件要求比较高且要消耗燃料能源;燃烧木炭生成的气体不纯,往往含有二氧化碳、一氧化碳,甚至氧气,产物难以分离;碳酸不稳定,常温是只存在于溶液中,浓度很小,且易分解。所以A、B、D均不常用。由于石灰石与稀盐酸廉价易得、常温就可反应,反应速率适中,且生成的气体即使混有氯化氢、水蒸气,也较易除去。是实验室制取二氧化碳气体的常用方法。所以C正确。
【总结升华】实验室制取气体时药品选择依据是:低成本、条件易行、操作安全简单、便于控制、产物较纯、易于分离。
6.下列有关实验室制取二氧化碳的方法不合理的是( )
A.因为二氧化碳密度比空气大,故能用向上排空气法收集
B.因为二氧化碳能溶于水,故一般不用排水法收集
C.在发生装置中加人块状石灰石和硫酸
D.因为碳酸钙和盐酸在常温下即可迅速反应,故气体发生装置不需要加热
【思路点拨】掌握实验室制取二氧化碳的原理、装置和操作要点。
【答案】C
【解析】实验室是利用大理石或石灰石和稀盐酸反应来制取二氧化碳的,化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑。因为二氧化碳的密度比空气的密度大,所以用向上排空气法收集二氧化碳。硫酸和石灰石发生反应时生成的硫酸钙微溶于水,覆盖在石灰石的表面,阻止反应的进一步进行,导致不能得到大量的CO2。所以C不合理。
【总结升华】二氧化碳的实验室制法是中考常考的知识点。实验室制取二氧化碳,一般选用的试剂是稀盐酸和大理石(或石灰石),不用稀硫酸代替稀盐酸。
举一反三:
【变式1】下列有关二氧化碳的检验、制备和用途能达到目的的是( )
A.干冰用于人工降雨
B.二氧化碳气体通入紫色石蕊试液中,溶液变蓝
C.用块状石灰石和稀硫酸迅速制备大量二氧化碳
D.将燃着的木条伸入集气瓶,火焰立即熄灭,证明瓶内原有气体就是二氧化碳
【答案】A
【变式2】下图是化学实验中常用的几种装置。
请回答下列问题:
(1)指出有编号的仪器名称:① ,② 。
(2)利用上述A、 装置的组合可以制取二氧化碳气体,写出实验室制取该气体的化学反应方程式 。
【答案】
(1)①分液漏斗 ②集气瓶
(2)D CaCO3+2HCl=CaCl2+ H2O + CO2↑