- 82.50 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
实验探究与综合计算 专题复习
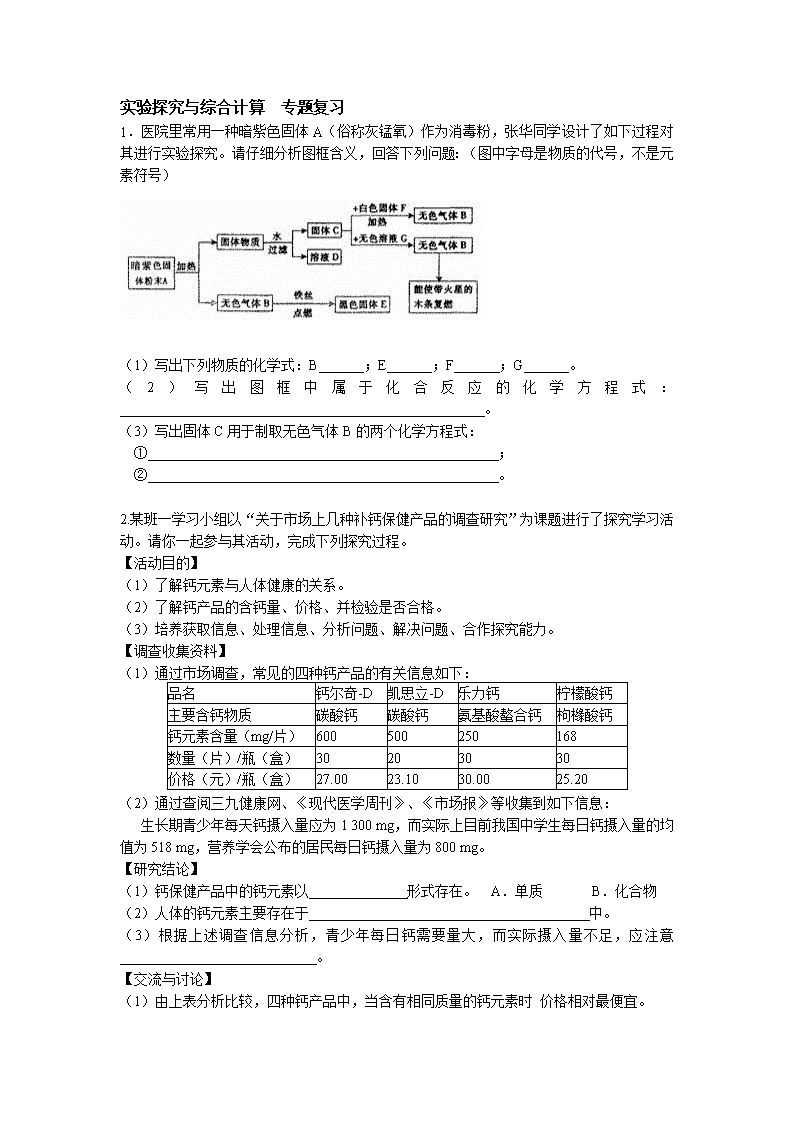
1.医院里常用一种暗紫色固体A(俗称灰锰氧)作为消毒粉,张华同学设计了如下过程对其进行实验探究。请仔细分析图框含义,回答下列问题:(图中字母是物质的代号,不是元素符号)
(1)写出下列物质的化学式:B ;E ;F ;G 。
(2)写出图框中属于化合反应的化学方程式: 。
(3)写出固体C用于制取无色气体B的两个化学方程式:
① ;
② 。
2.某班一学习小组以“关于市场上几种补钙保健产品的调查研究”为课题进行了探究学习活动。请你一起参与其活动,完成下列探究过程。
【活动目的】
(1)了解钙元素与人体健康的关系。
(2)了解钙产品的含钙量、价格、并检验是否合格。
(3)培养获取信息、处理信息、分析问题、解决问题、合作探究能力。
【调查收集资料】
(1)通过市场调查,常见的四种钙产品的有关信息如下:
品名
钙尔奇-D
凯思立-D
乐力钙
柠檬酸钙
主要含钙物质
碳酸钙
碳酸钙
氨基酸螯合钙
枸橼酸钙
钙元素含量(mg/片)
600
500
250
168
数量(片)/瓶(盒)
30
20
30
30
价格(元)/瓶(盒)
27.00
23.10
30.00
25.20
(2)通过查阅三九健康网、《现代医学周刊》、《市场报》等收集到如下信息:
生长期青少年每天钙摄入量应为1 300 mg,而实际上目前我国中学生每日钙摄入量的均值为518 mg,营养学会公布的居民每日钙摄入量为800 mg。
【研究结论】
(1)钙保健产品中的钙元素以 形式存在。 A.单质 B.化合物
(2)人体的钙元素主要存在于 中。
(3)根据上述调查信息分析,青少年每日钙需要量大,而实际摄入量不足,应注意 。
【交流与讨论】
(1)由上表分析比较,四种钙产品中,当含有相同质量的钙元素时 价格相对最便宜。
A.钙尔奇—D B.凯思立—D C.乐力钙 D.柠檬酸钙
(2)在交流过程中,小芳同学提出一个观点,补钙还可以食补,即能省钱又能补钙。下列做法可以补钙的是 。
A.在事物中添加生石灰 B.食用一些虾皮 C.喝排骨汤 D.做馒头时放纯碱
(3)小明认为食用凯思立-D的碳酸钙进入胃内能发生化学反应,其化学方程式是:
。
【质疑与再探究】
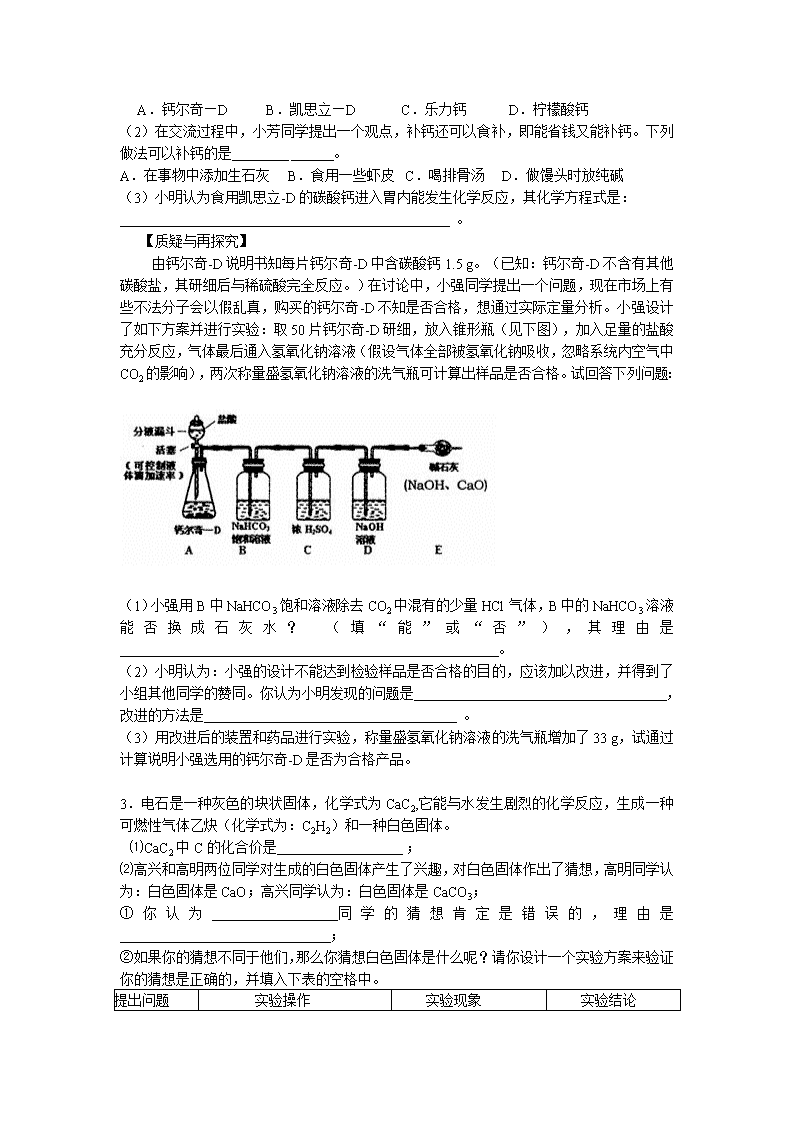
由钙尔奇-D说明书知每片钙尔奇-D中含碳酸钙1.5 g。(已知:钙尔奇-D不含有其他碳酸盐,其研细后与稀硫酸完全反应。)在讨论中,小强同学提出一个问题,现在市场上有些不法分子会以假乱真,购买的钙尔奇-D不知是否合格,想通过实际定量分析。小强设计了如下方案并进行实验:取50片钙尔奇-D研细,放入锥形瓶(见下图),加入足量的盐酸充分反应,气体最后通入氢氧化钠溶液(假设气体全部被氢氧化钠吸收,忽略系统内空气中CO2的影响),两次称量盛氢氧化钠溶液的洗气瓶可计算出样品是否合格。试回答下列问题:
(1)小强用B中NaHCO3饱和溶液除去CO2中混有的少量HCl气体,B中的NaHCO3溶液能否换成石灰水? (填“能”或“否”),其理由是 。
(2)小明认为:小强的设计不能达到检验样品是否合格的目的,应该加以改进,并得到了小组其他同学的赞同。你认为小明发现的问题是 ,改进的方法是 。
(3)用改进后的装置和药品进行实验,称量盛氢氧化钠溶液的洗气瓶增加了33 g,试通过计算说明小强选用的钙尔奇-D是否为合格产品。
3.电石是一种灰色的块状固体,化学式为CaC2,它能与水发生剧烈的化学反应,生成一种可燃性气体乙炔(化学式为:C2H2)和一种白色固体。
⑴CaC2中C的化合价是 ;
⑵高兴和高明两位同学对生成的白色固体产生了兴趣,对白色固体作出了猜想,高明同学认为:白色固体是CaO;高兴同学认为:白色固体是CaCO3;
①你认为 同学的猜想肯定是错误的,理由是 ;
②如果你的猜想不同于他们,那么你猜想白色固体是什么呢?请你设计一个实验方案来验证你的猜想是正确的,并填入下表的空格中。
提出问题
实验操作
实验现象
实验结论
白色固体
是什么?
4.某校小张、小明、小许三位同学在帮化学实验员整理药品时,发现药品包装箱里有两瓶化学药品的标签已脱落,从脱落的标签可知,这两瓶药品是碳酸钠和碳酸氢钠。为确定这两瓶药品到底哪一瓶是碳酸钠,哪一瓶是碳酸氢钠,三位同学开始了探究行动:
[上网查阅资料]资料摘要如下:
碳酸钠是白色粉末或细粒,加热至851 ℃时熔化而不分解。Na2CO3易溶于水,其水溶液呈碱性。…… 碳酸钠的最大用途是制玻璃,也是造纸、肥皂、洗涤剂、纺织、制革、石油、染料、食品等工业的重要原料。NaHCO3是白色粉末,在水中的溶解度比碳酸钠略小,水溶液呈微碱性,固体碳酸氢钠受热即分解,生成碳酸钠、二氧化碳和水,……,NaHCO3是发酵粉的主要成分,也用于制灭火剂、焙粉或清凉饮料等方面的原料,在橡胶工业中作发泡剂。
[实验方案及探究]根据以上信息及学过的知识,三位同学各自设计的实验方案及探究过程如下。填写下列空白。
[小张同学] 实验方案:将碳酸钠、碳酸氢钠分别溶于水,根据溶液的pH鉴别出两种药品。
结论及讨论:(1)小张同学测出两种溶液pH分别为10和8,则pH为10的是 溶液。
(2)水溶液呈碱性的物质一定是碱吗?(填 “一定”或“不一定”)。
[小明同学]实验方案:将碳酸钠、碳酸氢钠分别与盐酸发生反应,根据是否有气体生成鉴别出两种药品。
问题讨论:你认为小明同学的实验方案 (填“正确”或“不正确” ),理由是 (用化学方程式表示)。
[小许同学]实验方案:根据碳酸钠、碳酸氢钠加热是否分解
及生成的产物鉴别出两种药品
实验装置:如右图(图中显示的是加热NaHCO3的情况)
探究报告:小许同学设计的探究报告如下,请你帮他补充完整。
实验操作
实验现象
得出结论
5.某同学在实验室发现一瓶标签残缺(如图甲所示)的溶液。为了测定此溶液的溶质质量分数,他取出25 g该溶液,向其中逐滴加入溶质质量分数为10%的NaOH溶液。反应过程中生成沉淀的质量与所用NaOH溶液质量的关系如图乙所示。请计算此溶液的溶质质量分数。
6.保小组监测到一工厂向河中排放的酸性废液中含有CuSO4。为了测定废液中CuSO4的质量分数,该小组取了100 g废液,逐滴加入NaOH溶液至过量,测得生成Cu(OH)2沉淀的质量与所加NaOH溶液的质量关系如右图。
(1)说明图上OA段未生成Cu(OH)2沉淀的原因。______________________。
(2)计算废液中CuSO4的质量分数。
[参考答案]
1.(1)B:O2;E:Fe3O4;F:KClO3;G:H2O2
(2)3Fe+2O2 Fe3O4
(3)2KClO32KCl+3O2↑, 2H2O22H2O+O2↑ (化学式每空1分,方程式每空2分)
2.【研究结论】(1)B (2)骨骼和牙齿 (3)补钙等
【交流与议论】(1)A (2)BC (3)CaCO3+2HCl=CaCl2+H2O+CO2↑
【质疑与再探究】(1)不能,因为石灰水能吸收二氧化碳 干燥CO2 气体
防止空气中的二氧化碳进入D干扰实验结果
(2)NaHCO3饱和溶液吸收HCl时,要反应产生CO2,导致盛NaOH溶液的洗气瓶增重大于样品产生CO2的质量,无法计算样品是否合格。
将盐酸换成稀硫酸,将NaHCO3饱和溶液的洗气瓶去掉。(以上每空1分)
3.⑴-1 (2)① 高明 ②
提出问题
实验操作
实验现象
实验结论
白色固体
是什么?
取样, 溶于水, 通入二氧化碳
有白色沉淀
白色固体是
Ca(OH)2
4.小张同学:Na2CO3 不一定
小明同学:不正确 Na2CO3 + 2HCl == 2NaCl+ CO2↑+ H2O NaHCO3 + HCl == NaCl+ CO2↑+ H2O
小许同学:
实验操作
实验现象
得出结论
取样于试管中,分别加热
生成气体使石灰水变浑浊
粉末为NaHCO3
取样于试管中,分别加热
没有气体生成
粉末为Na2CO3
5.解:从图乙中获知,当MgSO4完全转化为沉淀时消耗NaOH溶液的质量为40 g。
设MgSO4的质量为x,则
MgSO4+2NaOH=Mg(OH)2↓+Na2SO4
120 80
x 40 g×10%
解得:x=6 g
该MgSO4溶液的溶质质量分数:=24%
6.(1)NaOH中和废液中的酸,生成可溶性钠盐和水………………(3分)
(2)解:设废液中CuSO4的质量为x
CuSO4+2NaOH ===Cu(OH)2 +Na2SO4…………………………….(2分)
160 98
x 1.96 g ……………………………………………(1分)
160 / 98 = X / 1.96 g……………………………………………(1分)
x=3.2g……………………………………………………………(1分)
废液中CuSO4的质量分数为:
(3.2/100)*100%=3.2%………………………………………… (2分)
答:废液中的CuSO4质量分数为3.2%。