- 278.00 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第一讲 常见的酸、碱、盐
【学习目标】
1. 理解酸碱盐定义和分类
2. 熟练掌握酸碱盐的物理性质
【知识要点】
一、 基本概念
1.电离:是指物质溶于水或在熔融状态下,原子、分子形成离子的过程。
2.酸的概念:
酸:电离时生成的阳离子全部是氢离子的化合物.
3.碱的概念
电离时生成的阴离子全部是OH-的化合物
4. 盐的概念
盐是指一类组成里含有金属离子(包括铵根离子)和酸根离子的化合物。
食盐就是盐是不正确的。科学上说的盐不仅仅指食盐,而是包括数量很大的一类金属离子和酸根离子组成的化合物(包括铵根离子),例如Na2CO3、KCl等。
二、常见的酸
1. 酸的分类和命名
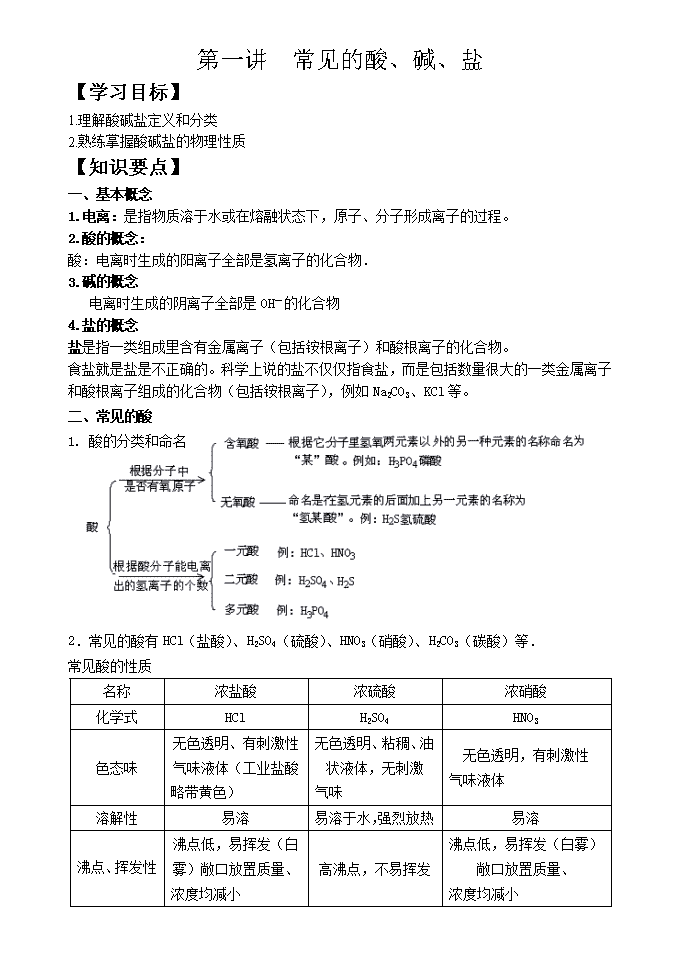
2.常见的酸有HCl(盐酸)、H2SO4(硫酸)、HNO3(硝酸)、H2CO3(碳酸)等.
常见酸的性质
名称
浓盐酸
浓硫酸
浓硝酸
化学式
HCl
H2SO4
HNO3
色态味
无色透明、有刺激性气味液体(工业盐酸
略带黄色)
无色透明、粘稠、油状液体,无刺激
气味
无色透明,有刺激性
气味液体
溶解性
易溶
易溶于水,强烈放热
易溶
沸点、挥发性
沸点低,易挥发(白雾)敞口放置质量、
浓度均减小
高沸点,不易挥发
沸点低,易挥发(白雾)敞口放置质量、
浓度均减小
吸水性
无
用作干燥剂,敞口放置质量增加、浓
度减小
无
脱水性
无
能使纸张、木材碳化
无
稳定性
稳定性酸,受热或见
光难分解
稳定性酸,受热或
见光难分解
见光或受热易分解
强氧化性
与氢前金属反应,放
出氢气
能与许多金属发生反应,但不生成氢气
3.浓硫酸的稀释
烧杯中先倒入水后倒入浓硫酸,“杯壁下流”并用玻璃棒搅拌。
氢氧化钠(NaOH)
氢氧化钙[Ca(OH)2]
颜色、状态
白色块状固体
白色粉末状固体
溶解性
易溶,且溶解时放出大量的热
微溶
腐蚀性
强腐蚀性
较强腐蚀性
俗名
苛性钠、火碱、烧碱
熟石灰、消石灰
用途
重要化工原料,应用于肥皂、石油、造纸、纺织、印染等工业;生活中可用来除油污
重要的建筑材料,也是一种工业原料.如漂白粉,农业上用于改良酸性土壤
三、常见的碱及其性质
四、酸碱指示剂
酸碱指示剂:石蕊和酚酞溶液叫酸碱指示剂,也简称指示剂,石蕊和酚酞是两种常用的指示剂,它们在酸碱中的变色情况下表所示:
溶
液
指
示
剂
酸溶液
碱溶液
中性溶液
紫色石蕊溶液
变红色
变蓝色
紫色
无色酚酞溶液
不变色(无色)
变红色
无色
五、几种常见盐
1. 碳酸钠
碳酸钠(Na2CO3)俗名纯碱或苏打,从组成上分析,应属于盐,但它溶于水后溶液显碱性,故又称为纯碱,是一种重要的化工原料,广泛用于玻璃、造纸和洗涤剂的生产等。
2.碳酸钙
用途:重要的建筑材料,也是一种补钙剂。
3.食盐
生活中重要的调味品,是人体生理活动必不可少的一种物质,每人每天约需3g~5g食
盐,食用过多不利于人体健康。
(1)存在:海水、盐湖、盐井、盐矿中。
(2)物理性质:白色晶体,易溶于水,溶解度随温度升高变化不大。
(3)用途:①医疗上用氯化钠配制生理盐水; ②农业上可以用氯化钠溶液来选种;
③工业上可以用氯化钠溶液来选种; ④生活中的调味品,用来腌渍蔬菜等;
⑤利用NaCl可以消除公路上的积雪等。
六、常见的干燥剂
1、浓硫酸可干燥:酸性气体(如:CO2、SO2、SO3、NO2、HCl、)
中性气体(如:H2、O2、N2、CO)
※不能干燥碱性气体(如:NH3)
2、氢氧化钠固体、生石灰、碱石灰可干燥:碱性气体(如:NH3)
中性气体(如:H2、O2、N2、CO)
※不能干燥酸性气体(如:CO2、SO2、SO3、NO2、HCl等)
3、无水硫酸铜固体遇水由白色变蓝色,可检验水的存在,并吸收水蒸气。
4.CaCl2, MgCl2等吸水性杂质
七、物质的溶解性
钾纳铵盐都可溶; 氯化物不溶氯化银
硫酸盐钙银微溶钡不溶;
硝酸盐遇水影无踪
碳酸盐除钾纳铵都不溶;
钾纳钡钙碱可溶
红褐铁,蓝絮铜;
其它沉淀白色呈
【典型例题】
例1 写出盐酸、硝酸、硫酸电离时的式子。
、 、 。
例2写出下列酸、碱、盐的化学式:
盐酸 硫酸 硝酸 碳酸 磷酸
氢氧化钠 氢氧化铁 氢氧化铜 石灰水
氨水 苛性钠 食盐 石灰石 硫酸钡
硫酸铜 纯碱
例3 含有少量杂质的某盐酸样品,经分析只含有H+、Cl-、SO42-,则杂质的化学式为 ,若测得溶液中Cl-、和SO 42-的个数为20:1,则H+与Cl-的个数比为 。
例4向滴有石蕊试液的稀盐酸中,慢慢滴入过量氢氧化钠溶液,石蕊颜色变化的是( )
A、红→蓝→紫 B、紫→蓝→红 C、蓝→紫→红 D、红→紫→蓝
例5下列对盐酸的性质叙述正确的是( )
A.浓盐酸是一种无色无味的液体 B.浓盐酸有挥发性
C.浓盐酸挥发在空气中会产生白烟 D.浓盐酸有强氧化性
例6把盛浓硫酸的试剂瓶敞口放置一段时间后,它的变化情况是( )
A.溶液变浓了 B.质量变小了 C.溶液中溶质质量分数变小 D.不变
例7下列物质久置于敞口容器中,发生变质的是( )
A.浓盐酸 B.浓硫酸 C.食盐水 D.氢氧化钠溶液
例8.人体口腔内唾液的pH通常约为7,在进食过程的最初10分钟,酸性逐渐增强,之后酸性逐渐减弱,至40分钟趋于正常。与上述事实最接近的图象是 ( )
【经典练习】
1.下列几种酸的命名正确的是( )
A. HClO3 氯酸 B. H2S 硫酸 C. H2CO3 氢碳酸 D. H2SO4 亚硫酸
2.下列说法正确的是( )
① 浓盐酸会在空气中形成白烟;② 液态氯化氢就是盐酸;
③ 盐酸遇石蕊变红;④ 浓盐酸受热易分解。
A. ① B. ②和③ C. ③和④ D. 都不对
3.盐酸的下列性质,与它在溶液中电离生成的氢离子无关的是( ).
A.可以使紫色石蕊试液变红 B.可以和锌反应生成氢气
C.可以和硝酸银溶液反应生成氯化银沉淀 D.可以和氧化铜反应生成氯化铜和水
4.pH试纸可测定物质的_________,测定的方法是用________蘸取少许待测物质的溶液滴在_________上,将试纸显示的颜色与________进行对照,看与哪种颜色最接近,从而得出该物质的pH.
5.人体内一些液体的近似pH值如下:血浆7.35~7.45,胆汁7.1~7.3,胰液7.5~8.0,胃液0.9~1.5,其中一种液体呈酸性,该液体是( )
A.血浆 B.胆汁 C.胰液 D.胃液
6.醋酸、柠檬酸等都是食品加工中常用的酸,它们在水溶液中都能电离生成( )
A. B. C. D.
7.下表是某酸碱指示剂在不同的pH范围内显示的颜色( )
颜色
红
橙
绿
蓝
紫
pH范围
1~3
4~5
6~7
8~10
11~14
向滴有少量该指示剂的稀盐酸中逐滴加入氢氧化钠溶液,出现的颜色变化是( )
A.由红到蓝 B.由绿到橙 C.由蓝到绿 D.由紫到红
*8.溶液的碱性强弱跟溶液中OH-的数量有关。一定体积的溶液中OH-
数量越多,则溶液碱性越强。10%的NaOH溶液(密度为1.1g/cm3)与10%的KOH溶液(密度也为1.1g/cm3)相比较,碱性更强的是
A.NaOH B.KOH C.一样强 D.无法比较
9.酸在水中电离时,生成的阳离子都是________,同时生成的阴离子叫__________.如叫_________,叫__________,叫____________,是盐酸的酸根,叫_____________离子,酸根不一定是原子团.
10.向实验仪器点滴板的四个井穴分别滴加氢氧化钠、氢氧化钾、氢氧化钙和碳酸钠四种溶液各三滴,再各加1滴紫色石蕊试液,观察到四种溶液均变为蓝色。
(1)本实验说明这四种溶液的pH_________7 (填“<、=、>”)。
(2)根据此实验的现象你还能得出的结论是_________________________________
11.往氢氧化钠溶液里加入1-2滴酚酞试液,然后逐滴滴入稀盐酸,直到反应完成。在整个过程中溶液的颜色变化为( )
A红色——无色——红色 B红色——无色——无色
C无色——红色——无色 D无色——蓝色——无色
12.某溶液能使紫色石蕊试液变蓝色,则该溶液能使无色酚酞试液变( )
A红色 B无色 C蓝色 D紫色
13.能把氢氧化钙溶液、稀硝酸、水三种无色液体区别开来的一种试剂是( )
A酚酞试液 B石蕊试液 C蓝色石蕊试纸 D红色石蕊试纸
14.固体NaOH在实验室可用作干燥剂,这是利用了它的( )
A 物理性质 B 化学性质 C 碱性 D 腐蚀性
15.下列不能用NaOH固体来干燥的气体是( )
A H2 B CO C CO2 D O2
16.下列用途中,不属于氢氧化钙的是( )
A在农业上常用来改良酸性土壤. B用作建筑材料,用来抹墙.
C常用来检验二氧化碳气体的存在。 D广泛用于制肥皂、造纸等工业。
17. 实验测得生活中常见物质的pH如下,其中能使紫色石蕊溶液变红的是 ( )
A.肥皂水:9.5~10.5 B.食盐水:7 C.牙膏:8~9 D.橘子汁:3~4
18.在我国南方一些地区,分布着酸性土壤,不适宜某些作物生长。为改良作物生长条件,当地的农民常用来中和土壤酸性的物质是( )
A.石灰石 B、熟石灰 C、烧碱 D、醋酸
19.下列几种溶液久置于空气中,溶质成分不变,但溶质的质量分数减小且溶液质量增加的是( )
A. 浓硫酸 B. 浓盐酸 C. 浓硝酸 D. 石灰水
20.将一定质量分数的硫酸溶液加水稀释,下图正确表示PH变化的是( )
21.浓盐酸和浓硝酸均有______性,所以敞口放置,质量会______;浓H2SO4稀释时,要将______慢慢沿杯倒入______中,不能将______很快倒入______中,否则将会使____________,造成危险。浓硫酸沾到衣服上、纸张上,会变焦,是由于浓硫酸有______性,浓硫酸可以干燥H2或O2,是由于它有______性,浓H2SO4和硝酸(浓或稀)和金属反应均无H2产生,是由于它们具有______性。
22.几种物质的化学式及其名称分别是:Na2S2O3硫代硫酸钠;CaSx多硫化钙;BaO2过氧化钡。根据上述命名规律K2CS3的名称应为( )
A.三硫代碳酸钾 B.多硫碳化钙肥 C.过硫碳酸钾 D.超硫碳酸钾
【课后作业】
1.食盐的化学名称叫 ,化学式为 .碳酸钠俗称 ,
碳酸钠化学式为 .
2.下列说法中正确的是( )
A.能电离出H+的化合物一定是酸 B. 含有酸根的物质一定是酸
C.盐中一定含有酸根离子 D. 能电离出OH-的化合物一定碱
3.下列物质中,属于盐类的是( )
A.氧化镁 B. 氢氧化铜 C. 盐酸 D. 氯化钾
4.下列关于酸、碱、盐组成的说法中,不正确的是( ).
A.酸、碱、盐都是化合物 B. 酸、碱、盐都可能不含金属元素
C.酸、盐可能含氧,碱一定含氧 D. 盐一定含金属元素,酸、碱不一定含金属元素
5.鱼胆弄破后会使鱼肉粘上难溶于水的胆汁(一种酸)而变苦,要减少这种苦味,用来先涤的
最佳物质是( ).
A.水 B. 纯碱 C. 食盐 D. 食醋
6.正常雨水与酸雨的差异是( )
A、正常雨水显中性,酸雨显酸性
B、正常雨水的pH约为5.6,酸雨的pH<5.6
C、正常雨水不含杂质,酸雨降在城市
D、正常雨水降在农村,酸雨降在城市
7.如图为喷墨打印机工作原理示意图,溶解在打印墨水(pH:7.5~9.0)中的染料,从喷嘴喷到打印纸(pH:4.5~6.5)上,变为不溶于水的固体,下列说法正确的是( )
A、 打印墨水偏酸性 B、打印墨水显中性
C、打印纸偏酸性 D、打印纸偏碱性
8.将pH试纸用水湿润后测定某溶液的酸碱度,所测得溶液的pH与实际情况相比,结果是( )
A、相等 B、偏大 C、偏小 D、三种结果均有可能
9.现有化学药品:锌、稀硝酸、浓硫酸、盐酸、苛性钠、生石灰、纯碱。能与锌、纯碱保存在同一药橱中的是( ) C
A.稀硝酸、浓硫酸、盐酸 , B.生石灰、稀硝酸
C.苛性钠、生石灰 D.稀硝酸、浓硫酸、盐酸、苛性钠、生石灰
10用pH试纸测定食用白醋的酸碱度,如果先将pH试纸用蒸馏水润湿后,再把白醋滴在试纸上,测得的pH与白醋实际pH比较 ( )
A.前者偏高 B.前者偏低
C.两者相等 D.难于确定何高何低
11农药波尔多液是苹果、葡萄等生长过程中经常使用的杀灭霉菌的药剂,该农药配制方法是将石灰乳和硫酸铜溶液按一定比例混合即可。据此判断,下列叙述正确的是
A.硫酸铜属于盐类 B.石灰乳的pH 小于7
C.配制过程中不发生化学反应 D.波尔多液属于溶液
12.下列气体中既可以用浓硫酸干燥,又可以用NaOH固体干燥的是( )
A、SO2 B、H2 C、CO2 D、NH3