- 369.50 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
中考化学探究题
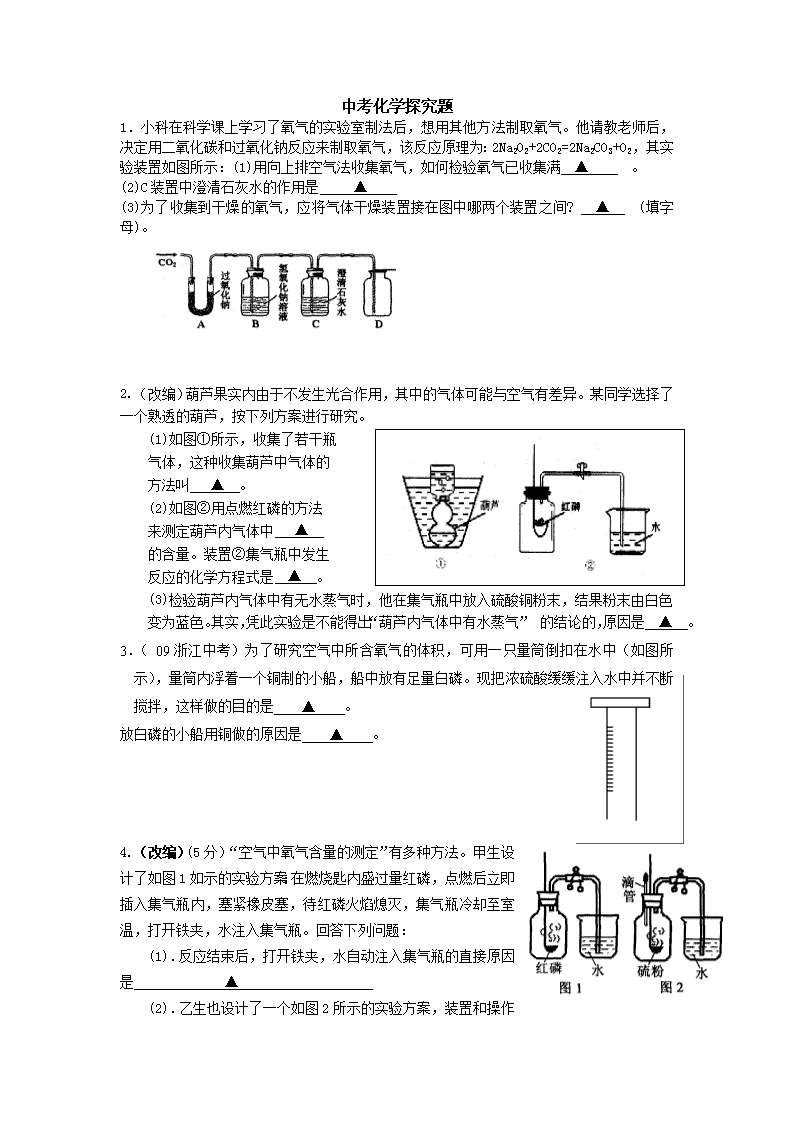
1.小科在科学课上学习了氧气的实验室制法后,想用其他方法制取氧气。他请教老师后,决定用二氧化碳和过氧化钠反应来制取氧气,该反应原理为:2Na202+2C02=2Na2C03+02,其实验装置如图所示:(1)用向上排空气法收集氧气,如何检验氧气已收集满 ▲ 。
(2)C装置中澄清石灰水的作用是 ▲
(3)为了收集到干燥的氧气,应将气体干燥装置接在图中哪两个装置之间? ▲ (填字母)。
2.(改编)葫芦果实内由于不发生光合作用,其中的气体可能与空气有差异。某同学选择了一个熟透的葫芦,按下列方案进行研究。
(1)如图①所示,收集了若干瓶
气体,这种收集葫芦中气体的
方法叫 ▲ 。
(2)如图②用点燃红磷的方法
来测定葫芦内气体中 ▲
的含量。装置②集气瓶中发生
反应的化学方程式是 ▲ 。
(3)检验葫芦内气体中有无水蒸气时,他在集气瓶中放入硫酸铜粉末,结果粉末由白色变为蓝色。其实,凭此实验是不能得出“葫芦内气体中有水蒸气” 的结论的,原因是 ▲ 。
3.( 09浙江中考)为了研究空气中所含氧气的体积,可用一只量筒倒扣在水中(如图所示),量筒内浮着一个铜制的小船,船中放有足量白磷。现把浓硫酸缓缓注入水中并不断搅拌,这样做的目的是 ▲ 。
放白磷的小船用铜做的原因是 ▲ 。
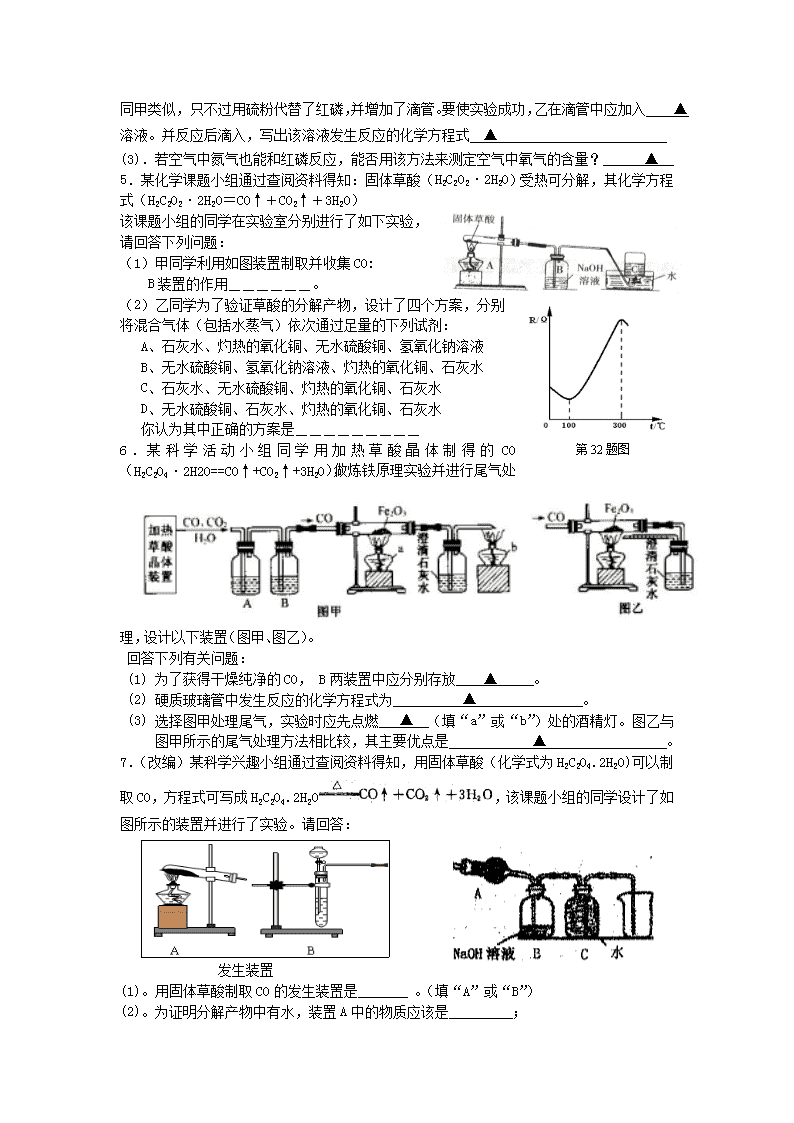
4.(改编)(5分)“空气中氧气含量的测定”有多种方法。甲生设计了如图1如示的实验方案:在燃烧匙内盛过量红磷,点燃后立即插入集气瓶内,塞紧橡皮塞,待红磷火焰熄灭,集气瓶冷却至室温,打开铁夹,水注入集气瓶。回答下列问题:
(1).反应结束后,打开铁夹,水自动注入集气瓶的直接原因是 ▲
(2).
乙生也设计了一个如图2所示的实验方案,装置和操作同甲类似,只不过用硫粉代替了红磷,并增加了滴管。要使实验成功,乙在滴管中应加入 ▲ 溶液。并反应后滴入,写出该溶液发生反应的化学方程式 ▲
(3).若空气中氮气也能和红磷反应,能否用该方法来测定空气中氧气的含量? ▲
5.某化学课题小组通过查阅资料得知:固体草酸(H2C2O2·2H2O)受热可分解,其化学方程式(H2C2O2·2H2O=CO↑+CO2↑+3H2O)
该课题小组的同学在实验室分别进行了如下实验,
请回答下列问题:
(1)甲同学利用如图装置制取并收集CO:
B装置的作用______。
第32题图
(2)乙同学为了验证草酸的分解产物,设计了四个方案,分别
将混合气体(包括水蒸气)依次通过足量的下列试剂:
A、石灰水、灼热的氧化铜、无水硫酸铜、氢氧化钠溶液
B、无水硫酸铜、氢氧化钠溶液、灼热的氧化铜、石灰水
C、石灰水、无水硫酸铜、灼热的氧化铜、石灰水
D、无水硫酸铜、石灰水、灼热的氧化铜、石灰水
你认为其中正确的方案是_________
6.某科学活动小组同学用加热草酸晶体制得的CO(H2C204·2H20==CO↑+C02↑+3H20),做炼铁原理实验并进行尾气处理,设计以下装置(图甲、图乙)。
回答下列有关问题:
(1) 为了获得干燥纯净的CO, B两装置中应分别存放 ▲ 。
(2) 硬质玻璃管中发生反应的化学方程式为 ▲ 。
(3) 选择图甲处理尾气,实验时应先点燃 ▲ (填“a”或“b”)处的酒精灯。图乙与图甲所示的尾气处理方法相比较,其主要优点是 ▲ 。
7.(改编)某科学兴趣小组通过查阅资料得知,用固体草酸(化学式为H2C2O4.2H2O)可以制取CO,方程式可写成H2C2O4.2H2O,该课题小组的同学设计了如图所示的装置并进行了实验。请回答:
发生装置
(1)。用固体草酸制取CO的发生装置是 。(填“A”或“B”)
(2)。为证明分解产物中有水,装置A中的物质应该是 ;
(3)。实验中采用“压水法”收集CO(装置C);从CO的物理性质考虑,是因为 。
水
红磷磷
图甲
图乙
水
8.用来测定空气成分的方法很多, 图甲所示的是用红磷在空气中燃烧的测定方法。实验过程是:
第一步:将集气瓶容积划分为五等份,并做好标记。
第二步:点燃燃烧匙内的红磷,伸入集气瓶中并把塞子塞紧。
第三步:待红磷熄灭并冷却后,打开弹簧夹,发现水被吸入集气瓶中,进入集气瓶中水的体积约为集气瓶总容积的1/5。
请回答下列问题:
⑴集气瓶中剩余的气体主要是 。
⑵实验完毕,若进入集气瓶中水的体积不到总容积的
1/5,你认为导致这一结果的原因可能是: 。
⑶某同学对实验进行反思后,提出了改进方法(如图
乙所示 ),你认为改进后的优点是: 。
9.某实验室的废水中含有大量AgNO3、Zn(NO3)2和Fe(NO3)2,课外小组同学欲从该废液中回收银,并得到副产品硫酸亚铁晶体。实验方案如下:
(1)固体甲中含有的物质是(填化学式) ;溶液乙中溶质的化学式是 。
(2)写出步骤①的化学方程式: 。
(3)检验步骤①向废水中加入A是否过量的方法是 。
1. (1) 用带火星的木条在集气瓶口,若复燃则已满 .
(2) 检验二氧化碳是否被除尽 . (3) C和D
2、
3.浓硫酸溶于水放热,使白磷的温度达到着火点。(2分)
铜是热的良导体且不与稀硫酸反应。 (2分)
4. ⑴ 瓶内气压小于外界大气压
⑵ 碱溶液(或NaOH等溶液) 2NaOH + SO2 Na2SO3 + H2O
(3) 不能
5.(1) 吸收CO2 (2) D
6.⑴ 浓硫酸 ⑵ ⑶ b 节约能源(答案合理即可)
7.(1) A (2) 白色的无水硫酸铜粉末 (3) 难溶于水
8.(1) 氮气 (2) 红磷的量不足(或装置漏气等)
(3) 装置始终密闭,空气没有逸出,实验结果准确
9.(1)Ag、Fe Zn(NO3)2、Fe(NO3)2 (2)Fe +2AgNO3 === Fe (NO3)2+2Ag(3)取少量上层清液,加入少量铁,若铁表面有固体析出,则A不过量,若铁表面无固体析出,则A过量。